Se cree que el uso de criterios de valoración indirectos en la regulación de fármacos reduce el tiempo necesario para la comercialización de nuevos medicamentos; sin embargo, de los fármacos aprobados con base en estos resultados, solo unos pocos demuestran posteriormente que aportan mejoras significativas en la supervivencia global (SG).
Si la FDA y otros organismos reguladores priorizaran los resultados centrados en el paciente [1], probablemente se comercializarían menos medicamentos, pero serian de mayor calidad, y es posible que las decisiones de aprobación fueran más rápidas, ya que las nuevas terapias se probarían inicialmente en líneas posteriores de tratamietno y en pacientes con peor pronóstico.
La FDA y la EMA han aprobado más de 400 fármacos oncológicos (autorizaciones únicas de comercialización) en las últimas dos décadas [2].
La mayoría de los medicamentos se han aprobado sin demostrar que mejoran la Supervivencia Global (SG) ni la calidad de vida de los pacientes, sino que se han aprobado por su capacidad para reducir el tamaño tumoral en algunos pacientes (Tasa de Respuesta Objetiva, TRO) o por retrasar eventos compuestos por varias variables, como la muerte y la reaparición del tumor (Supervivencia Libre de Enfermedad, SLE), o el crecimiento del tumor más allá de un umbral predefinido (Supervivencia Libre de Progresión, SLP).
Investigaciones previas han demostrado que estos criterios de valoración indirectos conllevan una incertidumbre considerable en relación al alcance del beneficio [3]. No todos los fármacos que mejoran la SLP, la SLE o la TRO ayudan a las personas con cáncer a vivir más tiempo o a tener una mejor calidad de vida [4]. De hecho, tras 4,4 años en el mercado de EE UU, solo el 14 % de los fármacos aprobados con base a estos criterios de valoración indirectos mostraron beneficios en la supervivencia [4].
Un argumento sugiere que utilizar variables subrogadas es beneficioso porque podría acelerar la velocidad con la que se comercializan los fármacos. Sin embargo, en un análisis de meta regresión, mis colegas y yo encontramos que las aprobaciones en base a criterios subrogados no ahorraron tiempo cuando se aplicaron a pacientes en etapas avanzadas de la enfermedad o en recaída tras varias líneas de terapia, probablemente porque los resultados son tan graves que la supervivencia global (SG) puede medirse con la misma rapidez.
Aun así, en todos los entornos, utilizar variables subrogadas ahorró aproximadamente 11 meses, respecto a un plazo promedio de desarrollo de fármacos de 8 años [5]. La desventaja de este aumento en la velocidad de aprobación, por supuesto, es el aumento de la incertidumbre; pero ¿se trata de un compromiso aceptable? La pregunta de si los pacientes están dispuestos a sacrificar la certeza por la rapidez y, de ser así, en qué medida, motiva la reciente publicación de Forrest y sus colegas [6].
Forrest et al [6] preguntaron a cientos de personas (aproximadamente el 20% de las cuales tienen o han tenido cáncer), cuánta certeza estarían dispuestas a sacrificar para obtener aprobaciones de fármacos más rápidas. Sus respuestas revelan que, en promedio, se requiere un ahorro considerable de tiempo antes de que las personas lo prefirieran a mayor certeza sobre su impacto clínico.
Al presentar un fármaco contra el cáncer con una mejora en una variable subrogada, pero con efectos inciertos en la supervivencia global -un escenario común de la vida real-, los participantes estuvieron dispuestos a esperar 16 meses para obtener evidencia de certeza moderada y 22 meses para obtener evidencia de alta certeza [6].
Otros datos confirman estos hallazgos. Una encuesta a más de 700 pacientes con mieloma múltiple reveló que solo la mitad está dispuesta a aceptar que se añada un fármaco nuevo a un tratamiento establecido en base únicamente al beneficio de la SLP. El escenario clínico investigado en este estudio es idéntico al evaluado en el ensayo PERSEUS, que condujo a que la FDA aprobara el daratumumab, que líderes de opinión han aclamado como un cambio en la práctica clínica [7].
Ambos estudios sugieren que la forma en que las agencias reguladoras establecen el balance entre velocidad y certeza es erróneo; las agencias reguladoras están priorizando excesivamente la velocidad con la que se comercializan los fármacos cuando, en promedio, las personas prefieren tener certeza. Dada esta preferencia, la FDA debería esperar a tener evidencia robusta antes de tomar una decisión, en lugar de aprobar un medicamento basado en variables inciertas, como la SLP y la TRO.
Toda esta investigación se basa en un modelo simplista del mundo con o sin variables subrogadas. La situación contraria es más compleja, con implicaciones para el desarrollo de fármacos y el diseño e implementación de ensayos clínicos.
Imaginemos que la FDA decide mañana restringir el uso de variables subrogadas. La supervivencia global sería el nuevo indicador preferido para la mayoría de las indicaciones. Todos los estudios mencionados anteriormente asumen que las empresas seguirían en gran medida la misma agenda de ensayos clínicos, pero es poco probable que eso ocurra.
Inicialmente, es probable que las empresas reduzcan su cartera de desarrollo de fármacos. Cuanto mayor sea el incentivo para desarrollar fármacos y cuanto más fácil sea obtener un resultado positivo en los ensayos clínicos, más productos entrarán en fase de prueba. Algunos economistas lamentan el hecho de que si se cambia la estructura de incentivos se perderían [probables] curas; sin embargo, me inclino a pensar que esa eficiencia es deseable.
Se están desarrollando muchos fármacos con beneficios marginales o tóxicos, de los que sería mejor prescindir, y se seguirán desarrollando fármacos verdaderamente transformadores, como el imatinib o el trastuzumab deruxtecan, ya que los fabricantes probablemente sabrán que estos agentes tienen más probabilidades de conferir mejoras significativas en la SG y, por lo tanto, de recibir la aprobación.
Además, la agenda de ensayos clínicos cambiaría por completo. Los desarrolladores de fármacos tendrían más probabilidades de realizar ensayos aleatorizados con pacientes con enfermedad, en recaída o refractaria al tratamiento, de alto riesgo y en estadio avanzado, por la sencilla razón de que estas personas presentan los peores resultados clínicos, las tasas de eventos más altas y, por consiguiente, los resultados clínicos se obtendrían más rápidamente.
En lugar de que el desarrollo de un fármaco como pertuzumab se inicie junto con un tratamiento de referencia existente en pacientes con enfermedad HER2-positiva de reciente diagnóstico (el ensayo CLEOPATRA), probablemente veríamos que estos agentes se probarían primero en mujeres con progresión de la enfermedad, con una o dos líneas de tratamiento previas.
De igual manera, en lugar de que el ensayo PERSEUS se realice incluyendo a todos los pacientes con mieloma múltiple de reciente diagnóstico, podríamos tener un ensayo que incluyera exclusivamente a pacientes con enfermedad de alto riesgo, que tienen un pronóstico más desfavorable y una expectativa de vida más corta.
Por lo tanto, la relación entre velocidad y certeza podría ser diferente. Si los ensayos se realizan en los pacientes más necesitados, oodríamos obtener mayor certeza sin perder la velocidad de aprobación o, en algunos casos, obtener aprobaciones más rápidas. Curiosamente, el estudio de Forrest et al [6] también muestra que quienes tienen un peor estado funcional son más propensos a aceptar la velocidad; en un mundo sin variables subrogadas, los recursos para la investigación, incluyendo ensayos clínicos, se centrarán más en estas personas. Si los resultados de los ensayos son positivos, se podrían diseñar nuevos ensayos para evaluar la eficacia en líneas de terapias más tempranas o en personas con enfermedad de riesgo promedio.
Las variables subrogadas representan el criterio de valoración de dos tercios de las aprobaciones que la FDA está emitiendo, y se han convertido en una parte importante del canon de la regulación de medicamentos en EE UU; por lo tanto, actualmente es difícil imaginar un mundo en el que dichos criterios de valoración se utilicen con mayor moderación. Dicho mundo sería diferente del que habitamos en aspectos que van más allá de las diferencias entre velocidad y certeza. Se desarrollarían menos fármacos (ya que las barreras de acceso al mercado serían mayores), aunque es de esperar que solo se abandone el desarrollo de los fármacos más marginales. Todo el panorama de los ensayos clínicos se centraría en pacientes en fase terminal o con un pronóstico adverso.
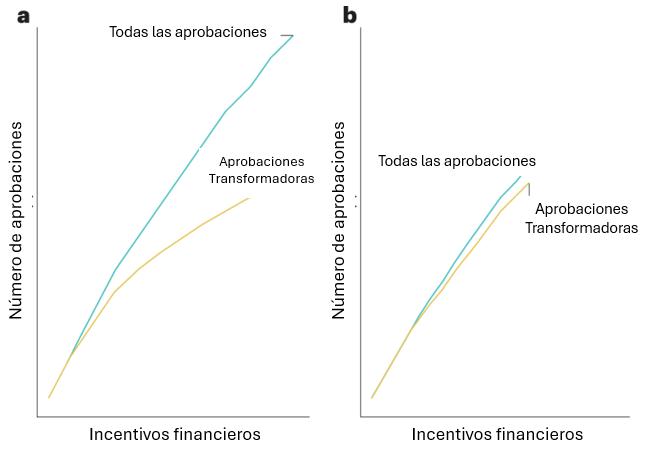
Las investigaciones futuras deberían explorar si estos cambios serían deseables, y la actitud de los pacientes ante un escenario distinto y tan complejo. Se necesitará más investigación para imaginar un escenario de este tipo. Programas piloto, posiblemente dirigidos por la FDA u otras agencias reguladoras, podrían evaluar las implicaciones de la utilización, más o menos permisiva, de variables subrogadas en tipos específicos de enfermedades. Cuanto más dinero paguemos por fármacos contra el cáncer, más fácil es que se aprueben y, por lo tanto, más medicamentos aprobados tendremos. Probablemente exista algún tipo de curva que represente esa relación (Fig. 1).
La FDA parece haber tomado una postura particular, priorizando la rapidez y la multiplicidad de opciones, una estrategia que beneficia principalmente a las corporaciones con fines de lucro. Las preguntas importantes que no han sido abordadas con seriedad es si eso es lo que los estadounidenses y las personas con cáncer quieren, ¿cuál es la forma de esa curva? y ¿nos encontramos en un punto óptimo?
Referencias