Los organismos reguladores aprobaron tratamientos controvertidos que provocaron un exceso de muertes, tenían una eficacia cuestionable y estaban afectados por conflictos de intereses.
Hace seis años, Genevieve Lane disfrutaba de una vida activa en Florida, hasta que empezó a olvidar los nombres de sus vecinos y en dónde ponía las llaves. A sus 76 años, pudo haberse encogido de hombros ante estos olvidos y considerarlos como meros signos de la edad, pero cuando empezó a tener momentos de confusión y a perderse de vez en cuando mientras paseaba, su compañera de piso y amiga de toda la vida, Vicki Holmes, le habló de un centro de investigación que quedaba cerca. Allí, un médico le diagnosticó Alzheimer en fase inicial y le habló de un estudio en el que se estaba probando un nuevo fármaco prometedor. Lane se inscribió, diciendo a su hija que quería disponer de más tiempo.
Poco después de empezar a recibir las infusiones dos veces al mes, ella y Holmes creyeron que su memoria iba mejorando. “Al principio, realmente pensamos que estaba funcionando”, dijo Holmes. Pero Lane no tomaba el fármaco, sino que recibía el placebo: infusiones de solución salina. Cuando el ensayo concluyó al cabo de 18 meses, empezó a recibir el fármaco real, con el nombre comercial de Leqembi, como parte de la fase de extensión del estudio.
Seis semanas después, Lane estaba muerta.
La familia de Lane pidió una autopsia. “Creía que el fármaco había sido la causa de su muerte”, dijo Yvonne Battaglia, su hija, a The Lever. “No confiaba en el fármaco ni en la empresa farmacéutica”. Pero, tanto la empresa de investigación que había contratado la compañía farmacéutica, como el hospital donde murió, dijeron que no podían realizar la autopsia. Así que Battaglia y su familia contrataron a un neuropatólogo independiente.
El patólogo encontró el cerebro de Lane lleno de vasos sanguíneos rasgados, inflamación generalizada y zonas de células muertas. Una segunda autopsia, realizada en el Centro Médico de la Universidad de Vanderbilt, donde la familia donó el cerebro de Lane, confirmó la causa de la muerte: inflamación cerebral grave, probablemente causada por Leqembi [1].
No fue la única paciente que sufrió daños mientras tomaba el fármaco. Aunque la empresa fabricante de Leqembi no informó ninguna muerte relacionada con el fármaco durante los 18 meses que duró el estudio, posteriormente, durante la fase de extensión del estudio, en el que participaron 714 pacientes que tomaron el fármaco, se produjeron cuatro muertes relacionadas con el mismo [2]. Y la muerte no fue el único resultado catastrófico. Durante el ensayo principal, al menos dos de los pacientes que empezaron con problemas leves de memoria quedaron discapacitados tras tomar el fármaco, incapaces de cuidar de sí mismos o de reconocer a sus familias [3]. El 22% de los pacientes que tomaron Leqembi sufrieron hemorragias o inflamaciones cerebrales, más del doble que el 10% de los que recibieron placebo [4].
No obstante, la FDA, que regula los productos médicos, aprobó el fármaco en 2023.
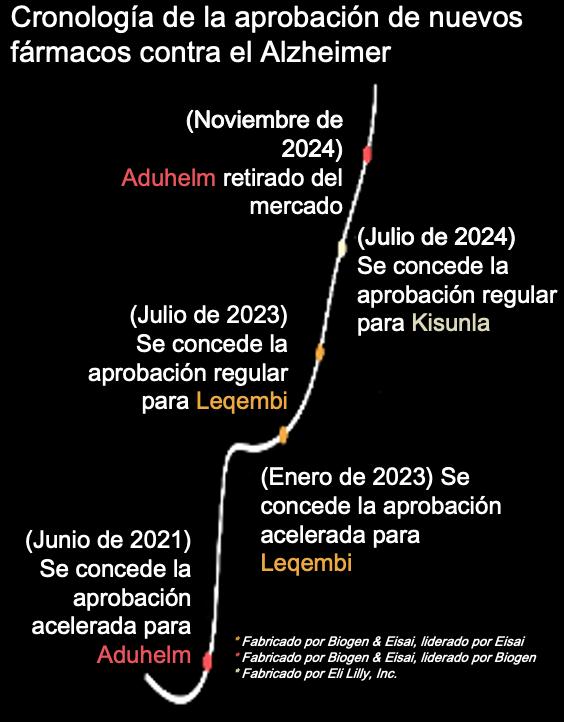
Leqembi es uno de los tres medicamentos contra el Alzheimer, todos son de la misma clase, y todos ellos introducidos con una extraña mezcla de escepticismo y algarabía en los últimos cuatro años. El predecesor de Leqembi, Aduhelm, comercializado en 2021, ya está fuera del mercado, tras las alegaciones sobre un acuerdo secreto entre las empresas farmacéuticas y los organismos reguladores (los fabricantes dijeron que retiraron el fármaco por razones comerciales) [5, 6]. El tercer fármaco de esa clase, Kisunla, se aprobó en julio de 2024. En los estudios sobre Kisunla, los pacientes experimentaron lesiones cerebrales asociadas al fármaco en mayor proporción que con Leqembi [7, 8]. Sin embargo, ambos fármacos han sido aclamados por algunos médicos, ejecutivos del sector farmacéutico, y periodistas, como medicamentos “innovadores” que podrían “cambiar la evolución” de la enfermedad de Alzheimer [9, 10].
Pero, ¿son realmente un gran avance?
Pocas enfermedades son tan funestas como el Alzheimer, que puede despojarnos lentamente de todo nuestro ser. Si la evolución de la enfermedad se pudiera modificar de forma significativa con medicamentos, algunos pacientes estarían sin duda dispuestos a asumir parte del riesgo, y la aprobación de un fármaco eficaz ofrecería a los pacientes y a sus familias más opciones para tratar la enfermedad. Los fabricantes de Leqembi y Kisunla sostienen que los estudios de sus fármacos, y la consiguiente aprobación de los mismos por la FDA, confirman que los posibles beneficios de los tratamientos superan sus riesgos.
Pero esta investigación ha revelado evidencias de que tanto los fabricantes de medicamentos como la FDA han minimizado los posibles daños de los medicamentos mientras exageraban sus posibles beneficios. The Lever desveló datos relacionados con la aprobación de Kisunla: cuando el fármaco se sometió por primera vez a revisión, la agencia rechazó su aprobación, señalando un “desequilibrio en las muertes”, así como la falta de datos, debido a que la empresa había perdido el rastro de casi una cuarta parte de los pacientes que participaron en un estudio clave. La FDA dijo a la empresa que tendría que averiguar si estaban vivos o muertos [11].
The Lever también descubrió que tres de los cuatro asesores médicos de la FDA, que votaron a favor de Leqembi, tenían vínculos financieros con los fabricantes u otras empresas farmacéuticas. Es más, los datos de los ensayos clínicos muestran que los efectos de los fármacos sobre la cognición y otras funciones pueden ser menores de lo que los pacientes y sus cuidadores suelen ser capaces de percibir. Cuando empezaron a conocerse los mediocres resultados de los estudios, un grupo de expertos convocado por una influyente organización de pacientes vinculada a los fabricantes de fármacos sugirió un umbral más bajo para medir la eficacia de los medicamentos.
La administración Trump está enviando mensajes contradictorios sobre la reestructuración de la FDA y el proceso de aprobación de medicamentos. El nominado del presidente para secretario del Departamento de Salud y Servicios Humanos, Robert F. Kennedy Jr, quiere facilitar que tratamientos cuestionables lleguen al mercado, asegurando que la FDA está librando una “guerra contra la salud pública” al bloquear la aprobación de terapias que no han demostrado ser efectivas, como la hidroxicloroquina para prevenir la covid-19 [12, 13]. Sin embargo, Kennedy también ha promovido una regulación más estricta de las vacunas. Está previsto que la audiencia para su confirmación comience el miércoles [14, 15].
El 3 de enero, la FDA escribió en un correo electrónico que estaba trabajando en la respuesta a una consulta de The Lever sobre las críticas de que el efecto de los nuevos medicamentos contra el Alzheimer es demasiado insignificante para que los pacientes y cuidadores lo percibieran, y que los medicamentos conllevan “graves problemas de seguridad”. Sin embargo, el 23 de enero, la agencia envió un correo electrónico a The Lever afirmando que el Departamento de Salud y Servicios Humanos “había emitido una pausa con los medios de comunicación para asuntos que no estuvieran directamente relacionadas con emergencias o que no fueran críticos para preservar la salud” [16].
La empresa farmacéutica japonesa Eisai, que desarrolló Leqembi en colaboración con la empresa biotecnológica estadounidense Biogen, declaró a The Lever que sus estudios demuestran que el fármaco es seguro y eficaz. La empresa citó el voto unánime de los asesores de la FDA a favor de aprobar Leqembi para justificar el “beneficio clínico” del fármaco y su “perfil general beneficio-riesgo”. Eli Lilly, el fabricante de Kisunla, dijo que su estudio demostró que la ralentización de la demencia se “lograba de forma fehaciente”. La FDA también mantiene que los nuevos fármacos son “seguros y eficaces”, como se explica en sus documentos de revisión [17].
A pesar de las aseveraciones que han hecho la agencia y los fabricantes, muchos neurólogos siguen dudando sobre si recetar o no los nuevos fármacos [18]. Madhav Thambisetty, antiguo investigador principal del Instituto Nacional sobre el Envejecimiento de los Institutos Nacionales de la Salud (quién ahora es director ejecutivo de medicina traslacional en neurociencia, en la empresa farmacéutica Novartis), nos dijo que pensaba que Leqembi podría ofrecer un beneficio modesto, pero que solo lo recetaría tras advertir a sus pacientes sobre lo que se sabe, y lo que no, acerca de sus efectos secundarios, que pueden ser graves. Cuando se le preguntó si recomendaría el fármaco si sus propios familiares desarrollasen Alzheimer, su respuesta fue tajante: “En absoluto”.
Reshma Ramachandran, codirectora de la Yale Collaboration for Regulatory Rigor, Integrity, and Transparency (Colaboración de Yale por el rigor, la integridad y la transparencia en materia de regulación) y experta en análisis de ensayos clínicos, nos dijo que Leqembi y Kisunla “plantean graves riesgos de seguridad y, en el mejor de los casos, beneficios poco claros” y “están dando falsas esperanzas a los pacientes y a sus médicos”. Rudolph Castellani, profesor de neuropatología en la Northwestern University, nos dijo que le preocupa que los medicamentos se prescriban ampliamente, porque sus efectos tóxicos podrían convertirse en “un desastre para la salud pública”.
Los fármacos deben administrarse por vía intravenosa en lugar de tomarse en forma de píldora, lo que hasta ahora ha limitado su mercado. En el informe sobre los resultados económicos de noviembre de 2024, Eisai informó que unos 4.000 pacientes habían tomado Leqembi, y los hospitales estaban estableciendo centros de infusión para ofrecer el tratamiento a un mayor número de pacientes (la empresa se negó a publicar datos más recientes).
Un dato clave que médicos y pacientes necesitan para valorar si merece la pena tomar estos medicamentos, es la tasa de efectos adversos graves que provocan. Los efectos adversos graves se definen como discapacidad permanente, necesidad de hospitalización o muerte. Según los fabricantes, los pacientes que tomaron Leqembi o Kisunla sufrieron efectos adversos graves durante los ensayos clínicos en mayor proporción que los que tomaron placebo.
Se calcula que entre cinco y siete millones de personas padecen deterioro cognitivo leve debido a la enfermedad de Alzheimer, pero solo 1,28 millones han sido diagnosticadas [19, 20]. Incluso si solo los que han sido diagnosticados tomaran eventualmente uno de los fármacos, los datos revelados por The Lever sugieren que decenas de miles de pacientes podrían quedar con lesiones graves, discapacitados o muertos.
Durante el ensayo clave de Leqembi, cinco pacientes sufrieron grandes hemorragias cerebrales (conocidas como “macrohemorragias”), en comparación con un solo paciente en el grupo placebo [21]. “Aunque la tasa de letalidad no sea mayor, el aumento de graves hemorragias cerebrales es preocupante”, declaró a The Lever Steven Goodman, médico y profesor de epidemiología en la Universidad de Stanford y experto en diseño de ensayos clínicos. “Algunos de los efectos colaterales de los fármacos son tan graves como los síntomas del Alzheimer que los pacientes intentan evitar”.
Actualmente, los fabricantes de fármacos aspiran a mercados aún mayores, ampliando el tratamiento a personas con síndrome de Down y a quienes no tienen ningún problema de memoria pero podrían estar en riesgo de desarrollar Alzheimer [22, 23]. El precio de lista de Leqembi es de US$26.500 al año, y el de Kisunla es de US$32.000 [24, 25]. Si a esto se añade el costo no solo de los medicamentos, sino también de los análisis de sangre, las punciones lumbares y las pruebas de diagnóstico por imagen, se calcula que el precio total de Leqembi por paciente en EE UU asciende a US$109.000 al año [26].
Una situación destinada al fracaso
El camino hacia los nuevos fármacos contra el Alzheimer se inició hace más de 30 años, con el desarrollo de la teoría de que la enfermedad está causada principalmente por la acumulación de una proteína en el cerebro llamada beta amiloide. Aunque los depósitos de amiloide están presentes en el cerebro de los enfermos de Alzheimer, algunas personas con amiloide nunca llegan a sufrir demencia, y nadie ha demostrado con rotundidad que la proteína cause la enfermedad en lugar de ser una consecuencia de esta.
Los expertos llevan años criticando la llamada “hipótesis del amiloide” [27, 28]. Recientemente, las dudas sobre la teoría aumentaron cuando una investigación en curso, detallada en la revista Science en 2022, reveló que las imágenes técnicas utilizadas en un estudio clave, en el que se apoyaba la hipótesis, habían sido alteradas [29, 30].
Al no contar con otras teorías, durante las últimas dos décadas la industria farmacéutica ha invertido miles de millones de dólares en la investigación y el desarrollo de fármacos antiamiloides. Entre 2004 y 2021, las empresas se han dedicado al menos a 23 de ellos, y todos ellos han resultado inútiles o incluso peligrosos [31]. En algunos estudios, la cognición de los pacientes empeoró; en otros, sufrieron graves efectos colaterales, como convulsiones continuas, encefalitis y muerte [32-34].
Se comercializa Aduhelm, Leqembi y Kisunla. Estos fármacos emplean anticuerpos monoclonales para atacar al amiloide, de forma muy parecida a como el sistema inmunitario ataca a un virus. Los tres han demostrado ser muy eficaces para eliminar el amiloide del cerebro. Desgraciadamente, poco más se puede decir de ellos.
El primero de la clase, Aduhelm, fue codesarrollado por Biogen y Eisai. Biogen interrumpió sus dos estudios pivotales con Aduhelm antes de tiempo, alegando “futilidad” [35]. En otras palabras, el fármaco no funcionó. Más tarde, la empresa volvió a analizar los mismos datos, esta vez con resultados contradictorios: un estudio mostró una ligera ralentización de la demencia; el otro, con un diseño casi idéntico, siguió arrojando resultados negativos: el fármaco no confirmó beneficio alguno para los pacientes.
Enterrados en las casi 1.000 páginas de análisis de la FDA sobre Aduhelm, había algunos resultados preocupantes. Cuando los revisores de la FDA compararon el grado de reducción de amiloide en la función cognitiva de los pacientes que tomaban los fármacos, no se observó ninguna correlación [36]. En otras palabras, los pacientes podían experimentar una reducción significativa del amiloide sin que disminuyera la pérdida de memoria.
Después de que Biogen presentara sus datos a la FDA, la agencia convocó una reunión del comité asesor, constituido por expertos externos, en 2020. (Este tipo de reuniones se celebran cuando los resultados de un estudio son contradictorios o inciertos). Los funcionarios de la FDA comunicaron al grupo de revisores externos que el estudio con resultados negativos no era fiable, y les dijeron que se centraran en el estudio con resultados positivos, que mostraba cierta ralentización de la demencia. Billy Dunn, alto funcionario de neurociencia de la agencia, también les informó que la agencia no consideraría la eliminación del amiloide como base para la aprobación, diciendo: “No estamos usando el amiloide como sustituto de la eficacia” [37]. En su lugar, la FDA quería que los asesores evaluaran el efecto del fármaco en la ralentización de la demencia.
Los miembros del comité protestaron, porque los estudios tenían un diseño casi idéntico, y era irracional centrarse solo en el estudio con resultados positivos [38]. Dieron al fármaco un decisivo pulgar hacia abajo (10 personas del comité de 11 personas dijeron que no había suficiente evidencia de la eficacia del fármaco; la undécima dijo que los estudios eran inciertos) [39].
A sugerencia de Dunn, Biogen solicitó la aprobación acelerada de Aduhelm tomando en cuenta su acción para eliminar el amiloide, en lugar de basarse en si realmente se había demostrado que ralentizaba la demencia [40].
Este fue precisamente el enfoque que Dunn había dicho a los asesores que la FDA no utilizaría. Por eso, cuando la agencia anunció a principios de 2021 que iba a desautorizar a sus asesores y conceder la aprobación basándose en la reducción del amiloide, tres de ellos dimitieron en señal de protesta [41]. Uno de ellos, Aaron Kesselheim, profesor de medicina en Harvard y uno de los principales expertos en el proceso de aprobación de medicamentos de la FDA, consideró que era “probablemente la peor decisión relacionada con la aprobación de medicamentos en la historia reciente de EE UU” [42].
El resultado fue un desastre de relaciones públicas para la FDA y el medicamento. La prensa descubrió una serie de cambios en el protocolo de la agencia, incluyendo un plan que Biogen bautizó como Proyecto Onyx, en el que sus científicos y directivos de la FDA, entre ellos Dunn, colaboraron para conseguir la aprobación del fármaco [43-45]. Una investigación del Congreso concluyó que Dunn mantenía una relación demasiado estrecha con Biogen y que la aprobación estaba “plagada de irregularidades” [46]. Algunos hospitales importantes se negaron a suministrar Aduhelm a los pacientes y, a principios de 2024, Biogen anunció que suspendería el medicamento [47, 48].
Cuando el siguiente fármaco de esta clase, Leqembi, se sometió a revisión en 2022, se parecía a Aduhelm en muchos aspectos. Ambos fármacos fueron desarrollados por Biogen y Eisai (en el caso de Leqembi, Eisai asumió el papel principal). Al igual que Aduhelm, el primer ensayo clínico de Leqembi no logró confirmar que los pacientes que tomaban el fármaco obtuvieran mejores resultados que los que tomaban placebo, según la prueba cognitiva principal que realizó la empresa [49]. Eisai utilizó los efectos colaterales, incluyendo la eliminación del amiloide, para solicitar la aprobación acelerada, y la FDA aprobó el fármaco en enero de 2023, basándose en los resultados de solo 152 pacientes.
Al mismo tiempo, había evidencia de que el fármaco causaba daños graves. La FDA detectó complicaciones asociadas al Leqembi, complicaciones a las que la empresa restó importancia o no había incluido en su resumen de “efectos adversos”. La FDA observó que Eisai no había informado que el medicamento había causado síntomas de inflamación cerebral en dos pacientes (uno sufrió una convulsión) y omitió dos casos de hemorragias cerebrales [50].
Conflictos de intereses
Antes de que un segundo estudio de mayor alcance sobre Leqembi fuera sometido a revisión, la FDA sustituyó a su comité asesor de 11 miembros, el cual estaba formado en su mayoría por médicos académicos independientes que habían rechazado Aduhelm. El nuevo comité asesor, compuesto por seis miembros, incluía a cuatro médicos, un bioestadístico y un representante de los pacientes.
Según el análisis de The Lever, tres de los cuatro asesores médicos tenían conflictos de intereses financieros con Biogen (el socio de Eisai en el desarrollo de Leqembi) lo que incluía haber recibido de la empresa honorarios de consultoría, honorarios por conferencias y financiación para investigación [51]. Un cuarto asesor era el director ejecutivo de un consorcio de desarrollo de fármacos, cuyos miembros incluían a Eisai, Biogen y Eli Lilly. El consorcio recibe financiación de los fabricantes de medicamentos y asegura que uno de sus éxitos fue “impulsar avances cruciales” para la aprobación de Aduhelm y Leqembi [52].

Las normas de la FDA exigen que, en la medida de lo posible, los asesores no tengan vínculos con las empresas farmacéuticas. Aunque sus vínculos financieros no son necesariamente indicio de mala conducta, los estudios han demostrado que los investigadores y médicos con tales conexiones con la industria tienen más probabilidades de ver a sus fármacos con buenos ojos, que los expertos que no tienen conflictos de intereses [53].
Dado que el panel asesor recién constituido dio el visto bueno unánime a Leqembi, no hubo ningún espectáculo de dimisiones públicas cuando fue aprobado por la FDA, y el fármaco no fue sometido a la misma paliza que la prensa dio a Aduhelm [54]. De hecho, la cobertura fue festiva. La revista Time nombró al fármaco como uno de los “mejores inventos de 2023” [55].
En una conferencia de prensa celebrada el 7 de marzo de 2024, Eisai anunció un plan coordinado para impulsar las ventas de Leqembi, que incluía el lanzamiento previsto de un nuevo análisis de sangre para la enfermedad de Alzheimer, que permitiría identificar rápidamente a más pacientes [56]. El análisis de sangre, junto con el desarrollo de una versión inyectable del fármaco que los pacientes pudieran utilizar en casa, podía ayudar a trasladar el tratamiento a manos de los proveedores de atención primaria.
Pero el mayor aumento de las ventas podía venir de los resultados de un ensayo clínico que trata con Leqembi a personas que no tienen problemas de memoria, pero que podían estar en riesgo de desarrollar la enfermedad por tener una predisposición genética o signos de depósitos amiloides en el cerebro. En la rueda de prensa, la empresa estimó que su posible mercado podría duplicarse hasta alcanzar los 6 millones de clientes para 2032, si la FDA aprobaba Leqembi para este uso “preclínico” [57].
Pero los riesgos y efectos de Leqembi (junto con Kisunla, que también fue muy elogiado cuando salió al mercado el verano pasado) son muy similares a los de Aduhelm, que ya no se comercializa [58].
“Todos los nuevos fármacos contra el Alzheimer —Aduhelm, Leqembi y Kisunla— son esencialmente iguales”, declaró a The Lever George Perry, profesor de neurociencia de la Universidad de Texas en San Antonio y redactor jefe del Journal of Alzheimer’s Disease (Revista de la Enfermedad de Alzheimer). “Utilizan el mismo mecanismo y han demostrado tener la misma eficacia insignificante y provocar daños graves”.
“Tóxicos y potencialmente letales”
En 2019, una mujer de unos 60 años, llamada Monique, vivía con su marido Richard en las afueras de París cuando su preocupación por la pérdida de memoria la llevó a consultar a un neurólogo. (Richard pidió a The Lever que usara solo sus nombres de pila.) Ella y el neurólogo hablaron sobre un ensayo clínico con Leqembi, y ella se inscribió. Tras la undécima infusión del fármaco, Monique fue trasladada al hospital tras sufrir una serie de convulsiones que pusieron en peligro su vida, y que su neurólogo determinó que se debían a una inflamación cerebral relacionada con el Leqembi [59].
Una serie de problemas nuevos siguieron a las convulsiones, manteniendo a Monique en el hospital durante meses. Cuando su familia pudo verla, “estaba delirando, alucinando, tirando de su equipo médico, con las piernas y brazos atados a las barandillas de la cama, sufriendo, sin reconocernos”, recuerda Richard. Una vez en casa, Monique fue decayendo rápidamente hacia la demencia. Los pocos momentos en que ahora está lúcida son difíciles, pero de un modo distinto, dice Richard, porque ella entrevé la realidad de su estado.
Cinco meses después del ingreso de Monique en el hospital, otra parisina, Nicole Nicolle, de 70 años, acudió a urgencias tras haber perdido la mitad de la visión en cada ojo. Una tomografía computarizada mostró una hemorragia cerebral masiva [60]. Ella también formó parte del estudio Leqembi y estuvo recibiendo el fármaco. En 18 meses, había pasado de un deterioro cognitivo leve a una demencia avanzada, un proceso que normalmente puede durar hasta una década [61]. Hoy, su hija Céline Marzin dice que su madre rara vez reconoce a la familia. “Está en su propio mundo”, nos dijo Marzin. “Y no hay nadie que pueda entrar”.
Tanto la inflamación como la hemorragia que sufrieron Monique y Nicolle son el resultado de la acción de los fármacos, según Castellani, de Northwestern. El exceso de amiloide en el cerebro suele vivir en las paredes de los vasos sanguíneos y, cuando se elimina, “puede ser como arrancar la costra de una herida”, explica. Los vasos sanguíneos se rompen y se inflaman, lo que provoca inflamación y hemorragias cerebrales. En los casos graves, los vasos sanguíneos dañados empiezan a morir. En palabras de Castellani, “la conclusión es que se trata de una droga tóxica que puede ser mortal”.
Muchos pacientes que toman estos fármacos sufren hemorragias cerebrales más pequeñas y menos inflamación que Monique y Nicolle. Los fabricantes afirman que suelen “resolverse” o aliviarse por sí solas. Algunos no causan síntomas. Pero nadie conoce las consecuencias a largo plazo de estos incidentes (por ejemplo, si pueden acelerar la progresión de la demencia), especialmente cuando se producen repetidamente. Para saberlo con certeza, los expertos afirman que los investigadores que no reciben remuneración de las empresas necesitan información sobre pacientes que hayan sufrido hemorragias e inflamaciones cerebrales.
Cuando Thambisetty aún trabajaba en el Instituto Nacional sobre el Envejecimiento, él y otros investigadores pidieron a Eisai que facilitara información sobre estas complicaciones, pero no tuvieron éxito [62]. La empresa afirmó que no facilitaría los datos de los pacientes mientras el fármaco se encontrara en fase de revisión regulatoria a escala mundial. Pero ese es “exactamente el momento en que se necesitan los datos”, dijo Perry, del Journal of Alzheimer’s Disease (Revista de la Enfermedad de Alzheimer). Sin ellos, los organismos reguladores no pueden revisar los análisis de fuentes independientes.
Incluso hay incertidumbre en lo que respecta a la prevalencia del posible efecto colateral más grave de Leqembi, la muerte. En diciembre de 2022, Eisai publicó los resultados de su ensayo clínico clave de Leqembi en The New England Journal of Medicine, en el que los autores afirmaban: “Los investigadores no consideraron que alguna muerte estuviera relacionada con el fármaco” [63]. Y añadían: “Se requieren ensayos más largos para determinar la eficacia y la seguridad de [Leqembi] en la enfermedad de Alzheimer temprana”.
Pero para Eisai, hacer una investigación más exhaustiva de las complicaciones del fármaco no parecía ser una prioridad; la empresa no informó de la realización de autopsias a los seis fallecidos durante la fase principal del estudio, en el que 898 participantes tomaron el fármaco [64]. Omitir una autopsia es habitual cuando la causa de la muerte no tiene una relación clara con el fármaco en cuestión, pero hacerla es muy importante cuando un fármaco puede dañar repentinamente el cerebro, y cuando la muerte podría atribuirse incorrectamente a algo distinto del fármaco.
Según Bryce Vissel, jefe del programa de neurociencia y medicina regenerativa del Hospital St. Vincent de Sidney, “sin una autopsia, no hay forma de excluir la posibilidad de que el fármaco contribuyera o incluso causara las muertes”. (Eisai no pregunta habitualmente a las familias si desean una autopsia cuando fallece un paciente, pero afirma que solicita copias de cualquier informe de autopsia realizado por patólogos independientes).
Poco después de que finalizara la fase principal del ensayo, aparecieron los resultados de las autopsias de dos pacientes que murieron mientras tomaban Leqembi durante la fase de extensión del estudio. Ambas implicaban al fármaco.
Una de las pacientes era Genevieve Lane, la mujer de Florida que murió seis semanas después de comenzar las infusiones del fármaco. Un equipo de médicos de la Universidad de Vanderbilt dirigido por el neurólogo Matthew Schrag, profesor adjunto de neurología realizó su autopsia. Él y 11 colegas publicaron sus hallazgos en la revista médica Nature Communications, documentando la inflamación y la hemorragia, efectos conocidos del fármaco [65]. El artículo incluía imágenes y un vídeo de los vasos sanguíneos del cerebro de Lane.
Schrag envió sus conclusiones a Eisai y solicitó información adicional. Pero señaló que la respuesta de la empresa “fue muy lenta” y no llegó a tiempo. Basándose en los documentos que Eisai presentó a la FDA, la agencia declaró que “no se podían sacar conclusiones firmes” sobre la causa de la muerte de Lane, porque la empresa dijo a los organismos reguladores que no había podido obtener “documentos críticos que corroboraran los hallazgos [del equipo de Schrag]”.
En un correo electrónico a The Lever, Eisai tildó a las conclusiones de Schrag sobre la autopsia como una “opinión”. Cuando se le preguntó qué medidas había tomado la empresa para confirmar o refutar los hallazgos, un portavoz de Eisai respondió: “Por lo general, no interactuamos directamente con investigadores independientes, ya que no queremos estar en posición de influir en su opinión o sesgarla”.
Los resultados de otra autopsia, realizada a Jean Terrien, una mujer atlética de 65 años que murió a finales de 2022, sugieren que el fármaco estuvo relacionado con su muerte [66]. Terrien fue trasladada a una sala de urgencias de Chicago, confusa e incapaz de hablar. Cuando murió, cuatro días después, Castellani, el neuropatólogo de Northwestern, realizó la autopsia. Informó que había muerto por hemorragias cerebrales extensas similares a las de Lane.
Eisai también se refirió a los resultados de la autopsia de Castellani como una “opinión”, sugiriendo que Terrien murió de un accidente cerebrovascular y una hemorragia en el cerebro causada por un medicamento anticoagulante utilizado para tratar una supuesta embolia cerebral. Según Castellani, “no tuvo una embolia cerebral típica, sino algo parecido a una embolia” causada por los efectos secundarios del Leqembi. Dijo a The Lever que su muerte fue el resultado de una serie de acontecimientos desencadenados por el fármaco, y añadió: “Si no se le hubiera administrado Leqembi, no habría tenido el evento parecido a la embolia cerebral que hizo que los médicos la trataran con un anticoagulante”.
En mayo de 2024, Eisai informó que cuatro de las nueve muertes que ocurrieron durante la fase de extensión estuvieron “posiblemente” relacionadas con el fármaco [67].
También murieron pacientes durante los ensayos con Kisunla, el medicamento más reciente contra el Alzheimer. La agencia observó un “desequilibrio” en las muertes: 17 pacientes (2,7%) que tomaban Kisunla murieron durante los ensayos clínicos, en comparación con 10 (1,4%) que tomaban placebo. Además, se descubrió que Eli Lilly había dejado de hacer el seguimiento de 391 pacientes que abandonaron el ensayo, de entre los 1.736 participantes. Los participantes en ensayos clínicos suelen abandonar los ensayos cuando sufren efectos colaterales, y algunos mueren más tarde [69]. No incluir esos casos de deserción en el análisis de los datos puede hacer que un medicamento parezca más seguro y eficaz de lo que es [70].
La FDA rechazó el primer intento de la empresa de obtener la aprobación para Kisunla, alegando la gran cantidad de datos que faltaban, y le ordenó que localizara a los pacientes que no se incluyeron [71, 72].
Para ello, Eli Lilly recurrió a un proveedor externo no identificado, que investigó a los pacientes que faltaban. El proveedor localizó a la mitad de ellos e informó de dos muertes adicionales entre los participantes que tomaron Kisunla, y otras cinco entre los pacientes que tomaron placebo [73]. Los resultados redujeron en cierta medida la diferencia de muertes entre los dos grupos (la mortalidad fue del 2,5% con Kisunla y del 1,9% con el placebo) [74, 75]. Sin embargo, varios expertos señalaron a The Lever que la falta de transparencia sobre el proveedor externo y sus métodos imposibilita que los investigadores independientes evalúen la confiabilidad de los nuevos datos [76].
Referencias
Nota de Salud y Fármacos. Charles Piller, un periodista que se dedica a investigar y escribe en Science acaba de publicar un libro sobre el fraude científico en la investigación relacionada con el Alzheimer. “Fraud, Arrogance, and Tragedy in the Quest to Cure Alzheimer’s, By Charles Piller, Editorial Simon & Schuster, 2025 https://www.simonandschuster.com/books/Doctored/Charles-Piller/9781668031247”. Según Piller, durante los últimos 25 años, la investigación sobre la enfermedad de Alzheimer ha sido víctima de una serie de fraudes y otras conductas inapropiadas por parte de investigadores de renombre mundial y científicos desconocidos, todos intentando ascender en un campo brutalmente competitivo.
Entre otros casos, Piller describe lo sucedido con Eliezer Masliah, cuya investigación tuvo una gran influencia en el desarrollo de tratamientos para la pérdida de memoria y la enfermedad de Parkinson, y a quien en 2016 se le confió la dirección del programa del Instituto Nacional sobre el Envejecimiento para abordar el Alzheimer. Este neurocientífico había publicado aproximadamente 800 artículos, muchos de ellos considerados muy influyentes, por lo que parecía ser la persona ideal para dirigir un proyecto para investigar el Alzheimer que contaba con un financiamiento de miles de millones de dólares. Sin embargo, en septiembre de 2024, Piller publicó un artículo en la revista Science, describiendo la conducta de Masliah y la evidencia sobre cómo había manipulado fotografías de tejido cerebral y otras imágenes técnicas, una clara señal de fraude. Salud y Fármacos resumió el articulo y lo publicó en febrero de 2025 (Documentos cuestionados respaldan varios fármacos, Boletín Fármacos: Ensayos Clínicos y Ética 2025; 28 (1) https://www.saludyfarmacos.org/boletin-farmacos/boletines/feb202505/55_do/).
Pero eso no es todo, Piller solicitó a un equipo de expertos en neuroimagen y en imágenes científicas que lo ayudaran a analizar estudios sospechosos de 46 investigadores destacados en Alzheimer. El proyecto no pretendía realizar un análisis exhaustivo de los 46, y mucho menos de la multitud de otros especialistas en Alzheimer que trabajaron con ellos. Eso requeriría un ejército de detectives y años de trabajo. Pero fue el primer intento de evaluar sistemáticamente el alcance de la manipulación de imágenes por un amplio abanico de científicos clave que investigan una enfermedad.
A lo largo de varios meses, el grupo elaboró un expediente de 300 páginas con 132 artículos del Dr. Masliah que consideraron sospechosos. (Aunque los artículos fueron escritos en colaboración con colegas, el Dr. Masliah fue el único autor común y, por lo general, desempeñó un papel destacado). Los experimentos incluidos en dichos artículos habían sido citados más de 18.000 veces en revistas académicas y médicas.
En conjunto, los expertos identificaron cerca de 600 artículos dudosos que han distorsionado la investigación en este campo; estos artículos se han citado unas 80.000 veces en la literatura científica. Muchos de los estudiosos del Alzheimer más respetados, cuyo trabajo guía el discurso científico, se refirieron repetidamente a estos estudios adulterados para respaldar sus propias ideas.
Piller también ha publicado un artículo en Statnews donde describe como se fue difundiendo la teoría del beta-amiloide para explicar la enfermedad de Alzheimer y la búsqueda de tratamientos para dicha enfermedad, y como se fue censurando a los científicos que la cuestionaron (Charles Piller. How the ‘amyloid mafia’ took over Alzheimer’s research. One idea has driven Alzheimer’s treatment — but to whose benefit? Statnews, 11 de febrero de 2025 https://www.statnews.com/2025/02/11/amyloid-hypothesis-alzheimers-research-lecanemab-aduhelm/)