Introducción: Las enfermedades mentales se encuentran entre las enfermedades más comunes e incapacitantes, con una importante necesidad insatisfecha [1]. A diferencia de muchos otros campos de la medicina, los diagnósticos psiquiátricos carecen de biomarcadores validados [2], y se sabe relativamente poco sobre la fisiopatología de los trastornos psiquiátricos [3], lo que plantea importantes desafíos para el desarrollo de fármacos [4].
Objetivo: Evaluar las aprobaciones de fármacos psiquiátricos en la última década para comprender el contexto regulatorio de los nuevos medicamentos psiquiátricos y la evidencia en la que las agencias se basaron para su aprobación.
Métodos: Este estudio transversal examinó todos los nuevos fármacos aprobados por la FDA para el tratamiento de indicaciones psiquiátricas entre enero de 2013 y octubre de 2024.
Los nuevos fármacos incluyeron Nuevas Entidades Moleculares (NME, Por su sigla en inglés), nuevos principios activos y fármacos reformulados para los cuales se realizaron ensayos de eficacia (durante el período del estudio), cada uno de los cuales recibió la aprobación de la FDA para su primera indicación psiquiátrica [5]. Se incluyeron fármacos dirigidos al estado de ánimo, trastornos del comportamiento, déficit de atención/hiperactividad y trastornos psicóticos. Este estudio siguió la guía de informes STROBE (Fortalecimiento de la Notificación de Estudios Observacionales en Epidemiología).
Utilizamos Drugs@FDA, una base de datos de acceso público, para obtener las características regulatorias de cada fármaco [5]. También extrajimos los datos demográficos de los participantes del estudio y las características clave del diseño del ensayo (aleatorización, enmascaramiento, comparador, criterio de valoración principal del ensayo y duración del ensayo) en los ensayos clínicos pivotales que condujeron a la aprobación de cada fármaco. Clasificamos los resultados de los ensayos pivotales como positivos o negativos según la evaluación del revisor de la FDA. Además de los ensayos pivotales, incluimos todos los demás ensayos de eficacia presentados a la FDA como estudios de apoyo y extrajimos los resultados de las variables principales de valoración. Utilizamos estadística descriptiva para caracterizar todos los resultados. Los datos se analizaron con STATA versión 18 (StataCorp LLC).
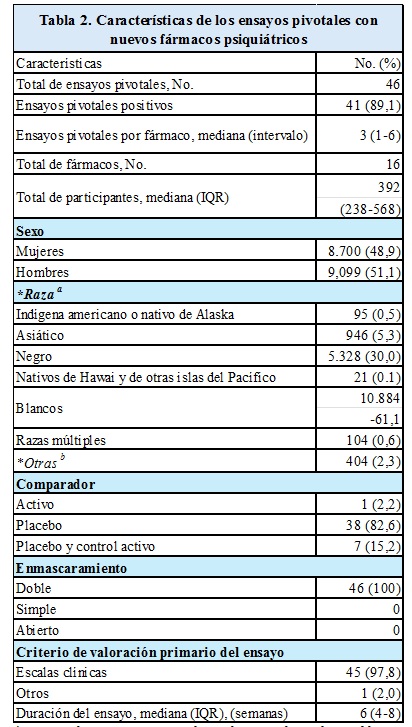
Resultados: Entre 2013 y 2024, la FDA aprobó 16 nuevos fármacos para el tratamiento de enfermedades psiquiátricas (Tabla 1). El mecanismo de acción de estos fármacos involucró una combinación de los sistemas de serotonina, noradrenalina y/o dopamina (11 fármacos), N-metil-D-aspartato (1 fármaco), ácido γ-aminobutírico (2), receptores α-2 adrenérgicos (1 fármaco) y receptores muscarínicos de acetilcolina (1 fármaco). Las aprobaciones de la FDA en esta muestra se asociaron con 73 ensayos clínicos, de los cuales la FDA consideró 45 (62%) positivos. Hubo 3 fármacos para los cuales menos de la mitad de los ensayos de eficacia presentados fueron positivos: brexipiprazol (3 de 7 [43%]), pimavanserina (1 de 4 [25%]) (un fármaco considerado no aprobable por los revisores médicos de la FDA, cuya decisión fue revocada por la dirección tras una votación favorable del comité asesor), y gepirona (2 de 12 [17%]), un fármaco que fue rechazado tres veces antes de obtener la aprobación.
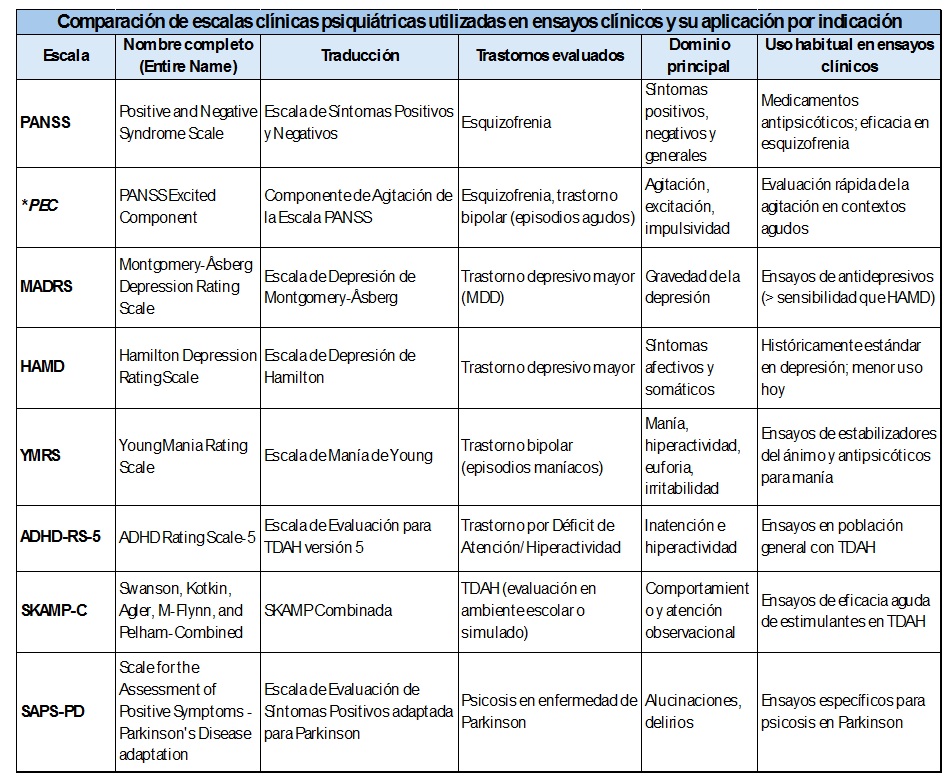
Entre los 73 ensayos clínicos, 46 fueron designados por la FDA como ensayos pivotales (mediana de 3 ensayos pivotales/fármaco [rango, 1-6]) (Tabla 2). Tres fármacos (19%) fueron aprobados después de un único ensayo pivotal. Entre los participantes en los ensayos pivotales, hubo una representación similar de mujeres (8.700 [48,9%]) y hombres Participantes (9.099 [51,1%]); 946 pacientes eran asiáticos (5,3%), 5.328 eran negros (30,0%) y 10.884 eran blancos (61,2%). Todos los ensayos pivotales fueron aleatorizados y doble ciego. La mayoría de los ensayos fueron controlados con placebo (38 [83%]) y otros 7 ensayos (15,2%) tuvieron ambos, controles con placebo y principio activo, definiendo el criterio de valoración principal con escalas clínicas (45 [97,8%]). Las tres escalas clínicas más utilizadas fueron la Escala de Síndrome Positivo y Negativo (PANSS) (12 ensayos [26%]), la Escala de Depresión de Montgomery-Asberg (MADRS) (12 ensayos [26%]) y la Escala de Depresión de Hamilton (7 ensayos [15%]).
En la última década, se ha aprobado un número limitado de fármacos psiquiátricos, y la mayoría de sus mecanismos de acción (que involucran los sistemas de serotonina, dopamina y/o noradrenalina) son similares a los de fármacos desarrollados décadas atrás [6]. Aunque la mayoría de los fármacos fueron respaldados por múltiples ensayos clínicos de fase 3 positivos, tres de ellos tuvieron más ensayos de eficacia negativos o fallidos que los positivos, incluyendo uno que fue aprobado con base en dos ensayos clínicos positivos en el contexto de otros diez ensayos clínicos negativos o fallidos. Cabe destacar que solo uno de estos tres fármacos fue designado para revisión acelerada. Las limitaciones incluyen resultados que podrían no ser generalizables a fármacos dirigidos a otras enfermedades (p. ej., trastornos del movimiento y relacionados con el consumo de sustancias) y la inclusión de profármacos y combinaciones de fármacos si al menos un fármaco era una Nueva Entidad Molecular. La calidad de la evidencia que respalda las aprobaciones de fármacos psiquiátricos varió sustancialmente, lo que subraya la necesidad de una mayor claridad y una aplicación consistente de los estándares de aprobación de la FDA para los fármacos que tratan enfermedades mentales.
Declaración de conflicto de intereses: El Dr. Turner declaró haber trabajado anteriormente (1998-2001) como revisor de fármacos psicotrópicos para la FDA. El Dr. Kesselheim declaró haber recibido honorarios personales de Alosa Health, ajenos al trabajo presentado. No se declararon otros conflictos de interés.
Financiación/Apoyo: Este trabajo fue financiado por el Programa de Formación de Médicos Científicos del Hospital General de Massachusetts/McLean (subvención 1R25MH135837-01 del Instituto Nacional de Salud Mental). El trabajo del Dr. Kesselheim está financiado por Arnold Ventures y la Fundación Commonwealth.
Rol del financiador/patrocinador: Los financiadores no participaron en el diseño ni la realización del estudio; la recopilación, la gestión, el análisis ni la interpretación de los datos; la preparación, la revisión ni la aprobación del manuscrito; ni en la decisión de enviar el manuscrito para su publicación.
Referencias:
Opinión de Salud y Fármacos:
Los procesos actuales de aprobación regulatoria para medicamentos antipsicóticos, especialmente en el contexto de los ensayos clínicos pivotales utilizados como base para la aprobación de nuevos fármacos, muestran limitaciones estructurales profundas. En la mayoría de los estudios, los medicamentos antipsicóticos aprobados tienen una eficacia modesta según los resultados de las escalas estandarizadas utilizadas, con diferencias mínimas frente al placebo y una alta heterogeneidad clínica y metodológica.
La evidencia del fallo estructural regulatorio en los criterios de exigencia científica aplicados por agencias como la EMA y la FDA, muestra cómo se han priorizado medidas de eficacia estadísticamente significativas, pero clínicamente irrelevantes, sin asegurar que los medicamentos ofrezcan mejoras tangibles en la funcionalidad o calidad de vida de los pacientes. Esta situación se agrava cuando los resultados de los ensayos clínicos no se traducen en beneficios observables en la práctica clínica, y cuando las decisiones regulatorias no se acompañan de una evaluación rigurosa del balance riesgo-beneficio en condiciones reales de uso.
Para los países de ingresos bajos y medianos ingresos (PBMI), las implicaciones de este fallo regulatorio son más graves. Estos países, con recursos sanitarios limitados, adoptan con frecuencia las aprobaciones de las agencias reguladoras de alto perfil como la FDA o la EMA, sin realizar procesos de evaluación independientes. Como consecuencia, se destinan recursos públicos a la adquisición de medicamentos de alto costo que no garantizan eficacia clínicamente significativa ni superioridad frente a alternativas disponibles y esto compromete la sostenibilidad financiera de los sistemas sanitarios y puede perpetuar modelos de atención ineficaces centrados en la medicalización de los trastornos mentales, en lugar de priorizar intervenciones psicosociales y de psicoterapia conductual integral.
En este contexto, acciones por parte de los sistemas regulatorios y de evaluación de tecnologías sanitarias en los PBMI, como el fortalecimiento de sus capacidades técnicas, la adopción de criterios de eficacia clínica más estrictos y la exigencia de evidencia de efectividad comparativa y de resultados centrados en el paciente podrían mejorar los resultados.
Es importante que los entes regulatorios establezcan mejores mecanismos de farmacovigilancia activa y reevaluación post comercialización para garantizar que las decisiones sobre incorporación y financiación de nuevos medicamentos se basen en su valor terapéutico real y no sólo en aprobaciones aceleradas o decisiones por votación de comités asesores externos; esto último es particularmente relevante para proteger la salud en casos de rechazo reiterado del proceso de aprobación de Nuevas Entidades Moleculares.
Dado que en psiquiatría el uso de escalas clínicas estandarizadas es crítico para demostrar eficacia en poblaciones con alta variabilidad de respuesta, Salud y Fármacos resume a continuación, en una tabla comparativa, las escalas mencionadas en el artículo original, aceptadas por la FDA como criterios primarios de valoración (en teoría, siempre que sean validadas, reproducibles y clínicamente relevantes).