Cómo mejorar el registro de los ensayos clínicos
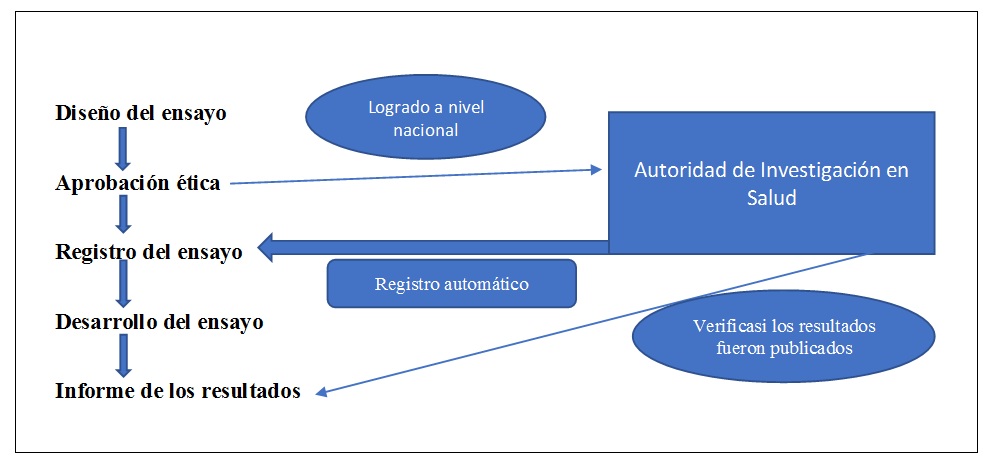
Los comités de ética (unos 60 en todo el país) envían los protocolos de todos los estudios que aprueban a la Autoridad de Investigación Sanitaria (Health Research Authority, HRA) en Londres. A continuación, el personal de la HRA inscribe directamente todos los ensayos clínicos en el registro ISRCTN. Una vez registrado el ensayo, el investigador principal del mismo se encarga de gestionar el registro y es responsable de mantenerlo actualizado y de introducir los resultados.
Mejorando los informes sobre los ensayos clínicos
Como la HRA registra directamente todos los ensayos que se realizan en el país, tiene una visión general de toda la investigación clínica. Un año después de la finalización de un ensayo, la HRA comprueba si el registro incluye los resultados del ensayo. Si no es el caso, envía un recordatorio al investigador principal. La HRA también publica auditorías anuales mostrando quiénes han hecho públicos los resultados de sus ensayos oportunamente y quiénes no.
Para cumplir las normas
Es probable que en 2023 el Reino Unido adopte una ley nacional que obligue a hacer públicos los resultados de todos los ensayos clínicos intervencionales (probablemente en un plazo de 12 meses en un registro de ensayos, como recomienda la Organización Mundial de la Salud). Parece que serán los patrocinadores de los ensayos, y no los investigadores individuales, los responsables legales de garantizar la publicación de los resultados. El regulador nacional de medicamentos se encargará de hacer cumplir la ley. Como éste tiene acceso a los datos de auditoría de los ensayos de HRA (véase más arriba), puede identificar fácilmente todas las infracciones. En la práctica, es muy probable que el organismo regulador de los medicamentos haga cumplir la ley de forma eficaz.
¿Cómo sucedió esto?
En 2018, el Comité de Ciencia y Tecnología del parlamento británico inició una investigaciónsobre la transparencia de los ensayos clínicos. Tras numerosos y acalorados debates, el Comité publicó un informe en el que recomendaba a la Autoridad de Investigación en Salud (en inglés HRA) que desarrollara una estrategia nacional de transparencia.
La HRA creó y dirigió un comité para desarrollar la estrategia. El comité incluía a funcionarios públicos, la industria, el mundo académico, grupos de transparencia y representantes de los pacientes. Paralelamente, la HRA puso en marcha un proceso de consulta. Tras debatir con todas las partes interesadas, la HRA adoptó el modelo arriba descrito [1].
A lo largo de este proceso, una coalición de grupos del sector de la salud, entre los que se encuentran TranspariMED, Cochrane, la UAEM y Transparencia Internacional, mantuvo la presión para lograr la reforma [2].
Cómo facilitar la transparencia
Las principales ventajas. El lema de la estrategia nacional #MakeItPublic es “facilitar la transparencia, que la transparencia sea la norma”. El objetivo es apoyar a los investigadores y patrocinadores, no castigarlos. El nuevo enfoque establece un flujo de trabajo en los ensayos clínicos más ágil y menos burocrático que antes. Está en marcha un proceso de integración de los sistemas de los distintos agentes y de armonización de sus requisitos de transparencia. En el futuro, la legislación, los comités de ética, los financiadores oficiales de la investigación y el registro ISRCTN tendrán exactamente las mismas normas de transparencia. Los investigadores y los patrocinadores de los ensayos se benefician de tener normas y flujos de trabajo claros y sencillos, una aprobación más rápida de los ensayos y menos papeleo.
Medidas de apoyo
Los dos principales financiadores de la investigación pública (NIHR y MRC) ya supervisan activamente el registro y la información sobre todos los ensayos que financian. El registro ISRCTN ya envía periódicamente correos electrónicos para recordar a los investigadores que deben actualizar los datos del registro y publicar los resultados. Todas las partes interesadas adoptan continuamente medidas para mejorar la transparencia.
Costo y relación calidad-precio
No está claro el costo exacto del desarrollo y la aplicación de la estrategia, ya que implica el trabajo de múltiples actores. Sin embargo, el gasto total de todos los actores juntos es seguramente inferior a un millón de euros, una cantidad marginal comparada con el inmenso costo de los despilfarros de la investigación médica.
Referencias