Economía y Acceso
Precios
Perú. El negocio de los medicamentos biológicos que alargan la vida en el cáncer: S/. 5,415 por ampolla
Beatriz Jiménez
La República.pe, 14 de marzo de 2015
http://archivo.larepublica.pe/14-03-2015/el-negocio-de-los-medicamentos-biologicos-que-alargan-la-vida-en-el-cancer-soles-5415-por-ampolla
La vida en manos de pocos. Los medicamentos biológicos para el cáncer son inasequibles para la población sin seguro y están llevando a EsSalud a la quiebra. La falta de una directiva para su registro y las acciones judiciales de las farmacéuticas impiden que el Estado registre y adquiera los biosimilares que abaratarían el costo de los tratamientos y permitirían que más pacientes tengan la opción de prolongar su vida.
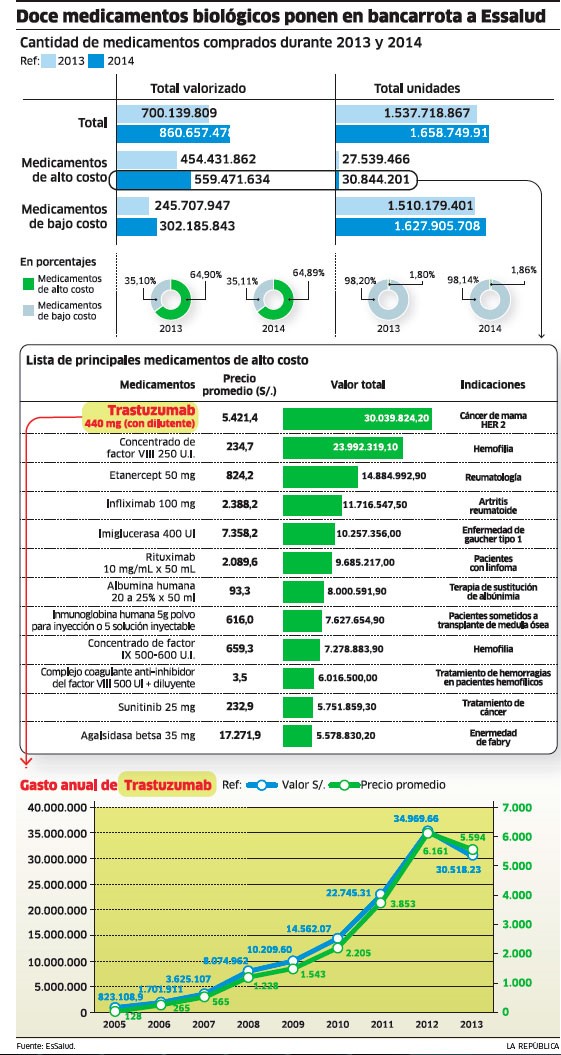
Cada ampolla de Trastuzumab, un medicamento de última generación que sirve para tratar el cáncer de mama, le cuesta al Estado peruano S5.415 (1US$=S3,09). Un tratamiento necesita en promedio más de 30 dosis, por lo que su precio por paciente supera los S100.000.
Entre un 20% y un 30% de los cánceres de mama son positivos para HER2, una proteína que lo convierte en uno de los más agresivos. En estos casos, el Trastuzumab, del laboratorio suizo Roche, es un tratamiento complementario a la quimioterapia cuya eficacia se mide en el tiempo que llega a alargar la vida sin progresión de la enfermedad: 16 meses.
Debido a la incidencia del cáncer de mama en Perú –es la segunda causa de muerte por cáncer en la mujer– el Trastuzumab ha sido incluido por la Dirección General de Medicamentos (Digemid) dentro de la lista de fármacos esenciales. En Perú, bajo el nombre comercial de Herceptín, es comercializado de forma monopólica por el consorcio Química Suiza-Roche.
En la sanidad privada los seguros oncológicos estándar no incluyen en sus pólizas el tratamiento con medicamentos biológicos y en la sanidad pública su acceso es restringido y exige mucha burocracia.
En el Seguro Integral de Salud (SIS) esta ampolla para alargar la vida de las mujeres peruanas es prescrita a aquellas con cáncer positivo a Her2 que ya hayan sufrido una mastectomía. Y en el Seguro Social de Salud (EsSalud), responsable de la compra del 75% de medicamentos oncológicos en nuestro país, la adquisición del Trastuzumab le hizo desembolsar en 2013 más de 30 millones de soles, lo que supuso un 35% de su presupuesto para medicamentos oncológicos.
El Trastuzumab no es el único medicamento biotecnológico (obtenido gracias a la ingeniería genética) incluido dentro del petitorio de medicamentos esenciales en Perú (Ver grafíco). En él están también otros como el Rituximab o el Interferón Alfa, que tratan diferentes tipos de leucemia; el Filgastrim, para infecciones asociadas a distintos tipos de cáncer; y el Sunitib, indicado también para cáncer. Dentro de las compras del Estado también existen biológicos para tratar enfermedades autoinmunes como la artritis reumatoide o para enfermedades raras o huérfanas.
En estos medicamentos de alto costo, que suponen menos de un 2% de las unidades adquiridas por EsSalud, esta institución gasta un 65% de su presupuesto general para medicamentos. Según reconoce a La República Víctor Dongo, jefe de la oficina de Coordinación Técnica de EsSalud, las compras de biotecnológicos a un solo postor están llevando a la quiebra a su institución.
El director de la Digemid, César Amaro, dimensiona el drama que supone este alto costo. “Me veo en el dilema de comprar vacunas para la polio o una sola ampolla de Trastuzumab”.
Actualmente, existen ya biosimilares de medicamentos biológicos con precios sensiblemente menores a los originales y cuyas pequeñas diferencias no representan para los pacientes riesgos de seguridad, calidad ni eficacia. Sin embargo, el Estado peruano está con las manos doblemente atadas para comprarlos.
Una de las cadenas es la falta de una directiva que regule los estudios de equivalencia terapéutica de los biosimilares, directiva que debió estar lista ya hace 4 años, cuando se promulgó el Reglamento para el Registro, Control y Vigilancia de Productos Farmacéuticos (D.S. 016-2011-SA).
La otra son las medidas cautelares logradas por los laboratorios que fabrican biológicos en el Poder Judicial contra los registros de medicamentos biosimilares que se han inscrito o intentan inscribirse en la DIGEMID.
Digemid en falta
César Amaro, director de la Digemid, reconoce que su institución está en falta. Argumenta que las directivas nacionales para el ingreso de biosimilares están en debate en Latinoamérica e incluso dentro de la misma Organización Mundial de la Salud (OMS). Ante el retraso de 4 años, anunció que en las próximas semanas se realizará una pre-publicación oficial de la directiva. Pero entre la prepublicación y su promulgación definitiva puede pasar más de un año, un periodo demasiado largo para los pacientes que necesitan los biosimilares para abaratar sus tratamientos.
La Digemid eligió el camino largo, ya que el artículo 16 de la Decisión Andina 562, según informó EsSalud, permite a los países miembros asumir reglamentos técnicos por la vía de urgencia y da 12 meses de plazo para regularizar después los trámites de ley.
Monopolio continúa
De los medicamentos biológicos, sólo goza de patente en nuestro país Sunitib, indicado para el tratamiento de determinados tipos de cáncer. El resto de biológicos, entre ellos el Trastuzumab, no han inscrito su patente aquí, lo que permitiría la comercialización de los biosimilares que prueben su eficacia.
Existen ya medicamentos biosimilares autorizados por la EMA (European Medicines Agency) y la FDA (Food and Droug Administration) que ahorrarían a los pacientes y al Estado millones de soles, pero su registro en el Perú está paralizado por una acción de amparo del Poder Judicial interpuesta por la Asociación de Laboratorios Farmacéuticos (Alafarpe) el 12 de mayo de 2014. Entre los miembros de Alafarpe están los laboratorios de biológicos potencialmente perjudicados por la entrada de competencia. En su recurso de amparo, al que dio la razón el Cuarto Juzgado Especializado de la Corte Superior de Lima, Alafarpe argumenta que al no existir la directiva que regula el ingreso de biosimilares estos medicamentos no pueden demostrar la comparabilidad con el producto biológico original. Un argumento que, al menos en el caso de aquellos biosimilares ya registrados en países de alta vigilancia, carecería de razón.
Esta medida cautelar contra la Digemid fue apelada y está en espera de sentencia. Desde su interposición, ningún biosimilar ha sido registrado en el país. Y los biosimilares que lograron inscribirse antes de este recurso, enfrentan demandas de amparo. La Digemid informó a La República de la existencia de cinco procesos.
En marzo de este año, un biosimilar del Bortezomib, indicado para la artritis reumatoide, ganó una pequeña licitación del Fospoli al ofrecer un precio algo menor por 4 unidades que el laboratorio Johnson and Johnson, productor de su par biológico. El laboratorio estadounidense interpuso una medida cautelar (Exp: 03226-2014) contra la inscripción de este biosimilar por parte de la empresa Roemmers (Argentina) con el mismo argumento que el de la presentada por la ALAFARPE. Y lo más sorprendente: la presentó exactamente en la misma fecha (el 12 de mayo) y ante el mismo juzgado.
Al igual que en el recurso de amparo anterior, el juez otorgó la medida cautelar. Y no solo eso, sino que el mismo juzgado la amplió en diciembre en contra de las empresas Seven Pharma SAC y MC Globe Incorporate (India), que también habían inscrito en el registro de la Digemid biosimilares del producto de Johnson and Johnson.
Tras la apelación de la Digemid, el 29 de enero de este año, el mismo juzgado se rectificó y antepuso el derecho a la salud a la ausencia de directiva, revocando la medida cautelar. Sin embargo, fue nuevamente apelada por el laboratorio y actualmente se encuentra en el 7° Juzgado Constitucional.
Estas demandas incluyen incluso biosimilares aprobados por la Unión Europea, como Remsima, del laboratorio de Corea del Sur Celltrion, importado en Perú por Olimed. De nuevo Johnson and Johnson solicitó una medida cautelar (Exp.32371-2013) en contra del registro de este producto indicado para enfermedades autoinmunes, biosimilar de infliximab, que en este caso fue declarada infundada el 1 de septiembre de 2014 por el 50 Juzgado Constitucional y está en apelación.
Otra empresa que ha solicitado un recurso de amparo contra la inscripción de un biosimilar es Pfizer (EEUU), en este caso contra la inscripción de “Altebrel”, con el principio activo de Etanercept, indicado para determinados tipos de leucemia. Pfizer pidió mediante un recurso de amparo declarar nula la inscripción en Digemid realizada por la empresa Perulab (Exp: 36450-2014). Posteriormente pidió un nuevo recurso contra otra empresa, Q. Pharm (Exp:40145-2014), que había inscrito en Digemid el mismo biosimilar. Ambos recursos de amparo han sido admitidos a trámite por el Primer Juzgado Constitucional de Lima.
Con estos recursos judiciales, las farmacéuticas han logrado hasta el momento impedir que el Estado compre biosimilares que abaratarían su costo y permitirían que más pacientes de determinados tipos de cáncer tuvieran la oportunidad de alargar sus vidas.
Claves
Biológicos. Estos medicamentos son anticuerpos monoclonales diseñados para tratar determinados cánceres y enfermedades autoinmunes como la artritis reumatoide. Son proteínas capaces de unirse a otras de nuestro cuerpo que favorecen la proliferación de los tumores y bloquearlas. Los laboratorios farmacéuticos los venden a precios desorbitados haciendo uso de patentes.
Biosimilares. Tanto la FDA y la EMA (European Medicines Agency) los definen como medicamentos biológicos similares a otros ya autorizados sin diferencias clínicas significativas en comparación con el biológico de referencia en términos de seguridad, pureza y potencia. Conforme vencen las patentes de los biológicos, biosimilares obtienen registros en EEUU y la UE.
“Hay mercado y espacio para todos”
“La judicialización de la salud es un fenómeno tangible en Perú y en Latinoamérica a través de demandas de empresas que defienden sus intereses”. César Amaro. Jefe de la DIGEMID
“Nosotros no estamos en contra de los biosimilares, estamos a favor siempre que esté probada su seguridad y eficacia y demuestren su intercambiabilidad”. Augusto Rey. Presidente de ALAFARPE