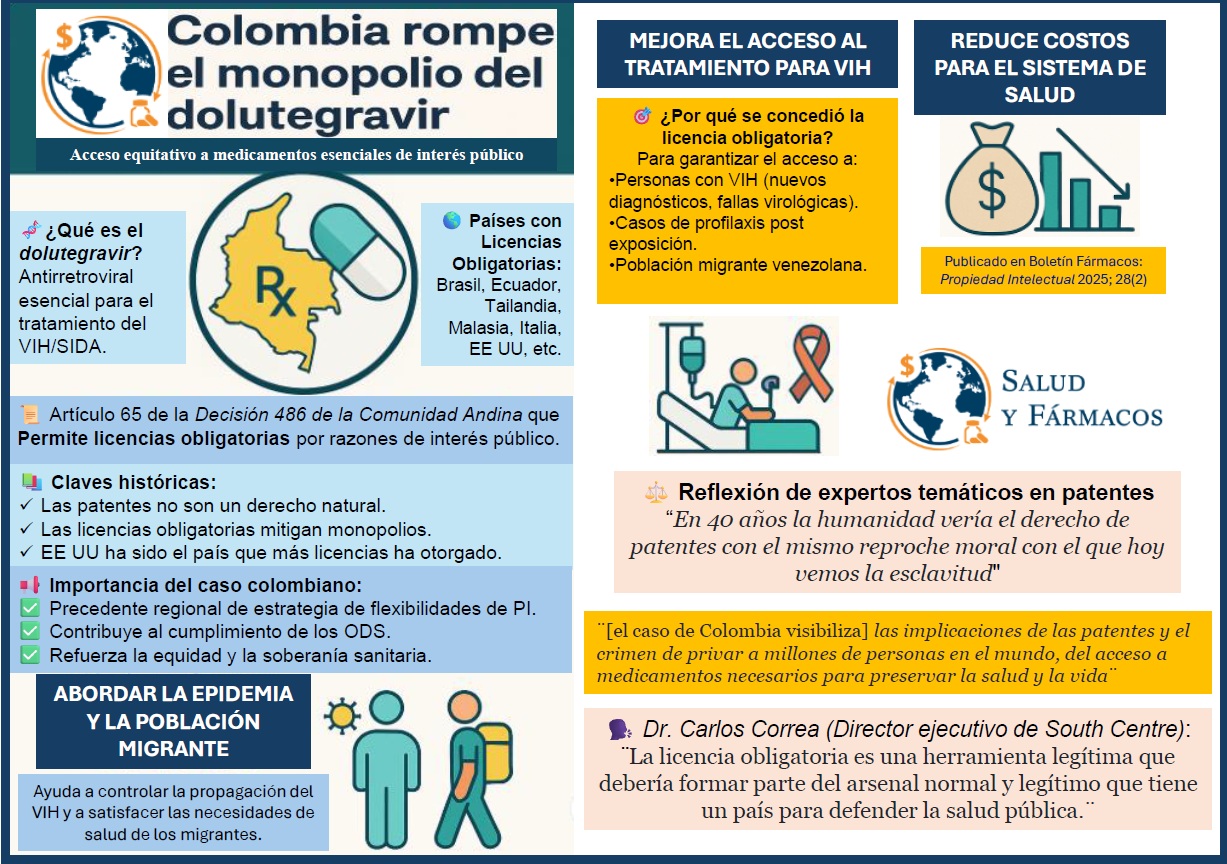
Petro del lado de la industria farmacéutica transnacional
Bernardo Useche Aldana
La Tribuna, 13 de julio 2025
https://latribunacolombia.co/petro-del-lado-de-la-industria-farmaceutica-transnacional/
Tags: Acceso universal a medicamentos, justicia sanitaria global, reformar sistema de patentes, Propiedad intelectual y salud pública, Industria farmacéutica transnacional, Comités de ética en investigación, Ensayos clínicos en América Latina.
La industria farmacéutica transnacional, con lineamientos del Banco Mundial, impulsa un plan para convertir a Colombia en centro regional de ensayos clínicos en América Latina. Declaraciones empresariales muestran que se busca redirigir recursos públicos, reformar los comités de ética y ampliar la presencia de multinacionales en el sistema de salud.
La Ley 100 introdujo como actores principales en el sistema a las EPS y el modelo de aseguramiento social en salud. En el panorama que se avecina luego del desbarajuste ocasionado con la política implementada por el presidente Petro y sus ministros de salud, las multinacionales farmacéuticas representadas por la Asociación de Laboratorios Farmacéuticos de Investigación y Desarrollo, AFIDRO, buscan jugar un rol preponderante en el nuevo sistema de salud que termine por configurarse.
El objetivo va más allá: “consolidar a Colombia como un hub regional de investigación” en América Latina. El interés de la industria farmacéutica en este empeño se basa en el hecho de que el mercado farmacéutico latinoamericano es uno de los de mayor crecimiento en el mundo con una población creciente de 660 millones adultos mayores. Interés incentivado por las recientes órdenes ejecutivas expedidas por el presidente Trump con el propósito de acelerar la producción de nuevas medicinas y disminuir los precios de los medicamentos en Estados Unidos, lo que obliga a las grandes farmacéuticas a aumentar los precios y los mercados en el exterior (Executive Order 14273 of April 15, 2025; Executive Order 14293 of May 5, 2025 – Executive Order 14297 of May 12, 2025).
El papel del Banco Mundial
Si en 1993 la reforma neoliberal de salud en Colombia en beneficio de las compañías aseguradoras en salud fue diseñada por el Banco Mundial, hoy, el Banco ha definido también las líneas centrales de la política de participación de las gran (https://openknowledge.worldbank.org/entities/publication/e5fae256-f0c0-5400-9c14-b80387e182c8) industria farmacéutica en los sistemas de salud en América Latina y el Caribe:
- Obtener mayor contratación pública que conlleve incremento de compras de sus medicamentos con recursos del Estado,
- Mantener las normas de propiedad intelectual que protegen las patentes de sus productos farmacéuticos y
- Aumentar exponencialmente el número de ensayos clínicos que generen nuevos medicamentos y otras tecnologías de salud patentables.
Las orientaciones del Banco Mundial se han materializado en una estrategia formulada por la Federación Latinoamericana de la Industria Farmacéutica (https://afidro.org/wp-content/uploads/2025/06/FIFARMA-Investigacion_Clinica_en_Latinoamerica_2.pdf), organización que agrupa “empresas farmacéuticas multinacionales líderes” y que actualmente está bajo la dirección de Yaneth Giha, exdirectora de AFIDRO y Ministra de Educación en el segundo gobierno de Juan Manuel Santos.
Aseguradoras y farmacéuticas
El propósito de los grandes laboratorios y compañías farmacéuticas es en primer lugar, articularse a los sistemas de salud y elevar las ventas de sus medicamentos y tecnologías con cargo a los recursos del Estado. Otro documento de la federación es claro al respecto: “El llamado que hacemos desde FIFARMA (…) es que los gobiernos de la región pongan en marcha planes de incremento en sus presupuestos para el sector salud”.
Aseguradoras y farmacéuticas coinciden en que se aumente el presupuesto general en salud, pero tienen entre sí una contradicción económica. A mayor gasto en medicamentos menor presupuesto disponible para el aseguramiento. En la superficie se clama por el aumento del financiamiento público de la salud y de la UPC para responder a las tutelas, quejas y reclamos de la población, lo cual tiene sentido en la crisis actual de la salud, profundizada en el presente gobierno.
En el fondo, las casas farmacéuticas se aprestan a competir con las aseguradoras por un mayor monto de los recursos del Estado. Esto implica una disputa por los servicios y tecnologías que se incluyan en el plan de beneficios y que se contraten con hospitales y clínicas. A propósito, un riguroso estudio reciente del sistema de salud de Taiwán (https://www.sciencedirect.com/science/article/pii/S0929664624004790?via%3Dihub) encontró que a medida que, con recursos del Estado, aumentaron las ganancias de las farmacéuticas, más se afectó la estabilidad financiera de los hospitales.
Más ensayos clínicos en Latinoamérica, parte de la estrategia global de frenar a China
En este contexto, las multinacionales farmacéuticas han lanzado un plan para convertir a Colombia en tierra fértil que produzca un “crecimiento exponencial” de los ensayos clínicos con los que la industria crea productos farmacéuticos de “innovación” cuyas patentes garantizan altísimos precios y monopolios en el mercado.
No extraña entonces que el Dr. Ignacio Gaitán, presidente actual de AFIDRO, haya declarado que: “América Latina podría cuadruplicar su participación en estudios clínicos”. Este plan de expansión de los estudios clínicos en los que se evalúa si un nuevo medicamento tiene efecto preventivo o curativo (eficacia), y si no produce efectos adversos de consideración para la salud de los participantes (seguridad), se encuadra en el reconocimiento por parte de la industria de que “la investigación clínica es una actividad altamente competitiva, que se desarrolla en un entorno global”.
En particular, para las multinacionales norteamericanas incrementar el número de ensayos clínicos en Latinoamérica se inscribe en la estrategia global de la industria de frenar el avance de China en la Investigación y Desarrollo (I & D) de productos farmacéuticos innovadores.
En el período 2000-2004, el número de ensayos clínicos iniciados en China (274) fue 40 veces menor que los estudios emprendidos por Estados Unidos (11.830). En el período 2020-2024, Estados Unidos inició 48.192 ensayos clínicos, solo dos veces el número de los estudios iniciados por China (23.137). De continuar su ritmo de crecimiento, China será en corto tiempo el país a la vanguardia en la investigación farmacéutica, lo que tendrá un gran impacto en el mercado global a mediano plazo.
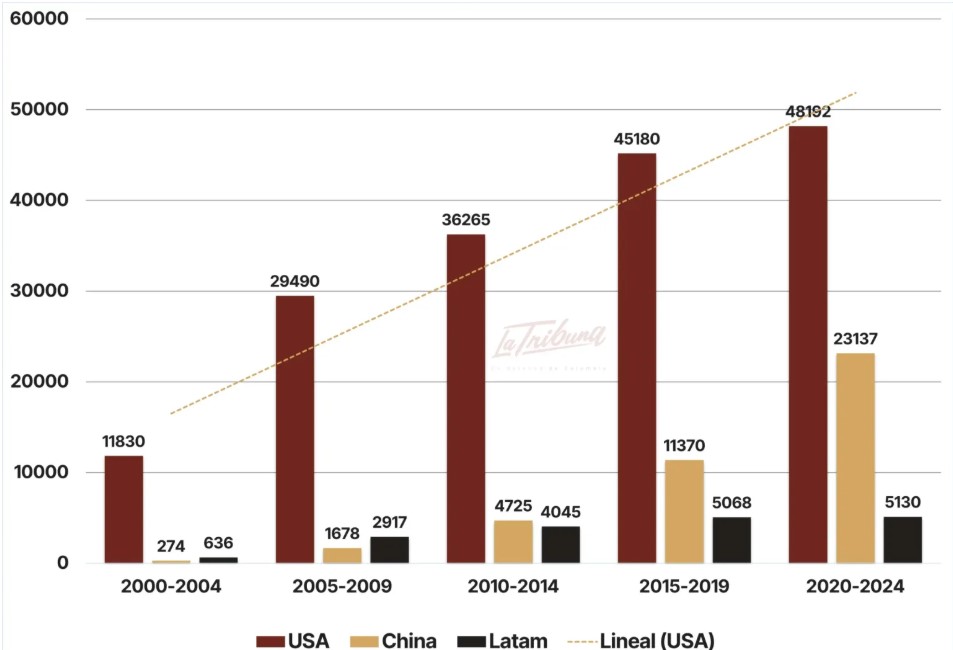
Fuente: Gráfico adaptado por La Tribuna – tomado de Informe FIFARMA – mayo 2025
Las grandes farmacéuticas consideran que Colombia y otros países latinoamericanos ofrecen condiciones muy favorables para su política de competir con China en la investigación de nuevos productos. El gasto público en salud crece, la población es étnica y racialmente diversa, el sistema de salud cubre la casi totalidad de la población, los costos de los ensayos clínicos son muy inferiores a los realizados en Europa o Norteamérica.
El gobierno de Gustavo Petro ha visto con buenos ojos el posicionamiento de las multinacionales en el país. Un documento del Ministerio de Salud de 2023 lo plantea: “En Colombia, la investigación clínica patrocinada por la industria farmacéutica ha ido avanzando en los últimos 30 años, posicionándose en el cuarto lugar en Latinoamérica y siendo uno de los países de gran interés por parte de la industria gracias a la infraestructura, calidad de los profesionales de la salud y cobertura del sistema de salud”.
En consonancia con el Ministerio, el mes de mayo pasado, María Fernanda Velasco, directora médica de Pfizer Colombia informó: “Pfizer ha invertido más de 524.5 millones de dólares en investigación clínica desde 2020, posicionando la región como un punto estratégico para la validación científica de tratamientos innovadores para enfermedades complejas que afectan a muchas personas”. La Doctora Velasco agregó que Pfizer cuenta con más de 300 centros de investigación en Brasil y más de 250 en otros países de la región, incluyendo a Colombia.
El papel de los Comités de Ética en Investigación
Ahora, multiplicar de manera expedita los ensayos clínicos requiere que los estudios obtengan rápida aprobación por Comités de Ética de la Investigación (CEI). Estos comités surgieron luego de que una comisión constatara los delitos atroces cometidos durante experimentos médicos con prisioneros en campos de concentración Nazis y otros casos notorios de abuso (Ver Tabla 1).
Posteriormente, en distintos momentos de la historia se ha documentado la existencia de condenables abusos con personas incluidas en diversos estudios clínicos (ver Tabla 2). Se hizo entonces necesario formular criterios y normas éticas y crear los CEI para garantizar la protección de las personas o pacientes participantes en este tipo de estudios.
Las compañías transnacionales de productos farmacéuticos consideran que el funcionamiento de los CEI es lento, que los criterios y normas éticas reguladoras de la investigación clínica se deben unificar internacionalmente y en últimas, que la aprobación de los ensayos debería hacerse en el país “por parte de un único comité”.
La propuesta se orienta a que los CEI sean reemplazados por Organizaciones de Investigación por Contrato o CRO por sus iniciales en inglés (Contract Research Organizations), compañías privadas afines a los intereses de la gran industria farmacéutica.
Los CEI no están exentos de problemas. Un estudio en ocho países latinoamericanos que hicimos bajo la dirección de Nuria Homedes y Antonio Ugalde encontró que, tanto en Colombia como en la región, los comités adolecen de falencias que debilitan su función protectora de los participantes, están expuestos a conflictos de interés con los patrocinadores y tienden a no dar prioridad a proyectos de investigación dirigidos a resolver las necesidades de salud de las poblaciones locales.
Sin embargo, un fuerte sistema de comités de ética independientes de la industria, centrado en la protección de los pacientes y en un conocimiento científico que ofrezca garantía de la seguridad y eficacia de los medicamentos investigados, podría dar mejores resultados que comités con protocolos orientados a favorecer la inversión de las multinacionales.
El dilema de Petro: del lado de las transnacionales o de la industria farmacéutica nacional
El gobierno a través del INVIMA convocó a la Primera Mesa Nacional de Investigación Clínica el pasado 11 de junio donde AFIDRO compartió su política de dar pasos adelante en posicionar al país como un hub en América Latina para el desarrollo de medicamentos que puedan ser patentados por las multinacionales farmacéuticas.
La gran industria farmacéutica debe mantener un lugar importante en el sistema de salud colombiano, pero la industria farmacéutica nacional debe fortalecerse. Las decisiones que se tomen sobre los CEI y las condiciones en que agilicen los trámites del INVIMA y la regularización de los ensayos clínicos van a definir el nivel de incidencia de las multinacionales en el sistema de salud colombiano.
Es una prioridad que se revise el capítulo 16 del TLC con Estados Unidos sobre propiedad intelectual. Es fundamental que la investigación clínica con recursos públicos conduzca a productos con patentes nacionales. Es el único camino para que Colombia se ubique en la senda de la seguridad y la soberanía farmacéutica.