Economía y Acceso
Tratados de Libre Comercio, Propiedad Intelectual y Patentes
El Tratado Transpacífico aplicará sus reglas farmacéuticas de una manera escalonada
Carlos B. Rodríguez
El Global, 16 de octubre de 2015
http://www.elglobal.net/noticias-medicamento/2015-10-16/politica-sanitaria/el-tratado-transpacifico-aplicara-sus-reglas-farmaceuticas-de-una-manera-escalonada/pagina.aspx?idart=942212&utm_source=mail&utm_medium=newsletter&utm_campaign=elglobal
La propiedad intelectual en materia de medicamentos sigue siendo la manzana de la discordia en el TPP
Los 12 países vinculados a través del Acuerdo Transpacífico de Cooperación Económica, también conocido como TPP, deberán ajustarse a las reglas farmacéuticas establecidas con independencia de su nivel de riqueza o desarrollo, pero no todos lo harán al mismo tiempo. La enorme dificultad para llegar a un acuerdo en esta materia (el último escollo que tuvo que superar el TPP) obligó a Estados Unidos a llevar a cabo lo que parece ser una negociación bilateral con el resto de sus socios, que en última instancia supondrá la aplicación escalonada de las nuevas reglas farmacéuticas.
Los acuerdos farmacéuticos incluidos en el TPP suponen, para empezar, un giro en la política comercial internacional de los Estados Unidos. Hasta ahora, se guiaban por un compromiso alcanzado en 2007, conocido como el Acuerdo del 10 de mayo, que por primera vez vino a reconocer el impacto negativo que la inclusión de fuertes reglas de protección intelectual podría tener en países en vías de desarrollo en materia de acceso a los medicamentos.
Desde que el TTP comenzó a negociarse, hace más de cinco años, quedó claro que Estados Unidos quería abandonar esta política. En octubre de 2014, una versión prematura del acuerdo farmacéutico todavía contemplaba dos posibilidades para afrontar los derechos de propiedad intelectual: por un lado, la posibilidad de incluir claúsulas que eximieran a los países de aplicar estas normas hasta que no hubiesen alcanzado cierto nivel de desarrollo; por otro, la que ha quedado plasmada en la versión filtrada por Wikileaks: una aplicación por tramos acordados en función de cada país.
¿Qué hay de nuevo?
El ejemplo más mediático continúa siendo el futuro de la regulación de la propiedad intelectual en relación a los medicamentos biológicos. El TPP ofrece dos opciones de redactado más bien ambigüo: por un lado se ofrece la posibilidad de dar ocho años de exclusividad de mercado a partir de la fecha de aprobación; por otro, los países pueden acogerse a un mínimo de cinco años, a los que habría que sumar una cantidad de tiempo no determinada y condicionada por “circunstancias de mercado” que resulten en un “resultado comparable” a nivel de mercado.
Sea cual sea la opción, en ocho de estos países (ver tabla) la aplicación de estas reglas no incluye periodo de transición. Malasia y México disponen de una moratoria de cinco años, y Perú y Vietnam de diez. Asimismo, seis de estos países, los cuatro que gozan de un aplazamiento más Chile y Brunei, incluyen variables en función de los anexos negociados con cada uno de ellos.
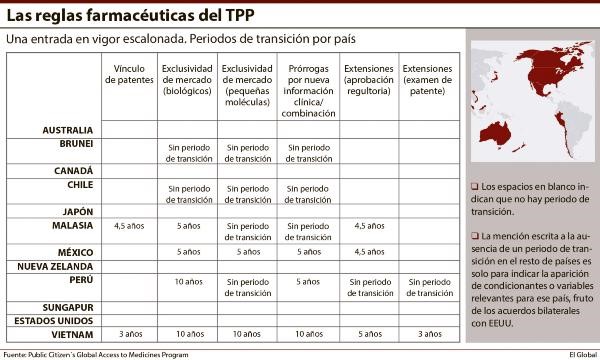
Perú, por ejemplo, podrá poner a correr el reloj de la exclusividad desde el momento en el que un medicamento biológico entre en el mercado estadounidense o de cualquier otro país socio del TPP. Pero esto sólo se aplicará mientras que las autoridades peruanas aprueben ese producto en el plazo de seis meses. Es decir, en términos prácticos, los periodos de exclusividad se acortarían sólo si el laboratorio tarda demasiado en solicitar la aprobación en Perú, tal y como señala Public Citizen, una organización sin ánimo de lucro que defiende los derechos de los consumidores.
En última instacia, puede considerarse que estas excepciones dependen más de lo que hagan las compañías que de lo que hagan los países. Similar al anexo de Perú es el que se ha firmado con Brunei y Malasia, y que procura respetar lo que allí se denomina como ‘ventana de acceso’. Las autoridades de ambos países pueden requerir a un laboratorio que inicie el proceso de comercialización de un medicamento en un plazo máximo de 18 meses después de haber sido aprobado en cualquier otro país, sea o no firmante del TPP.
Casi todos los puntos que forman parte del acuerdo farmacéutico del Tratado Transpacífico han terminado por quedar plasmados de manera muy distinta a la inicial. La versión más temprana del acuerdo, por ejemplo, establecía límites al periodo y aplicación de las extensiones de patente. La versión actual no hace referencia a estas limitaciones, sino que permite que cada país establezca las condiciones y limitaciones dentro de su sistema legal, animándoles además a acelerar los trámites relativos a los expedientes de comercialización.
Algo similar ocurre en relación a la ‘cláusula Bolar’, que permite iniciar los procesos de experimentación y obtención de autorizaciones gubernamentales necesarios para comercializar un producto antes de que haya vencido una patente. En versiones iniciales del acuerdo se intentó limitar su aplicación. Finalmente se ha adoptado un enfoque más generalizado y flexible, que refleja el régimen existente actualmente en Canadá y Nueva Zelanda.
En cuanto a las nuevas indicaciones, el acuerdo desemboca en otras dos posibilidades: la primera permitiría añadir un periodo de exclusividad de “al menos tres años” para nueva información clínica que apoye una nueva indicación; bajo la segunda, un país podría aprobar cinco años de exclusividad si un producto que ya está en el mercado es combinado con una nueva molécula que no había sido previamente aprobada.
¿Más excepciones?
La disposición establece salvaguardias para la salud pública, de conformidad con el Acuerdo sobre los ADPIC y la Declaración de Doha. Esto debería significar que las partes podrán establecer excepciones de la comercialización de exclusividad de ciertos medicamentos. Antes del Acuerdo Transpacífico, cinco de sus socios, por ejemplo, no tenían ningún tipo de exclusividad para medicamentos biológicos.
“El peor acuerdo comercial para el acceso a los medicamentos en los países en desarrollo”. Así ha calificado Médicos Sin Fronteras el acuerdo de los doce países agrupados comercialmente en el Tratado Transpacífico, que ha encontrado en la propiedad intelectual su manzana de la discordia. Aún faltan semanas para que los estados socios liberen los documentos del acuerdo, pero las filtraciones de Wikileaks han obligado a algunos de sus protagonistas a salir a la palestra para defender un tratado que, según afirman, no subirá el precio de los medicamentos.
Los detractores, por su parte, alertan de que el alza en el precio de los fármacos está casi garantizada y que el acceso a muchas innovaciones, así como a genéricos y biosimilares, podrá verse bloqueado. Apuntan a su principal impulsor para ejemplificar el daño que puede hacer el TPP. Estados Unidos ha conseguido incluir reglas farmacéuticas muy similares a las que maneja a nivel interno, y allí el alto precio de los medicamentos ya ha hecho estragos a nivel presupuestario y ha impuesto barreras de acceso que están llevando a algunos candidatos a las elecciones presidenciales a plantear un cambio radical del modelo.