AGENCIAS REGULADORAS Y POLÍTICAS
Investigaciones
Generalidades sobre las moléculas nuevas que aprobó la FDA entre 1827-2013
(An overview of FDA-approved new molecular entities: 1827–2013)
Kinch MS, Haynesworth A, Kinch SL, Hoyer D
Drug Discovery Today, 2014; 19 (8):1033-1039 Doi: 10.1016/j.drudis.2014.03.018
http://www.sciencedirect.com/science/article/pii/S1359644614001032
Traducido y resumido por Salud y Fármacos
Resumen
La industria farmacéutica está experimentando cambios importantes y su futuro es incierto. Hicimos un meta-análisis y catalogamos los medicamentos que ya estaban aprobados por la FDA y las nuevas entidades moleculares. En este informe documentamos la tasa de entrada de nuevas entidades moleculares hasta finales de 2013. La tendencia reciente muestra que unas cuantas compañías controlan dos terceras partes de las nuevas entidades moleculares; y muchas de las entidades moleculares están bajo el control de organizaciones comerciales que tienen poca o ninguna experiencia en el descubrimiento y desarrollo de medicamentos nuevos. Estas tendencias se han agudizado desde el año 2000 y cuestionan el futuro de este mercado y la viabilidad del descubrimiento y desarrollo de nuevos medicamentos
Introducción
La forma de descubrir y desarrollar (I&D) nuevos medicamentos está cambiando, y se espera que en el futuro este proceso sea muy diferente al utilizado hasta ahora.
Los autores compilaron la lista de todos los productos aprobados por la FDA utilizando el libro naranja (Orange Book) que contiene la lista de todos los medicamentos aprobados en EE UU, incluyendo los genéricos. Esta lista se complementó con los productos que se han dejado de comercializar y que se han retirado del mercado. Para los medicamentos aprobados después de 1990 se obtuvo información a partir de los datos incluidos en el paquete de aprobación del producto. Esta información no estaba disponible para los productos aprobados antes de esa fecha. También se hizo una revisión de la literatura y de las bases de datos de organismos relevantes.
Además de recopilar toda la información disponible sobre cada medicamento nuevo, los autores identificaron a las organizaciones involucradas en el descubrimiento del medicamento, desde la publicación de la patente hasta los estudios post-comercialización. Se documentó la evolución de estos organismos, como por ejemplo las fusiones, adquisiciones, bancarrota y otras.
Nuevas Entidades Moleculares (NMEs) 1827-2013
Se identificaron 1453 NMEs que obtuvieron el permiso de comercialización en EE UU antes del 31 de diciembre de 2013. La morfina y la aspirina se comercializaron antes de la creación de la FDA.
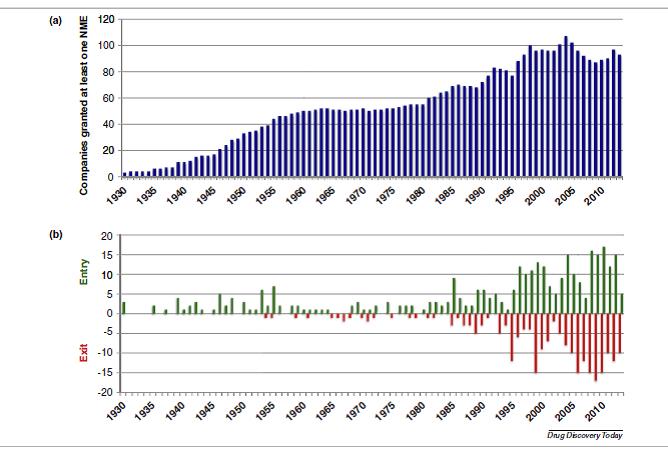
La industria farmacéutica moderna empezó a desarrollarse en 1930, pero el número de NMEs se mantvo bajo (menos de cuatro NMEs por año) hasta 1950. Entre 1950 y 1970 se aprobaron unas 15 NMEs al año; en los 1980s aumentó a 25-30 NMEs, cifra que se mantiene hasta el momento. En general estas cifras han sido bastante estables excepto en un periodo de volatilidad a finales de los 1990s, por ejemplo en 1997 se aprobron 55 NMEs, mientras que en años anteriores solo 19.
Cuando tuvimos la lista de todas las NMEs aprobadas, analizamos que había pasado con las organizaciones públicas o privadas que habían patrocinado el registro. Por ejemplo el 1989 se creo una nueva organización (Bristol-Myers Squibb) y desaparecieron dos (Bristol Myers y Squibb). En cambio cuando en 2013 Amgen compró Onyx solo desapareció una empresa (Onyx).
En total, 275 organizaciones han patrocinado al menos una NME, y como consecuencia de compras, fusiones etc… solo 93 siguen activas (33.8%). Al hacer el análisis a lo largo plazo, observamos que el número de organizaciones fue aumentando desde 1930s a los 1950s. A finales de los 1960s, 50 compañías diferentes habían desarrollado al menos una NME, lo que equivale a una entrada de 18.7 organizacioens por década, y salía una organización por década. En cambio entre 1960 y 1980 disminuyó el número de entradas (ocho por década) y aumentó el número de salidas (4.3 por década). Esta volatilidad se amplió en la década de los 80s (38 entradas y 21 salidas), de los 1990s (85 entradas y 67 salidas) y en el nuevo milenio (118 entrtadas y 124 salidas). Se espera que en los próximos años siga la misma tendencia.
Organizaciones que controlan las NMEs
Mientras en los 1940s, la media de NMEs que recibieron la aprobación de la FDA por organización era de 1,4 hoy en día es superior a 14,3. La mayoría de las organizaciones (152 de 275) solo desarrollaron una NME que obtuviera la aprobación de la FDA, 67 obtuvieron la aprobación de entre dos y cinco NMEs, y 45 entre 6 y 20 NMEs. Solo 14 organizaciones consiguieron que les aprobaran más de 20 NMS y seis recibieron más de 50. La compañía hasta ahora más exitosa ha sido Merck (63 NMEs) seguida de Roche, Johnson and Johnson, Eli Lilly, Pfizer y American Home Products.
Solo la mitad de las compañías más exitosas siguen funcionando. En total, hay 115 compañías que controlan (a las que les fue otorgado el permiso de comercialización, independientemente de que sigan comercializando el producto) al menos una NME. Casi la mitad (54) solo controlan una NME, 30 controlan entre 2 y 5 NMEs, 19 entre 6 y 20 NMEs, 12 controlan más de 20 NMEs cada una. Las compañías que más NMEs controlan son Pfizer (198), seguido de Merck (106), Novartis (98), SanofiAventis (84) y GlaxoSmithKline (79). En conjunto, las cinco compañías más grandes controlan el 40% de las NMEs, y las 10 más grandes controlan dos terceras partes del total de NMEs. La mayoría de las compañías más grandes han logrado posicionarse a través de fusiones y compras.
En 1990, solo dos NMEs estaban bajo el control de una organización que nunca había conseguido una aprobación de la FDA en forma directa, sino a través de compras, fusiones etc; a finales de 2013, esta cifra había aumentado a 215 NMEs (14,8% del total de NMEs). Es más, de las 118 compañías que controlan al menos una NME, 25 (21,1%) no han recibido ninguna aprobación por parte de la FDA.
Conclusiones y consecuencias
Las empresas farmacéuticas han cambiado mucho. Durante los primeros años, hubo un aumento sostenido del número de NMEs aprobadas y un aumento concomitante de las empresas que consiguieron la aprobación de una NME. Entre 1960 y 1980, el número de NMEs siguió creciendo pero el número de organizaciones que obtuvieron la aprobación de una NME se estabilizó, y hubo pocas entradas y salidas de empresas. A partir de 1980s empezó un periodo de gran volatilidad, donde muchas empresas entraron y salieron del mercado. Las empresas nuevas en gran parte eran biotecnológicas, y las salidas se debieron a consolidaciones a través de compras y fusiones, no por bancarrota.
Estos cambios han dado lugar a una industria que consta de cuatro tipos de organizaciones:
(1) La mayoría de empresas solo controlan un producto. Estas compañías suelen comprarlas otras de tamaño mediano;
(2) Compañías medianas, que controlan entre 2 y 20 productos, que suelen ser adquiridas o que se fusionan para formar compañías más grnades;
(3) Compañías establecidas que controlan un gran número de NMEs, y que han llegado a esta posición a través de fusiones, ninguna de ellas obtuvo esta categoría sin haber experimentado al menos una fusión. Las 10 compañías más importantes controlan dos terceras partes de las NMEs, lo que representa un incremento del 65% desde 1950, cuando 10 compañías controlaban el 40%.
(4) Compañías que primordialmente se dedican a la venta, comercialización y producción de NMEs. Estas compañías han reducido su capacidad de I &D y se dedican a comprar NMEs a través de obtener las licencias, fusiones o adquisiciones.
Aunque persiste la volatilidad en el número de empresas que entran y salen del mercado, se observa que empieza a haber más salidas que entradas. Las empresas más grandes han disminuido sus actividades de I&D, y las empresas que hacen I&D desaparecen a través de adquisiciones y fusiones. Otro hallazgo importante es el rápido incremento del número de empresas sin experiencia de I&D que compran a otras. Preocupa que estas tendencias erosionen la capacidad de I&D de medicamentos.
Hay que desarrollar mecanismos para mantener y potenciar la innovación farmacéutica.
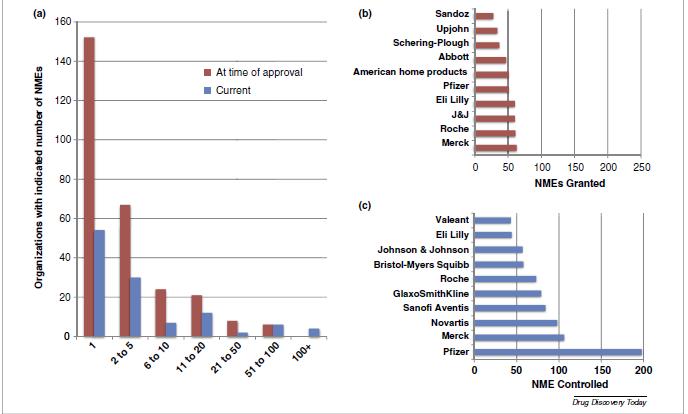
a. Número de NME por organización farmacéutica. Barras rojas organizaciones que controlaban la NME en el momento que se aprobó la NME y barra azul el número de organizaciones que controlan la NME el momento actual
b. Empresas y número de NMEs bajo su control en el momento de su aprobación.
c. Empresas y número de NMEs bajo su control en la actualidad
Referencias