Ensayos Clínicos
Investigaciones
Tachaduras en los protocolos de ensayos clínicos con medicamentos: lo que la industria patrocinadora oculta
(Redactions in protocols for drug trials: what industry sponsors concealed)
Marquardsen M, Ogden M, Gøtzsche PC
Journal of the Royal Society of Medicine, 25 de enero de 2018
http://journals.sagepub.com/doi/full/10.1177/0141076817750554
Traducido por Salud y Fármacos
Objetivo: Describir el tipo de información que la industria tacha en los protocolos contemporáneos de ensayos clínicos aleatorizados con fármacos que patrocinan y que aportan resultados relevantes para el paciente, y evaluar la existencia de un fundamento legítimo para tales eliminaciones de información.
Diseño. Estudio de cohortes. En virtud de la Ley de Libertad de Información, solicitamos acceso a los protocolos de ensayos clínicos aprobados por comités de ética en investigación en Dinamarca entre octubre de 2012 y marzo de 2013. Recibimos 17 protocolos consecutivos, en la los que se habían borrado información antes de que nos los entregaran, y nueve protocolos que no habían sido alterados. Las empresas se negaron a permitir que los comités nos dieran acceso a cinco protocolos adicionales, y en otros tres casos faltaron documentos.
Participantes. No aplica.
Lugar: No aplica.
Medida de resultado principal: Cantidad y naturaleza de la información eliminada con relación a 22 variables clave del protocolo predefinidas.
Resultados: Las partes del protocolo en donde se eliminó más información corresponde a las secciones donde hay más evidencia empírica de que ha habido problemas sustanciales de confiabilidad en los ensayos con medicamentos que se han publicado: análisis de datos, manejo de datos faltantes, detección y análisis de eventos adversos, definición de medidas de resultado, análisis provisionales y finalización prematura del estudio, acceso del patrocinador a los datos que se van generando mientras se ejecuta el estudio, propiedad de los datos y derechos de publicación de los investigadores. Las partes del texto que se habían eliminado diferían ampliamente, tanto entre las empresas como entre los ensayos patrocinados por la misma empresa.
Conclusiones: No pudimos identificar ningún fundamento legítimo para la eliminación de la información. La desconfianza actual en los ensayos de medicamentos patrocinados por la industria solo puede cambiar si la industria ofrece acceso incondicional a los protocolos de los ensayos y a otros documentos y datos relevantes.
Introducción
Se necesita tener acceso a los protocolos de los ensayos para hacer una evaluación adecuada de la veracidad de los informes sobre ensayos con medicamentos, pero es difícil acceder a ellos [1,2]. Las compañías farmacéuticas habitualmente afirman que contienen información comercial confidencial, secretos comerciales o propiedad intelectual, aunque no parece que haya secretos comerciales en los protocolos de ensayos [2].
Cuando, en virtud de la Ley de Libertad de Información, solicitamos acceso a una cohorte de protocolos de investigación de ensayos clínicos con medicamentos en curso que hubieran sido aprobados recientemente por uno de los cinco comités regionales de ética en investigación de Dinamarca tuvimos dificultades. Deseamos comparar la información en los protocolos con la información proporcionada a los pacientes para evaluar si los ensayos fueron éticos y necesarios, y si se había ocultado a los pacientes información esencial sobre los beneficios y los daños de los medicamentos. En varias ocasiones, los comités regionales permitieron que el patrocinador eliminar grandes cantidades de información importante para nuestra investigación, y en algunos casos, ni siquiera recibimos el protocolo. Tras recurrir al Comité Nacional de Ética de la Investigación en Salud, recibimos protocolos para todos los ensayos, que a menudo tenían más información (habían tachado menos) que los que habíamos recibido de un comité local. Esto nos dio una oportunidad única para evaluar si las eliminaciones tenían sentido y eran consistentes entre y dentro de las empresas.
Métodos
Utilizamos el sitio web del Comité Nacional Danés de Ética en la Investigación en Salud para ver los títulos de todos los estudios aprobados por uno de los cinco comités regionales de ética de Dinamarca entre enero de 2012 y marzo de 2013 (1401 proyectos).
La base de datos incluye información sobre la fecha de aprobación, el título del proyecto, las regiones donde se llevará a cabo el estudio y el nombre del investigador que lo coordina. Se realizaron búsquedas en la Plataforma de Registro de Ensayos Clínicos Internacionales de la Organización Mundial de la Salud y en clinicaltrials.gov utilizando como términos de búsqueda el número de identificación del estudio o el título o palabras clave del título de los 1401proyectos. Cuando no logramos encontrar el estudio en los registros de ensayos clínicos, hicimos una búsqueda en Google. La información recopilada incluyó el tipo de estudio, el diseño, la población, las intervenciones, los criterios de inclusión y exclusión, los resultados primarios y el tamaño estimado de la muestra.
Solo nos interesaron los ensayos aleatorizados que podrían ser directamente relevantes para los pacientes y, por lo tanto, excluimos los estudios que utilizaron medidas de resultado subrogadas como resultados primarios, por ejemplo, presión arterial y colesterol, ya que tienden a sobreestimar el beneficio de los medicamentos y a pasar por alto los daños graves [3]. También excluimos los ensayos con un diseño cruzado o los aleatorizados por conglomerados, ya que nuestro objetivo era recopilar una cohorte de proyectos que tuvieran un diseño razonablemente comparable. Un observador realizó el primer cribado de los proyectos y consultó con un observador adicional cuando había incertidumbre sobre su elegibilidad.
Encontramos 212 proyectos que parecían cumplir nuestros criterios, y como queríamos tener una muestra mínima de 60 protocolos, que nuestra investigación previa ha demostrado que es suficiente para proyectos como el actual [4-7] solicitamos acceso a 78 protocolos de ensayos aprobados por un comité regional durante los últimos seis meses (octubre de 2012 a marzo de 2013).
Solicitamos a los comités que nos dieran acceso al protocolo completo y a todos los documentos relacionados, incluyendo los relativos a los derechos de publicación, que no siempre forman parte del protocolo. Resaltamos que nuestros resultados se publicarían de forma que no se pudieran identificar los ensayos individuales y los referimos a nuestras investigaciones previas sobre protocolos [4-7] que habían aportado resultados importantes sobre la seguridad del paciente.
Para evaluar sistemáticamente las características de la información eliminada (tachada), adaptamos un marco de análisis que se utilizó en una revisión Cochrane que comparaba el contenido de los protocolos con los informes de ensayos [8]. En base a los resultados de esta revisión, definimos 22 variables clave del protocolo. Un observador (MM) revisó los protocolos en los que se había eliminado información y observó si las secciones correspondientes a nuestras variables se habían ocultado parcial o completamente. Como esta evaluación fue algo subjetiva, todos los casos ambiguos se discutieron con un segundo observador (PCG). Por lo general, era posible inferir lo que se había tachado de la tabla de contenidos o del texto que no se había tachado nada que recibimos después de nuestra apelación al comité nacional de ética en investigación. En algunos protocolos, pudimos ver lo que habían tachado copiando el texto ennegrecido y pegándolo en un documento de Word. Cuando fue imposible determinar si las secciones que buscamos habían sido eliminadas o simplemente no se mencionaron en un protocolo, las categorizamos como desconocidas.
Resultados
Resultó muy difícil obtener los 78 protocolos que solicitamos a los comités de ética locales y los protocolos originales que contenían toda la información nos fueron entregados con mucha información tachada. El comité nacional de ética de la investigación nos ofreció acceso completo siempre que firmamos un acuerdo de confidencialidad estableciendo que no compartiríamos la información que un patrocinador considera confidencial con otros. A pesar de eso, varias compañías se negaron a proporcionar su protocolo e involucraron a sus abogados. Sanofi-Aventis demandó al comité nacional, pero perdió el caso. Incluso después de un año y medio, los procesos para obtener varios protocolos todavía estaban en curso. Finalmente, en 2016, tres años después de iniciar nuestro proyecto, recibimos el último protocolo que habíamos solicitado.
Se excluyeron ocho protocolos que no cumplieron con nuestros criterios de inclusión: cinco no incluían un resultado primario clínicamente relevante; uno tenía diseño cruzado; uno no fue aleatorio; y uno estaba duplicado.
Solo 17 de los 34 protocolos de ensayos patrocinados comercialmente en los que no se había borrado nada, en comparación con 34 de los 36 ensayos que no tenía patrocinio comercial (p = 0,00003, prueba exacta de Fisher). Sin embargo, también hubo problemas con estos 17 protocolos sin que se hubiera borrado nada. Inicialmente solo recibimos nueve protocolos sin que se eliminara material del comité de ética local, y estos habían sido escritos por Boehringer Ingelheim, Abbott, Pharmacosmos, Celgene, Neotract, Novartis, Threshold Pharmaceuticals, Pfizer y Eli Lilly. No hubo superposición de empresas en absoluto con las 17 empresas con protocolos de los que se habían borrado información (Cuadro 1). Cinco compañías estaban en total oposición de que recibiéramos algo; estas compañías eran Bristol-Myers Squibb, Eli Lilly, Biosensor, Grünenthal e Intarcia. Las tres compañías restantes, no entregaron otros documentos aparte del protocolo: el folleto de los investigadores (Ipsen Pharma); un acuerdo para la realización del ensayo clínico (Novartis); y el acuerdo financiero (Stryker).
Cuadro 1: Compañías patrocinadoras y cantidad de información tachada en los protocolos
| Variables tachadas (%) | Variables desconocidas (%) | Total (%) | |
| Sanofi-Aventis | 73 | 23 | 95 |
| Merck Sharp and Dohmea | 44 | 42 | 86 |
| Novo Nordisk | 41 | 41 | 82 |
| Mundipharma research | 0 | 73 | 73 |
| Bayer | 32 | 27 | 59 |
| Bristol-Myers Squibbb | 39 | 18 | 57 |
| BM ImmunoTherapeutics | 27 | 27 | 55 |
| Glaxo Smith Klineb | 34 | 11 | 45 |
| Janssen | 27 | 14 | 41 |
| Amgenc | 18 | 20 | 38 |
Describimos aquí la información que fue eliminada de los 17 ensayos con patrocinio comercial. La mediana del número de páginas en los protocolos fue 111 (rango: 60 a 197). El grado en que nuestras 22 variables fueron eliminadas se presenta en la Figura 1, y hemos clasificado a las empresas de acuerdo a su nivel de sigilo en el Cuadro 1. Primero describimos los problemas más serios.
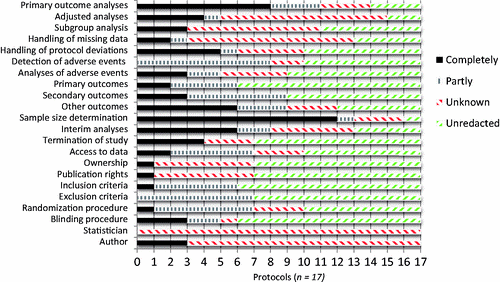
Resultados primarios. En ocho protocolos tacharon toda la información sobre el análisis de los resultados primarios (47%). En cuanto a su definición, no se alteró nada en 11 protocolos, mientras que cuatro ocultaron partes de sus resultados primarios (Sanofi-Aventis había borrado las seis páginas en donde se definían los cinco componentes del criterio de valoración compuesto de eficacia primaria). En los dos protocolos restantes, Bristol-Myers Squibb y GlaxoSmithKline habían ocultado todas las medidas primarias de resultado.
Resultados secundarios. En ocho protocolos no tacharon nada mientras que en seis ocultaron secciones de los resultados secundarios. En los tres protocolos restantes, Bristol-Myers Squibb, Merck Sharp & Dohme y Glaxo-SmithKline ocultaron todos sus resultados secundarios.
Otros resultados. No pudimos ver lo que se había eliminado en tres protocolos. En otros tres protocolos se tachó parte de la información, mientras que en seis protocolos se tachó todo lo que aparecía en secciones como “Resultados exploratorios”, “Otras medidas de impacto” u “Otra medida de impacto de eficacia”. En los otros cinco protocolos restantes, no había una sección de otros resultados.
Análisis ajustados. Solo dos compañías tenían una sección sobre ajustes al análisis que pudiéramos leer. En 12 protocolos, toda la información relacionada con estadísticas fue tachada, mientras que en uno solo se habían tachado algunas partes. Clasificamos a los dos protocolos restantes como desconocidos.
Análisis de subgrupos. Los análisis de subgrupos se describieron en nueve protocolos, tres de los cuales habían redactado toda la información, mientras que los otros seis no la ocultaron. Clasificamos los ocho protocolos restantes como desconocidos.
Manejo de datos faltantes. Merck había tachado todo en dos de sus protocolos; GlaxoSmithKline se refirió a un plan de informes y análisis que no teníamos, y Amgen había tachado partes del contenido. Clasificamos diez protocolos como desconocidos. La información estaba intacta en tres protocolos.
Manejo de las desviaciones del protocolo. En cinco protocolos tacharon todo, y en uno, la mayor parte del texto había desaparecido. Clasificamos cuatro protocolos como desconocidos. En siete protocolos no se había borrado nada, pero uno refería al lector a un Manual de Operaciones Estándar que no teníamos.
Detección de eventos adversos. En dos protocolos de Merck y Mundipharma no fue posible evaluar cómo se manejarían los eventos adversos, ya que los protocolos estaban tan tachados que los registramos como desconocidos. Ocho protocolos tenía textos tachados parcialmente y Sanofi-Aventis tachó la mayor parte del texto en la sección “Obligaciones del investigador con respecto a los informes de seguridad”. Otras compañías también ocultaron información esencial. En dos de sus protocolos, Merck había tachado gran parte de la información de la sección ‘Monitoreo y evaluación de seguridad’; bajo ‘Sobredosis’ se eliminó toda la información de valor; y en un protocolo desapareció toda la información sobre ‘Lista de medidas de seguridad’, ‘Selección de experiencias adversas no graves (si corresponde)’ y ‘Definición de sobredosis para este protocolo’. Novo Nordisk había tachado todo en las secciones ‘Eventos médicos de interés especial’ y ‘Precauciones y / o sobredosis’, mientras que Amgen había oscurecido los riesgos de seguridad de su medicamento en investigación. En siete protocolos no se había eliminado nada del texto.
Análisis de eventos adversos. En tres protocolos, todo fue eliminado. Dos protocolos fueron tenía partes del texto tachadas, y en uno de ellos, GlaxoSmithKline se refirió a un Plan de Informes y Análisis que no teníamos. Cuatro protocolos fueron registrados como desconocidos; no pudimos evaluar si los análisis de seguridad se describieron en la sección sobre consideraciones estadísticas, ya que ésta fue completamente eliminada. En ocho de los protocolos no se había eliminado nada.
Determinación del tamaño de la muestra. En 12 protocolos, toda la información fue eliminada, y en uno, algunas partes fueron tachadas, incluyendo el poder y la tasa de respuesta asumida. Clasificamos tres protocolos como desconocidos. Solo un protocolo, de GlaxoSmithKline, no tenía nada tachado.
Análisis provisionales y terminación del estudio. En seis protocolos, toda la información sobre los análisis provisionales había sido tachada, y en dos, había partes tachadas. Otros cinco protocolos fueron registrados como desconocidos. Dos estudios no incluían un plan de análisis de datos provisionales, y en los dos protocolos restantes, pudimos leer la sección sobre análisis provisional.
Los criterios de terminación se tacharon totalmente en cuatro casos, mientras que tres se registraron como desconocidos. En uno de estos, Novo Nordisk tenía una sección legible, pero refería a una carta de monitoreo de datos y seguridad, que no teníamos, para ver los criterios de terminación. En los diez protocolos restantes, no se ocultaron los criterios de terminación, pero en nueve, el patrocinador se reservó el derecho de finalizar el estudio en cualquier momento. Merck fue la única compañía con un protocolo que incluía criterios sobre cuándo el estudio se podría finalizar prematuramente, pero patrocinaba otro ensayo en el que se reservaba el derecho de finalizar el estudio en cualquier momento.
Acceso a los datos durante la implementación del estudio. Merck había tachado todas las secciones sobre los comités de seguridad y monitoreo en dos protocolos, y cinco protocolos adicionales también tenían tachaduras en esta sección. Siete protocolos tenían el texto completo y los tres restantes fueron registrados como desconocidos.
Además, 11 protocolos, seis de los cuales se registraron como “integros” porque no habían modificado el acceso a la información, referían a cartas de revisión a las que no teníamos acceso. Por lo tanto, en la mayoría de los casos, se desconocía si el patrocinador podía tener acceso a la información acumulada durante la realización del ensayo.
Propiedad de los datos y derechos de publicación. Sanofi-Aventis tachó toda la información sobre la propiedad de los datos. Seis protocolos no tenían tachaduras, pero incluían una declaración de que los datos recopilados durante el estudio eran propiedad exclusiva del patrocinador. No pudimos encontrar ninguna información sobre la propiedad de los datos en los diez protocolos restantes.
Merck había ocultado toda la información sobre el derecho de los investigadores a publicar en un protocolo, y Amgen había tachado alrededor del 80% del texto en un contrato entre el patrocinador y el investigador. Seis de diez protocolos sin tachaduras incluían una declaración por la que el patrocinador necesitaba aprobar los manuscritos o podía exigir la eliminación de información considerada confidencial; en los otros cuatro protocolos, el patrocinador tenía derecho a posponer la publicación. Cinco protocolos fueron registrados como desconocidos; tres de estos referían a una carta o contrato que no teníamos.
Criterios de elegibilidad. Seis protocolos tenían tachaduras en los criterios de inclusión y siete en los criterios de exclusión. Sanofi-Aventis había tachado todos los criterios de inclusión en su protocolo y 28 de 30 criterios de exclusión.
Procedimiento de aleatorización. Sanofi-Aventis había ennegrecido todo. Seis protocolos fueron tachados parcialmente, lo que hizo imposible evaluar si el procedimiento de asignación al azar era adecuado. Tres protocolos adicionales describieron el estudio como aleatorio, pero no pudimos encontrar una sección con el procedimiento, y tres no se modificaron, pero remitieron al lector a otros documentos para obtener detalles, a los que no tuvimos acceso. Por lo tanto, solo cuatro protocolos revelaron el procedimiento de asignación al azar.
Procedimiento de cegamiento. El procedimiento de cegamiento fue completamente tachado en tres protocolos y casi por completo en dos. Clasificamos un protocolo como desconocido. Los 11 protocolos restantes no fueron modificados.
Autores y estadísticos. Ninguno de los 17 protocolos especificó quién era el estadístico. Solo tres protocolos tenían una sección que mencionaba al autor del protocolo, pero estaba ennegrecida. En cinco protocolos, el patrocinador había eliminado los nombres del director del estudio, el investigador coordinador, el director del ensayo o la persona de contacto del patrocinador principal.
Discusión
Hasta donde sabemos, esta es la primera evaluación sistemática de la información de los protocolos de ensayos clínicos que las compañías farmacéuticas no desean divulgar a investigadores independientes. Hay un informe de un caso a cuyo autor, un ex miembro de un comité de ética de investigación, se pidió que participara en un estudio de la vacuna contra la varicela zóster para prevenir el herpes zóster [9]. Él describe sus dificultades para acceder al protocolo de investigación y ofrece una visión general de la información que tacharon cuando finalmente lo recibió. Concluyó sarcásticamente que si prevalecía la política de evitar que los protocolos estuvieran al alcance del público, la pregunta más interesante sería si los comités de ética de la investigación deberían exigir que se informara rutinariamente a los participantes sobre su derecho a acceder a los protocolos tachados.
La cantidad de tachaduras en los protocolos que recibimos fue tan grande que se convirtieron en bastante inútiles para fines de investigación, por ejemplo, para evaluar la justificación ética de los estudios y para identificar discrepancias con las publicaciones subsecuentes [6]. Si hubiera existido un fundamento ético legítimo para las tachaduras, hubiéramos esperado que fueran razonablemente uniformes entre las empresas y dentro de la misma empresa, pero ese no fue el caso. Por ejemplo, Merck Sharp & Dohme tachó prácticamente todo en uno de sus protocolos y mucho menos en sus otros tres protocolos, de modo que, en promedio, el 44% de las variables se habían redactado. Eli Lilly nos negó el acceso a uno de sus protocolos, pero aceptó que obtuviéramos otro sin ninguna tachadura, y Bristol Myers Squibb nos negó el acceso a un protocolo y en promedio tachó el 39% de las variables en otros dos protocolos.
Hubo más tachaduras en aquellas secciones del protocolo en las que existe evidencia empírica de que hay problemas sustanciales con la confiabilidad de los datos publicados de los ensayos con medicamentos. No hay buenas razones para eliminar la definición y el análisis de los resultados primarios, pero hay razones no aceptables para ocultar la mala conducta científica. En la primera revisión sistemática que comparó los protocolos con los informes publicados de los ensayos, encontramos que al menos un resultado primario había sido modificado, introducido u omitido en dos tercios de los informes, y este cambio no se mencionó en un solo informe publicado [4].
Hay muchas formas de manejar datos faltantes y de hacer análisis ajustados, y es preocupante que solo tres y dos protocolos, respectivamente, tuvieran información completa sobre estos aspectos. Anteriormente, informamos sobre las discrepancias no reconocidas sobre los datos faltantes entre los protocolos y las publicaciones en 39 de 49 ensayos y en los análisis ajustados para 23 de 28 ensayos [5].
También es digno de mención que solo un protocolo no tenía tachaduras en la sección de determinación del tamaño de la muestra, ya que esta sección a menudo se cambia post hoc para ajustarse mejor a lo que se obtuvo. En nuestra investigación anterior, encontramos discrepancias no reconocidas para los cálculos del tamaño de la muestra en 18 de 34 ensayos [5].
En la mayoría de los casos, no estaba claro si el patrocinador podía tener acceso a los datos a medida que avanzaba el ensayo y todo lo relacionado con los análisis provisionales estaba tachado en seis protocolos. Además, en la mayoría de los casos, el patrocinador podía finalizar el ensayo en cualquier momento. Anteriormente descubrimos que el patrocinador tenía control potencial sobre un ensayo en ejecución en 32 de 44 ensayos, y que el patrocinador tenía acceso a los datos que se iban acumulando en 16 ensayos, por ejemplo a través de análisis provisionales y de su participación en los comités de monitoreo de datos y seguridad, pero dicho acceso fue revelado en un solo informe del ensayo correspondiente [6]. La posibilidad de que el patrocinador realice un control inapropiado de un ensayo en curso acarrea el riesgo de que el ensayo se detenga cuando los datos son favorables para el patrocinador. Una revisión sistemática de 143 ensayos suspendidos anticipadamente por sus beneficios mostró que los ensayos con menos eventos arrojaron mayores efectos del tratamiento (odds ratio: 28; intervalo de confianza del 95%: 11-73) [10].
No tenemos idea de por qué solo cuatro protocolos revelaron el procedimiento de asignación al azar, ya que no podemos imaginar ninguna ventaja comercial para ocultarlo.
Hubo mucho secreto respecto a la detección y el análisis de eventos adversos, otra área donde los informes de ensayos publicados a menudo no son confiables y a menudo subestiman seriamente los daños de los medicamentos hasta el punto de omitir la mayoría o todas las muertes que ocurrieron [11,12].
Finalmente, es preocupante que los protocolos tengan tan poca información sobre la propiedad de los datos y los derechos de publicación. Cuando se publica dicha información, a menudo no es confiable. Obtuvimos acceso a los protocolos completos y sin tachaduras de una cohorte de ensayos patrocinados por la industria publicados en The Lancet y descubrimos que no había información sobre el acceso de los autores académicos a los datos en 67 de los 69 protocolos [13]. Esto contrastaba notablemente con los artículos publicados, que en 64 ensayos indicaban que uno o más autores académicos tenían acceso a los datos. Parece que en los últimos tiempos se ha vuelto más común que los acuerdos de publicación aparezcan en un documento separado del protocolo, al que nadie tiene acceso, aparte de la empresa y los investigadores académicos [6].
Limitaciones
No abordamos todos la información que había sido eliminada en los protocolos, ya que nos centramos en un conjunto de variables predefinidas, y no teníamos acceso a documentos complementarios que las empresas no habían enviado a los comités de ética de la investigación.
Conclusiones
La reproducibilidad y el control meticuloso de los resultados y el riesgo de sesgo, también por personas que no participan en la investigación, y la comparación de lo publicado con lo planificado, son elementos esenciales de la ciencia. Cuando esto no es posible, la ciencia deja de existir [14]. La desconfianza actual en los ensayos con medicamentos patrocinados por la industria solo puede cambiar si la industria colabora en todo lo que importa a los pacientes, los médicos y la sociedad en general, incluyendo el acceso incondicional a los protocolos de los ensayos, y a todos los documentos adicionales como las cartas de los comités de control de datos (que a menudo contienen información sobre las reglas de detención del ensayo), el folleto para los investigadores, los contratos entre el patrocinador y los investigadores, datos anonimizados de pacientes en bruto y formularios de informes de casos [15].
Referencias