Políticas
Europa
España. Todo lo que siempre quiso saber sobre financiación y no se atrevió a preguntar
J. Ruiz-Tagle
El Global, 16 de marzo de 2019
http://www.elglobal.net/politica-sanitaria/todo-lo-que-siempre-quiso-saber-sobre-financiacion-y-no-se-atrevio-a-preguntar-EY1463035#pk_campaign=Newsletter%3A+El+Global+Express%2FNewsletter&pk_kwd=Todo+lo+que+siempre+quiso+saber+sobre+financiaci%C3%B3n+y+no+se+atrevi%C3%B3+a+preguntar
El título de este reportaje puede sonar presuntuoso, pero no lleva tal intención. Tan sólo se pretende acercar al lector una información condensada y práctica sobre la vida de un fármaco hasta que los pacientes pueden disfrutar de sus ventajas terapéuticas. Gracias a un informe realizado por la Fundación Weber, en colaboración con Roche, es posible trasladar al lector esta información.
En España, la autorización de comercialización corre a cargo de la Agencia Española de Medicamentos. A continuación, la Dirección General de Farmacia decide si el producto es de interés para su inclusión en la lista de medicamentos financiados. Es aquí donde se encuadra la pregunta del millón. ¿Qué necesita un fármaco para ser del interés del Ministerio? La respuesta comienza en 2006, cuando se aprobó la Ley de Garantías que constituye la regulación básica de evaluación y financiación de estos productos.
Desde entonces, y como reacción a la crisis económica, se ha producido una continua sucesión de Reales Decreto (años 2009, 2010 —en dos ocasiones—, 2011, 2012 y 2014) que han tenido el propósito de completar o modificar la ley. Para aumentar la seguridad jurídica, en 2015 se aprobó el texto refundido de todas estas legislaciones para actualizar la norma de 2006. Pues bien, la inclusión de medicamentos en la financiación del Sistema Nacional de Salud se realiza teniendo en cuenta distintos criterios que puede observar en la tabla que encabeza este reportaje.
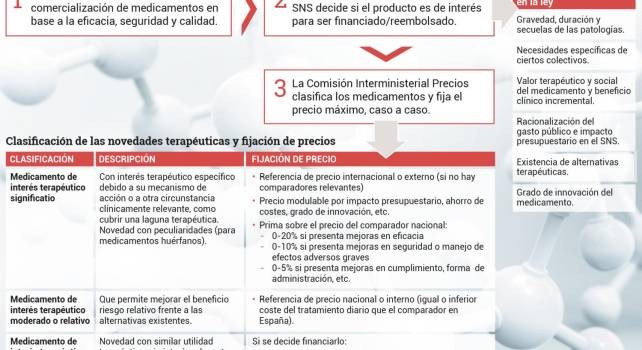
El siguiente paso, una vez decidida la financiación, es la fijación del precio máximo por parte de la Comisión Interministerial de Precios de Medicamentos (CIPM). Este organismo se encarga de fijar los precios caso a caso —de modo motivado y conforme a criterios objetivos— considerando por un lado la documentación aportada por la compañía farmacéutica, por otro los análisis de coste-efectividad y, sobre todo, de impacto presupuestario, así como los informes que elabore el Comité Asesor para la Financiación de la Prestación Farmacéutica del SNS.
Sin llegar a declararlo explícitamente, la CIPM clasifica los nuevos medicamentos en tres grupos diferenciados (ver tabla), en función de su interés terapéutico, y según los cuales posteriormente toma distintas decisiones de precio. Normalmente, si el nuevo medicamento tiene un interés terapéutico significativo porque se comercializa por primera vez, se tendrá en cuenta como referencia el menor precio de la eurozona. Aquí cabe recordar aquí que en 2016 el Tribunal Supremo declaró nula la bajada automática de precio si en otro país de la UE era inferior al que tenía en España.
Pero en este país las decisiones finales están descentralizadas. Entonces, ¿qué ocurre en las comunidades autónomas? Esta pregunta es más difícil de sintetizar porque prácticamente cada región cuenta con organismos que sirven de apoyo a la toma de decisiones sobre la incorporación efectiva de los medicamentos. Buscando una respuesta homogénea, la Fundación Weber recuerda un ejercicio de buenas prácticas implementado por el Comité Mixto de Evaluación de Nuevos Medicamentos para evaluar el valor añadido de la novedad terapéutica (exceptuando a las especialidades farmacéuticas genéricas y los medicamentos de uso hospitalario). Este organismo —integrado por los comités de Andalucía, Navarra, Cataluña, Aragón, Castilla-León y País Vasco— utiliza un algoritmo de decisión común con el fin de aumentar la transparencia y homogeneidad del proceso. El algoritmo asigna una puntuación entre 1 y 4 en función de la eficacia y seguridad comparadas del fármaco, que es ajustada posteriormente por factores como la pauta de administración, el coste relativo del medicamento o el ratio beneficio/riesgo en subgrupos de población.
Hasta aquí el presente, pero ¿y el futuro? El Plan Normativo del Gobierno para 2018 ha descartado desarrollar el Real Decreto de Precios y Financiación para medicamentos y el ‘innovómetro’ encargado a la Universidad de Alcalá duerme el sueño de los justos. Por tanto, es de esperar que, a excepción de modelos innovadores como el caso Spinraza, el presente año no traerá consigo ningún sobresalto legislativo.
Nota: Los gráficos no se ven bien en la versión original