Agencias Reguladoras
Unión Europea
El enfoque común en el uso compasivo de medicamentos fracasa en Europa
El Global, 1 de abril de 2016
http://www.elglobal.net/noticias-medicamento/2016-04-01/politica-sanitaria/el-enfoque-comun-en-el-uso-compasivo-de-medicamentos-fracasa-en-europa/pagina.aspx?idart=974630&utm_source=mail&utm_medium=newsletter&utm_campaign=elglobal
La EMA constata en STAMP las “múltiples diferencias” que se registran en los estados miembro
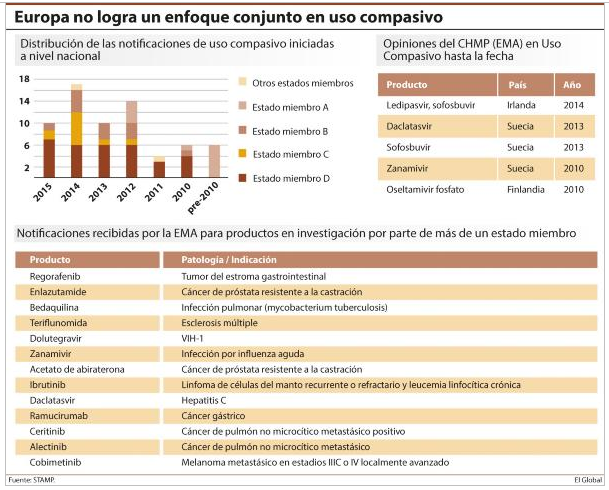
Si de algo están sirviendo las reuniones del Grupo para un Acceso Seguro y Temprano a los Medicamentos (STAMP) entre los estados miembro, la Comisión Europea y la Agencia Europea del Medicamento (EMA) no es sólo para intentar poner en común las bases de un nuevo enfoque regulatorio que impulse de manera conjunta el acceso a la innovación en la Unión Europea, sino también para poner de relieve lo lejos que aún se está del objetivo en algunos campos. El uso compasivo de medicamentos es uno de ellos. Una de las conclusiones del último encuentro de STAMP, celebrado el pasado 10 de marzo en Bruselas, ratifica que el enfoque común que se intentó fomentar en Europa no se ha alcanzado. Como resultado, han proliferado las diferencias entre los estados miembro.
El uso compasivo es una opción que permite el tratamiento con un medicamento no autorizado en pacientes que no pueden entrar en un ensayo clínico o que sufren una patología para la que no existe una terapia satisfactoria autorizada. Su base legal se marcó por directiva en 2001. Tres años después, un reglamento reconoció la necesidad de un enfoque común en Europa. Su artículo 83 establece la obligatoriedad de los estados miembro de elevar una notificación a la EMA cada vez que hicieran uso de esta herramienta. El mismo precepto regula también la posibilidad de que, al tiempo que presentan esta notificación, los estados puedan solicitar al Comité de Medicamentos de Uso Humano (CHMP) de la Agencia su opinión sobre la población diana del fármaco y sus condiciones de utilización y distribución en uso compasivo, con vistas a que dicha opinión pudiera ser de aplicación en el resto de estados miembro.
Para facilitar la implementación del artículo 83, la EMA desarrolló unas guías sobre uso compasivo de los medicamentos. La experiencia acumulada, presentada en STAMP, deja mucho que desear.
Objetivo no conseguido
Según el análisis llevado a cabo por la Agencia, desde que las guías se pusieron a disposición de los estados, muy pocos de ellos han notificado su intención de llevar a cabo programas de uso compasivo para grupos de pacientes (ver tabla). Además, de los pocos que han sido notificados, sólo se ha requerido la opinión del Comité de Medicamentos de Uso Humano en cinco ocasiones (tres por parte de Suecia, una por parte de Irlanda y otra por parte de Finlandia) y para dos patologías (influenza y hepatitis C).
La experiencia de la industria farmacéutica innovadora confirma el fracaso del enfoque conjunto en uso compasivo y su impacto a varios niveles. Según su patronal en Europa, la Efpia, los diferentes enfoques que los estados miembro han ido adoptando en los últimos años han aumentado la brecha en el acceso a los medicamentos innovadores y elevado la carga administrativa sobre todos los agentes. Invitada a STAMP, Efpia presentó su visión sobre el uso compasivo en Europa y las lecciones extraídas, en concreto, con el caso de daclatasvir, el tratamiento para la hepatitis C y uno de los cinco sobre el que el CHMP emitió una opinión.
El informe presentado por BMS, la compañía que comercializa el fármaco, alude a una “implementación a medida” en los estados, con una población base de tratamiento establecida solo en siete de ellos Asimismo, aunque la opinión y recomendación del CHMP fue seguida por los estados, no se hizo por igual, habiéndose registrado diferencias también por encima de las propias recomendaciones de la Agencia Europea del Medicamento.
Por último, el hecho de que los estados miembro apenas hayan hecho uso de las provisiones incluidas en el artículo 83 del reglamento europeo ha generado, según la Efpia, una “falta de experiencia” y una divergencia de criterios que hay que solventar. Los requerimientos planteados por las autoridades sanitarias varían, como también lo hacen los protocolos de tratamiento, las guías o los tiempos de aprobación.
La conclusión, para la EMA, es clara: “el enfoque común para los programas de uso compasivo no se ha conseguido y hay múltiples diferencias entre los estados”. Sobre la mesa de STAMP se han presentado ya algunas propuestas para reconducir la situación.
Recetas de la industria
Para la industria, sería beneficioso alinear los principios de implementación de los programas de uso compasivo, incluyendo la recogida de datos de eficacia y seguridad. Asimismo, sugiere que se estudien vías para que los pacientes y la industria puedan ser elementos desencadenantes de nuevos programas, con la mediación de los estados.
Por último, la Efpia solicita que se lleven a cabo estudios sobre los programas de uso compasivo en curso en los estados miembro y sobre el funcionamiento de los mecanismos de contacto con la EMA. La patronal también exige conocer la causa principal de porqué los estados no están notificando a la agencia la implementación de los programas, como obliga el reglamento.