Un informe histórico [1], encargado conjuntamente por los Ministerios de Investigación y Salud franceses, establece un plan integral para reducir el desperdicio en la investigación, específicamente cuando se trata de ensayos clínicos, y acelerar la publicación de resultados.
En particular, el informe insta a introducir primero un reglamento y luego una legislación nacional que exija que los resultados de todos los ensayos clínicos se publiquen en los registros de ensayos en el plazo de un año.
Según el Monitor de Ciencia Abierto de Francia [2], solo el 44% de los ensayos clínicos franceses que se concluyeron durante 2022 habían publicado sus resultados un año después, incluyendo el 54% de los estudios patrocinados por la industria y solo el 15% de los ensayos académicos.
Estas cifras probablemente sobreestiman la magnitud del desperdicio en investigación debido a la metodología empleada [3].
Sin embargo, múltiples estudios muestran sistemáticamente que Francia está significativamente por detrás del Reino Unido y Alemania en cuanto a la reducción del desperdicio de investigación [4], como se muestra en el mapa y en el siguiente ejemplo.
De cero a héroe
La Organización Mundial de la Salud ha exigido que todos los resultados de los ensayos clínicos se publiquen en el plazo de un año a partir de su conclusión [5]. En Francia, esto ya es un requisito legal para los ensayos con medicamentos, así como en todos los demás países de la Unión Europea.
El nuevo informe presenta una larga lista de recomendaciones para lograr este objetivo.
“El grupo recomienda que la publicación de los resultados se integre en los programas de formación en investigación clínica, en los acuerdos financieros de los ensayos clínicos que recluten en Francia, en los procedimientos de evaluación colectiva e individual de la investigación clínica, y que esta cuestión se tenga en cuenta en las estrategias institucionales relacionadas con la integridad científica”.
“El grupo también sugiere ampliar la normativa nacional y europea a todos los ensayos clínicos. De hecho, no hay ninguna justificación ética, científica o de salud pública que justifique la situación actual, donde los ensayos clínicos no farmacológicos están exentos de la obligación [legal] de publicar sus resultados”.
“Lo más importante de nuestro informe es que involucremos a todos” para solucionar el problema, declaró el presidente del grupo de trabajo, el profesor Philippe Ravaud, al periódico Le Monde [6].
Programa de reforma integral
Entre las medidas específicas que se recomiendan a las distintas partes del ecosistema de ensayos clínicos se incluyen:
A partir de 2025, mediante regulación, se establecerá la obligatoriedad de publicar los resultados de todos los ensayos clínicos en los registros de ensayos clínicos, según la definición de la OMS, más allá de los ensayos con medicamentos, en el plazo de un año. Posteriormente, se aprobará la legislación pertinente.
Modificar los criterios de evaluación de los patrocinadores e incluir la publicación de resultados en los indicadores para la financiación.
Enviar a cada patrocinador un informe con la lista de los ensayos para los que no han publicado los resultados, para instarlos a identificar y corregir los fallos de publicación.
Enviar recordatorios a los investigadores principales que no hayan transmitido al patrocinador la información necesaria para publicar los resultados de los ensayos concluidos antes de la fecha límite (que un año después de la finalización del ensayo).
Todos los financiadores deben publicar indicadores sobre la publicación de los resultados de los ensayos que financian en los registros y en las publicaciones científicas.
Condicionar el pago de la última cuota de financiación a la publicación de los resultados en un plazo de doce meses tras la finalización del ensayo.
Desarrollar una herramienta de código abierto para generar una plantilla de resultados que se publicará directamente en los registros de ensayos clínicos.
Incluir explícitamente la publicación de ensayos en las políticas de integridad científica de las organizaciones patrocinadoras de ensayos clínicos.
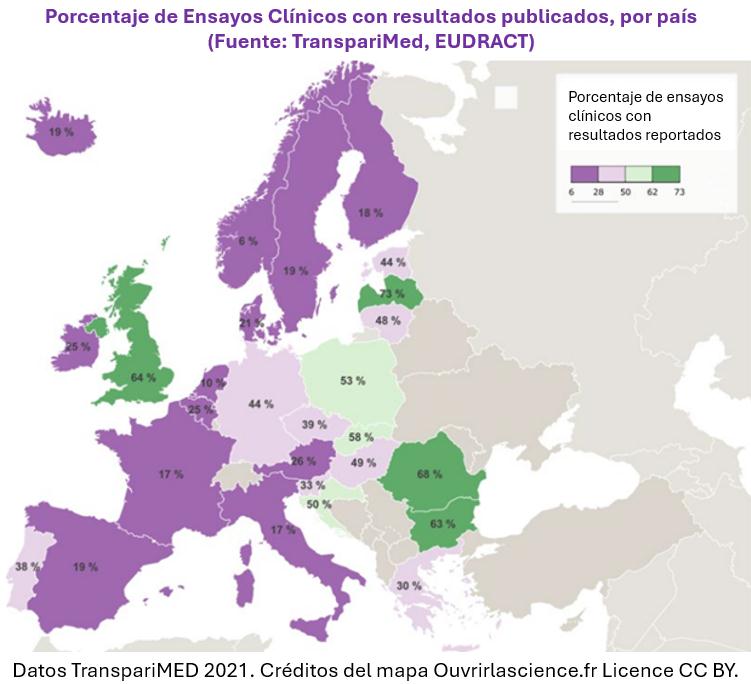
Pioneros en Europa continental
Según la información que tiene TranspariMED, hasta la fecha, el Reino Unido ha sido el único país del mundo que ha publicado una estrategia nacional comparable para mejorar la transparencia de los ensayos clínicos.
Años después, la estrategia del Reino Unido ha generado mejoras muy significativas en el registro de ensayos clínicos y probablemente también ha mejorado significativamente la notificación de resultados [7]. Cabe destacar que ahora, en el Reino Unido, hay una lista de todos los ensayos con pacientes que recibieron aprobación ética que está disponible al público, una primicia mundial.
Sin embargo, la Autoridad de Investigación en Salud del Reino Unido ha incumplido, hasta la fecha, sus promesas de registrar automáticamente los ensayos, supervisar sistemáticamente si se publican los resultados o no, y realizar un seguimiento activo de los resultados faltantes.
En EE UU, hace muchos años que la ley obliga a que se divulguen los resultados de algunos ensayos. La mayoría de los grandes patrocinadores estadounidenses ahora publican de forma sistemática y rápida los resultados de dichos ensayos en el registro ClinicalTrials.gov [8], a pesar de las persistentes demoras de la FDA en exigir el cumplimiento de esta norma [9].
También se están realizando esfuerzos para mejorar la notificación de ensayos clínicos en Alemania y los países nórdicos, pero estos suelen estar liderados por grupos Cochrane nacionales, en lugar de estar impulsados por los gobiernos nacionales.
Till Bruckner, fundador de TranspariMED, afirmó:
“El informe francés es excelente y establece un plan muy claro, realista y viable para acabar con el desperdicio en la investigación”.
“Si estas medidas se implementan plenamente, generarán un enorme ahorro para los contribuyentes franceses, además de mejorar la base de evidencia médica global”.
“El principal reto que tenemos por delante es que los pacientes, médicos y organizaciones de salud francesas mantengan la atención y garanticen que este impulso positivo se mantiene y que todas las recomendaciones se implementan rápidamente”.
El informe está disponible en línea tanto en inglés como en francés [1]. Incluye varios anexos que resumen las normas y las disposiciones legales globales relevantes.
Referencias
Nota de Salud y Fármacos: Una nota sobre este informe publicada en Statnews nos recuerda que el sesgo en la publicación de los resultados de los ensayos clínicos puede resultar en la toma de decisiones mal informadas, y que el año pasado se actualizó la Declaración de Helsinki para que los investigadores médicos sean responsables no solo de publicar los resultados de los estudios, sino también de hacerlo de manera oportuna [1].
En 2017 entró en vigor una norma en EE UU para fortalecer los requisitos de divulgación de resultados, pero su cumplimiento ha sido, en el mejor de los casos, irregular. Los resultados de más de 5.600 ensayos de un total aproximado de 26,100, o casi el 22%, no se han publicado, según la base de datos FDAAA Trials Tracker [1].
En el Reino Unido, un informe parlamentario publicado en 2018 reveló que aproximadamente la mitad de los ensayos clínicos no se habían publicado, el registro de ensayos clínicos aún no era universal y los resultados notificados no siempre coincidían con las propuestas originales de los estudios. Al año siguiente, el presidente de una comisión parlamentaria del Reino Unido advirtió a docenas de universidades que tenían seis meses para mejorar la información sobre los resultados de los ensayos clínicos o serian sometidos a audiencias. Un análisis reveló que la estrategia funcionó: para 2021, 20 importantes universidades divulgaron el 91% de los resultados de sus ensayos, frente a tan solo el 29% poco antes de que se emitieran las advertencias [1].
Referencia