Investigaciones
Regulación final para el uso de un solo CEI para ensayos multicéntricos
(Final NIH policy on the use of a single institutional review board for multisite research)
VM Gordon, MA Culp, CD Wolinetz
Clinical and Transnational Science, 2 de marzo de 2017, OI: 10.1111/cts.12447
http://onlinelibrary.wiley.com/doi/10.1111/cts.12447/full
Traducido por Salud y Fármacos
Introducción
Durante casi 50 años, por legislación consuetudinaria o de hecho (common rule) los Comités Institucionales de Revisión (IRBs en EE UU o Comités de Ética Institucionales en otros países -CEI) han vigilado la protección de los derechos humanos y el bienestar de quienes participaban en investigaciones financiada por el gobierno federal. Los Institutos Nacionales de Salud (NIH), reconociendo que las políticas de investigación deben evolucionar con la ciencia y asegurar tanto la eficiencia como la protección de los sujetos de investigación, emitieron en junio de 2016 una Regulación sobre el Uso de un Solo CEI en la Investigación Multicéntrica [1]
Revisión histórica
El principio de utilizar un solo CEI para monitorear los estudios clínicos multicéntricos no es nuevo. En 2004, el secretario del Comité Asesor de la Protección de la Investigación en Humanos anotaba que los CEIs se usaban muy poco y sugirió que se organizara un taller para examinar los retos asociados con uso de alternativas a la revisión de un CEI local. El taller tuvo lugar en 2005 y lo patrocinaron los NIH, la Asociación Americana Facultades de Medicina (AMCC), la Sociedad Americana de Oncología (ASCO), y la Oficina de Protección de la Investigación en Humanos (OHRP) [2]. Entre los modelos que se discutieron en el taller varios incluían un CEI único o central.
Esto llevó a que un año después se celebrara la Conferencia Nacional de Modelos Alternativos de CEIs, organizada por los líderes del taller previo, así como también otras agencias federales y un número de organizaciones representando a los centros de investigación, administradores de investigación y sociedades científicas de diferentes especialidades. Esta segunda reunión enfatizó que, en el caso de ensayos multicéntricos, los CEIs locales eran duplicativos y tomaban mucho tiempo. Los ponentes describieron el apoyo institucional para el uso de CEIs centrales y concluyeron que, aunque el uso de modelos alternativos a la revisión del CEI estaba aumentando, era necesario tener más apoyo por parte de los patrocinadores y agencias reguladoras. Más tarde, en 2009, la Oficina para la Protección de la Investigación en Humanos (OHRP) emitió un Aviso de Registro Federal preguntando si la OHRP debería proceder con un aviso para proponer legislación (NPRM) que permitiera que la OHRP hiciera a los CEIs y a las instituciones u organizaciones que tienen CEIs directamente responsables de cumplir ciertos requerimientos de las regulaciones del Departamento de Servicios Sociales y de Salud (DHHS) para la protección de sujetos humanos [3]. La OHRP estaba contemplando este cambio en la regulación para estimular a las instituciones a confiar en los CEIs que funcionan en otras instituciones, cuando fuera apropiado.
En 2009, empezó a prepararse un Aviso Anticipado de Propuesta de Cambio Regulador (Advanced Notice of Proposed Rulemaking ANPRM) para revisar y actualizar la legislación consuetudinaria (Common Rule 45 CFR part 46) [4]. El ANPRM, que se publicó en 2011, incluía una solicitud de comentario sobre la viabilidad, ventajas y desventajas de hacer obligatorio un CEI único para todos los estudios sujetos a la legislación consuetudinaria, que se hacen EE UU y son multicéntricos. En 2014, los NIH publicaron, con el objeto de recibir comentarios, un borrador de Regulación para el Uso de un Solo CIE en la Investigación Multicéntrica. El mandato propuesto por la ANPRM, que es consistente con la expectativa final de la política de los NIH, también se propuso en 2015 en el Aviso de la Legislación Consuetudinaria de Cambio Regulador (Figura 1) [5].
Al mismo tiempo que se hacían estas propuestas, se incrementaban las peticiones para reducir la carga y mejorar el proceso de revisión de los ensayos clínicos multicéntricos. El apoyo para el uso de un CEI único se incluyó en el informe de 2011 de la Comisión Presidencial para el Estudio de Temas Bioéticos “Moral Science: Protecting Participants in Human Subjets Resarch” [6].
La Comisión recomendó reducir “los comités institucionales de revisión [que corresponden a los comités de ética de investigación CEIs] que fueran innecesarios, duplicativos o redundantes en los estudios multicéntricos” y dijo que: “El uso de un solo CEI debería ser la norma a no ser que las instituciones o investigadores tengan una justificación para actuar de otra forma”. En 2014, el informe de la National Science Foundation titulado “La Reducción del Trabajo Administrativo de los Investigadores Financiados con Fondos Federales” recomendó que los reguladores apoyaran el uso de un solo CEI en los ensayos multicéntricos y redujeran la responsabilidad institucional, como parte de las reformas reguladoras para reducir las tareas administrativas. Más recientemente, el informe de 2016 de la National Academy of Science “Para Mejorar las Inversiones Nacionales en la Investigación Académica: Un Nuevo Marco Regulador para el Siglo XXI” se hizo eco de la anterior propuesta de un solo CEI para centros nacionales, pero autorizando excepciones para centros con necesidades específicas (por ejemplo, la soberanía de las tribus indígenas de EE UU).
La propuesta para utilizar un solo CEI en la propuesta ANPRM de la Legislación Consuetudinaria, el borrador de política de los NIH sobre el Uso de un Solo CEI para Ensayos Multicéntricos, y el NPRM de la Legislación Consuetudinaria recibieron principalmente comentarios positivos de la ciudadanía. En relación al borrador de política de los NIH, investigadores, científicos y sociedades profesionales, y asociaciones de defensa de los pacientes apoyaron el uso de un solo CEI para ensayos multicéntricos que usan el mismo protocolo. Los comentarios decían que la política ayudaría a hacer más eficiente la revisión del CEI sin debilitar sino más bien aumentando la protección de los que participaran en investigación.
Fig 1. Cronograma de eventos relacionados con un solo CEI para supervisor estudios clínicos multicéntricos.
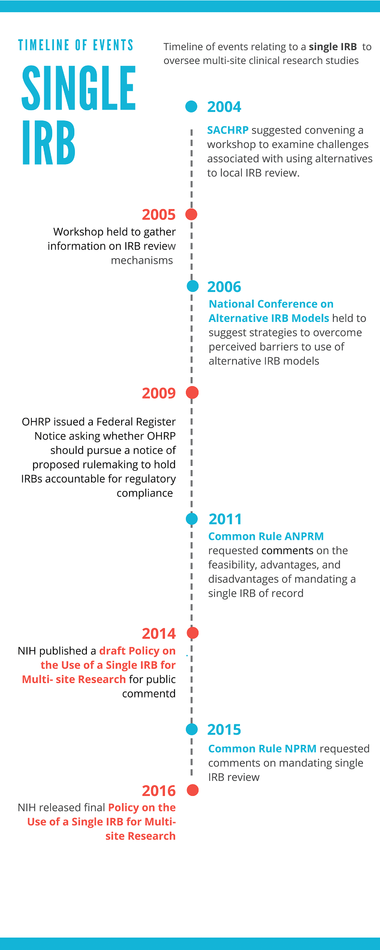
La mayoría de los comentarios también apoyaban el acercamiento propuesto por los NIH de promover el uso de un único CEI al convertirlo en la norma a seguir en todos los estudios multicéntricos realizados en EE UU, a no ser que por razones especiales fueran excluidos. Las universidades y las organizaciones que las representaban fueron más críticas, y en general no estuvieron de acuerdo con el alcance de la propuesta y sugerían que los NIH incentivaran a las instituciones para que confiaran en un solo CEI. Los NIH, al preparar la última propuesta tuvieron en cuenta todos los comentarios recibidos
La implementación de la propuesta de los NIH
La propuesta final de los NIH para el Uso de un Solo CEI para Ensayos Multicéntricos está diseñada para promover y avanzar este cambio de paradigma en la revisión de los CEIs. El inicio de su implementación se ha retrasado para facilitar que la comunidad de investigadores tenga tiempo para ajustar sus procesos administrativos; se pondrá en práctica a partir del 25 de mayo de 2017. La regulación es para todos los centros que en EE UU implementan el mismo protocolo de investigación con humanos, siempre que no estén exentos de revisión por un solo CEI.
Esperamos que todos los problemas relacionados con la implementación de esta regulación se resuelvan prontamente. Una vez que tenga lugar el cambio, incluyendo los cambios en las regulaciones y procedimientos institucionales, se anticipa que los beneficios del uso generalizado de un solo CEI superen los inconvenientes que los cambios hayan podido causar a los investigadores y a las instituciones. Para facilitar una transición con el menor número posible de dificultades, los NIH y otros están preparando instrumentos para ayudar a las instituciones y los investigadores a hacer los cambios. Además, el SACHRP está trabajando en una serie de Puntos que Hay que Tener en Cuenta que deberán ser de gran ayuda a la comunidad investigadora.
Como varios de los que hicieron comentarios públicos a la propuesta de la regulación de los NIH pidieron ayuda específica sobre cómo preparar el presupuesto para la revisión por un CEI único para incluirlo en las solicitudes de becas y en las propuestas de los contratos, los NIH ha publicado una Guía con varios estudios de casos (NOT-OD-16-109) describiendo cómo se pueden cargar los costos, directos vs. indirectos, asociados a la revisión por un solo CEI.
Una importante iniciativa diseñada para facilitar a las instituciones de investigación a confiar en CEIs externos es la Plataforma de Confianza en CEIs de Recursos para Ensayos Agilizados, Multicéntricos y Rápidos (SMART), un recurso desarrollado por el National Center for Advancing Translational Sciences (NCATS) de los NIH [
Antes de la fecha de implementación de la nueva regulación, los NIH esperan divulgar una serie de Temas que se Preguntan Frecuentemente, diagramas de flujo, y guías. Es importante recordar que la regulación excluye a ciertas instituciones, algunas becas de los NIH, y poblaciones específicas. La regulación establece que se pueden pedir otras excepciones cuando existe una justificación apremiante. Los centros extranjeros, el entrenamiento institucional y becas para ayudantes de investigación y poblaciones para los cuales hay requisitos federales, estatales o requisitos de las tribus americanas para que se haga una revisión local no están sujetos a esta regulación. La regulación establece que se pueden pedir otras excepciones cuando existe una justificación apremiante. Estas decisiones se harán públicas, las concederán los NIH y no necesitarán ningún otro trámite.
Cada vez más, hay CEIs que se usan y desarrollan para revisar ensayos multicéntricos. Aunque nosotros y muchos otros están convencidos de que en unos pocos años su uso será la norma, y las molestias que se experimenten durante la transición se convertirán en un vago recuerdo, los NIH se comprometen a monitorear el impacto de la nueva regulación en la investigación. Con el paso del tiempo, anticipamos ver beneficios para la investigación, por ejemplo, la iniciación más eficiente de los ensayos multicéntricos, el mantenimiento de altos estándares de protección para los humanos que participan en experimentos, y la reducción de la carga administrativa.
Conflictos de intereses
Los autores declaran no tener conflictos de intereses.