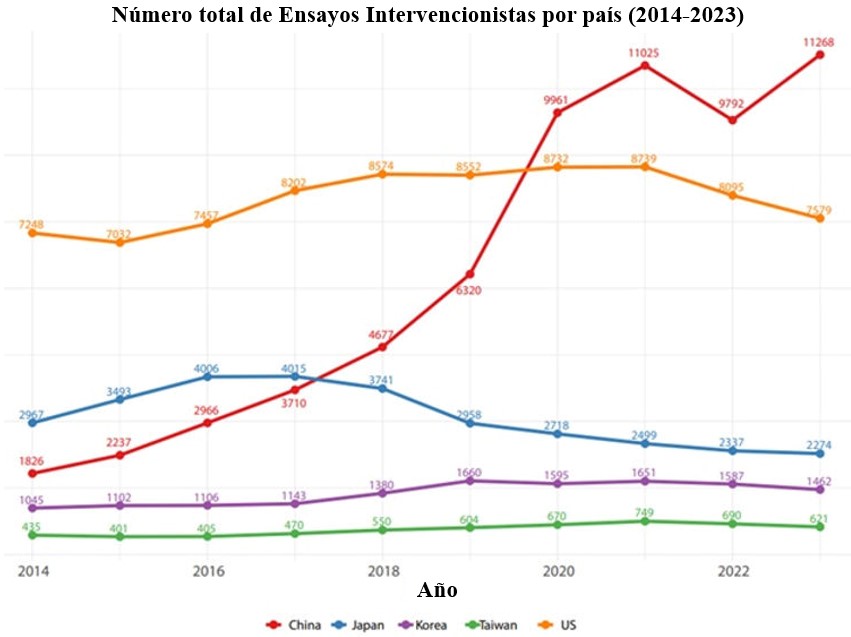
A China é agora o principal centro mundial de ensaios clínicos. Um novo estudo [1], baseado em dados de múltiplos registros de ensaios clínicos, mostra que, em 2023, foram registrados na China mais de 11.000 ensaios clínicos intervencionistas — aproximadamente 50% a mais do que nos Estados Unidos.
É claro que um número maior de ensaios não equivale necessariamente a um maior avanço no conhecimento científico útil. Por exemplo, o Reino Unido destacou-se por ter gerado evidências sólidas e úteis sobre possíveis tratamentos para a covid-19, justamente porque concentrou seus esforços em um pequeno número de ensaios amplos e bem desenhados.
No entanto, o novo estudo deixa claro que a China é agora uma potência mundial em pesquisa clínica.
Preocupação com a transparência
Isso é preocupante, pois há indícios de que a transparência nos ensaios clínicos realizados na China pode ser consideravelmente menor do que na Europa ou nos Estados Unidos.
Estudos recentes, conduzidos por um bolsista da TranspariMED, revelaram que a legislação chinesa não exige que empresas e universidades publiquem os resultados de seus ensaios clínicos [2], e encontraram indícios de deficiências na divulgação de informações por parte das empresas biofarmacêuticas chinesas que operam no exterior [3].
Da mesma forma, o novo estudo revelou que muitos ensaios clínicos realizados na China e em outros países do leste da Ásia não estão sendo registrados prospectivamente [1].
Lacunas de dados em ensaios clínicos na Ásia Oriental
Os autores do novo estudo também tentaram documentar quantos resultados de ensaios clínicos nunca foram publicados na China, Japão, Coreia do Sul e Taiwan, mas descobriram que:
“Um dos problemas importantes foi a dificuldade para determinar se o estudo havia sido concluído. Os dados foram extraídos de vários registros da plataforma International Clinical Trials Registry Platform (ICTRP), mas as diferenças nos formatos dos diferentes registros impediram a recuperação da informação sobre a conclusão do estudo, restando apenas informações sobre o status de recrutamento.”
“Ao acessar as páginas da web (URL) do registro original, é possível fazer uma revisão direta de cada registro, e foi fácil encontrar a informação sobre a conclusão do estudo em ClinicalTrials.gov. No entanto, no caso de outros registros, foi difícil identificar com clareza o status ou as datas de conclusão do estudo. Portanto, não pudemos avaliar comparativamente as taxas de notificação de resultados dos ensaios registrados em diferentes países.”
Uma revisão recente da Cochrane [4], baseada em dados de mais de 200 estudos, constatou que — em nível global — 47% dos resultados de ensaios clínicos não são publicados, mas os estudos revisados provinham majoritariamente do Atlântico Norte, o que não responde à pergunta sobre o que ocorre com os ensaios chineses (ou indianos, ou japoneses).
Essa persistente lacuna de conhecimento se deve, em parte, à infraestrutura deficiente de registro, mas também ao fato de que a maioria dos cientistas, reguladores e metapesquisadores ainda se concentram na Europa e nos Estados Unidos, de forma um tanto míope.
O desastre do registro global
Essas deficiências persistentes na infraestrutura do registro global minaram os esforços de resposta à covid-19 em todo o mundo [5] e continuam a impedir a obtenção de uma visão abrangente sobre a pesquisa médica em andamento e sobre as novas descobertas científicas.
(Por exemplo, por que foi necessário um estudo complexo para descobrir quantos ensaios clínicos estão sendo realizados na Ásia Oriental e em quais áreas de doenças eles se concentram?)
A equipe do estudo concluiu que:
“Muitos estudos, incluindo ensaios clínicos randomizados, não foram registrados prospectivamente… Um problema crítico que surgiu durante nossa análise foi a necessidade de melhorar o controle de qualidade dos registros de ensaios…”
“A inconsistência no formato entre os registros, incluindo variações na forma como as informações foram registradas, gerou desafios significativos para a padronização dos dados e, consequentemente, para a comparação do que ocorre em diferentes países. Por exemplo, as categorias relacionadas ao desenho do estudo, como alocação e randomização, foram consideravelmente diferentes entre os diversos registros.”
“No ChiCTR [o registro chinês], os tamanhos de amostra previstos para o grupo controle e para os braços de intervenção múltipla são apresentados em formato de texto, e não como um número total. Isso exigiu um esforço adicional durante a extração dos dados. Se não houver uma padronização adequada dos dados dos ensaios e um fortalecimento do controle de qualidade, aumenta o risco de se obter registros de ensaios imprecisos ou incompletos, o que pode levar a interpretações equivocadas.”
Portanto, é crucial contar com melhores protocolos de registro e controles de qualidade adequados, não apenas para garantir a precisão e integridade dos dados, mas também para promover a colaboração global e a transparência nos ensaios clínicos.
A Organização Mundial da Saúde (OMS) publicou recentemente uma nova diretriz sobre a notificação de resultados em registros de ensaios clínicos [6], que inclui o requisito de que os registros contenham um campo específico para as datas de conclusão dos estudos.
No entanto, ainda não está claro quando os numerosos registros que alimentam a base de dados global da OMS adotarão a nova diretriz.
Referências