Investigaciones
Una vista panorámica de los ensayos clínicos aporta nuevas perspectivas sobre la investigación y el desarrollo de fármacos
(A bird’s-eye view of clinical trials provides new perspectives on drug research and development)
Spencer Phillips Hey
Statnews, 18 de julio de 2019
https://www.statnews.com/2019/07/18/clinical-trials-birds-eye-view-drug-development/
Traducido por Salud y Fármacos
El desperdicio y la ineficiencia en el desarrollo de medicamentos son problemas graves. Pueden ser difíciles de detectar, especialmente cuando se está en medio del proceso. Una nueva forma de visualizar los ensayos clínicos podría ayudar.
Según expertos, se desperdicia hasta el 85% de la investigación biomédica [1] por sesgos en el diseño del estudio, falta de publicación de resultados, duplicación innecesaria o porque responden preguntas de investigación de poca importancia. También se estima que sólo uno (o tal vez dos) de cada 10 medicamentos que son objeto de ensayos clínicos resultan ser efectivos.
Esta imagen bastante deprimente de la productividad en la investigación farmacéutica ha hecho reflexionar a los científicos, especialistas en ética y a los que analizan políticas que están interesados en mejorar la eficiencia de estos procesos. Una vez, la revista médica The Lancet publicó una serie completa de artículos dedicados a discutir cómo se puede reducir el desperdicio y mejorar el valor de la investigación. Esta serie incluyó sugerencias sobre cómo mejorar la priorización [2], el diseño de los estudios [3], la regulación [4], el acceso [5] y la calidad de los informes científicos [6].
Si bien estas estadísticas son esclarecedoras, y las sugerencias para mejorar el sistema son razonables, sólo representan una imagen muy general de cómo funciona el negocio de la investigación y el desarrollo de medicamentos, lo que podría considerarse una vista panorámica a 30,000 pies (9000 metros) de altura. Pero el sistema de investigación podría seguir patrones o tener propiedades importantes que sólo se pueden apreciar desde una distancia más corta.
Presentamos una prueba de concepto para ofrecer una vista panorámica desde una perspectiva más cercana, utilizando los datos de ClinicalTrials.gov y los gráficos AERO para analizar todos los ensayos clínicos registrados por 10 grandes compañías farmacéuticas durante más o menos los últimos 20 años, incluyendo a AbbVie, Bayer, Gilead, GSK, Johnson & Johnson, Merck, Novartis, Pfizer, Roche y Sanofi.
El resultado completo es un gráfico gigante que muestra 13.749 ensayos que incluyeron a más de 6 millones de pacientes. Es tan grande que no cabe adecuadamente en el sitio web de STAT. Pero puede verlo e interactuar con él en su propio sitio web (https://www.aerodatalab.org/birds-eye-view-of-research-landscape), o ver un video (https://www.youtube.com/watch?v=kPuTEIrDudo) de todo el gráfico.
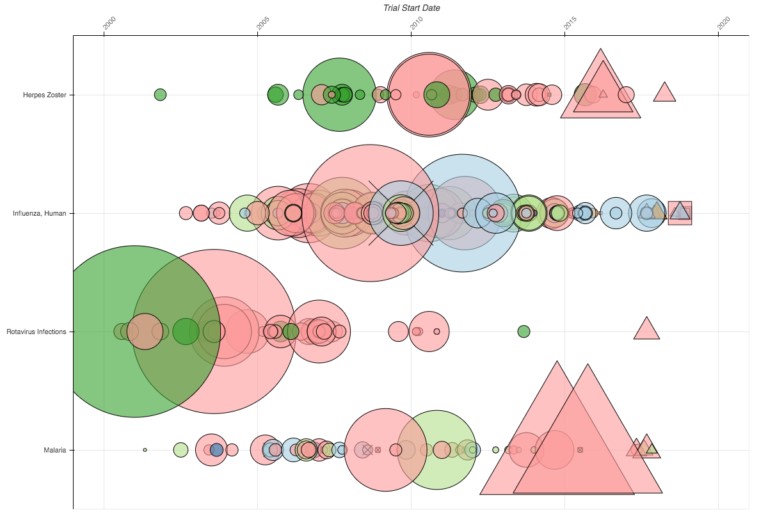
Aquí hay una guía para interpretar el gráfico: cada nodo corresponde a un ensayo registrado de una de las 10 compañías; al hacer clic en cualquier nodo se abre la página de registro del ensayo. Luego, los ensayos se organizan por orden temporal, del más antiguo al más reciente en el eje x, y por población de pacientes o enfermedad estudiada en el eje y. Las áreas de la enfermedad se agrupan según el árbol de títulos de temas médicos (MeSH) de la Biblioteca Nacional de Medicina de EE UU. El color del nodo indica la compañía (Pfizer es azul oscuro, Johnson & Johnson es naranja, Merck es verde oscuro, etc.). La forma indica el estado del ensayo: los estudios que ya se han completado aparecen como círculos, los estudios en fase de reclutamiento son triángulos, los estudios interrumpidos tienen una “x” por encima, y el tamaño representa el número de pacientes inscritos.
¿Qué puede mostrarnos esta perspectiva a vista de pájaro que la vista desde 9000 metros o 30.000 pies no nos permite detectar? A primera vista, revela el increíble volumen de investigación que se ha realizado. Estos ensayos representan una enorme inversión social y científica, que probablemente cuestan varios cientos de miles de millones de dólares, y estas son las actividades de sólo 10 empresas, una pequeña parte de la investigación clínica total.
También cuestiona lo que hemos aprendido y lo que deberíamos probar a continuación, preguntas que incluso a aquellos de nosotros que estudiamos ensayos clínicos y políticas de investigación normalmente no se nos ocurriría hacer.
Por ejemplo, la imagen de arriba muestra solo unas pocas filas del gráfico de las enfermedades virales: herpes zoster, influenza, rotavirus y malaria. Se puede ver inmediatamente cuales son algunos de los ensayos con mayores muestras de todos los estudios. Los dos ensayos de principios de la década de 2000, realizados por Merck en verde y GSK en rosa, inscribieron cada uno a más de 60.000 participantes; y los dos ensayos activos de malaria de GSK han inscrito a más de 50.000 cada uno. También es evidente que la compañía, GSK, es la más activa, y Sanofi en azul claro y Merck en verde son realmente las únicas otras dos compañías que han realizado ensayos comparables. Esto plantea la pregunta: ¿Por qué hay tan pocas empresas en este campo?
Esto contrasta con la figura a continuación, que muestra cuatro filas en el espacio neurológico: Parkinson, Alzheimer, migraña y meningitis. Estos ensayos tienden a ser más pequeños, los más grandes generalmente sólo tienen unos pocos miles de participantes. También participa un mayor número de estas 10 empresas, aunque la meningitis es claramente un área donde hay menos investigación que las otras tres.
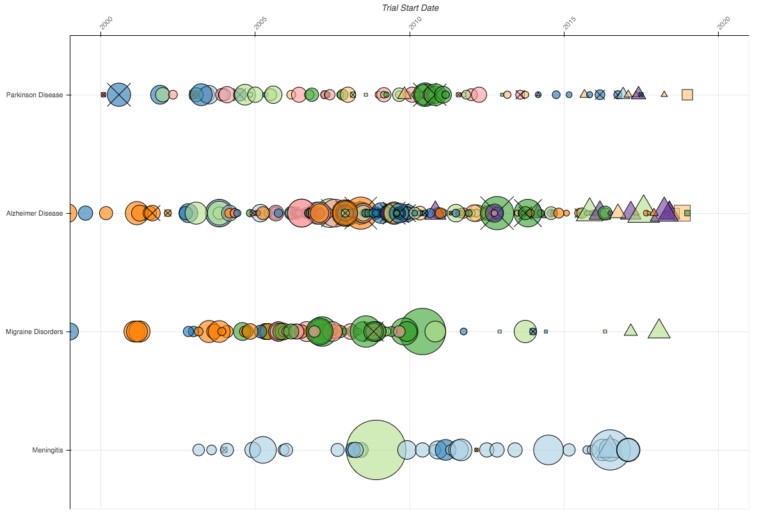
También es interesante observar las brechas en investigación. ¿Qué pasó con los estudios de la migraña después de 2010? ¿Por qué estas 10 compañías han iniciado tan pocos ensayos en migraña desde entonces? Por el contrario, la actividad en la investigación de Alzheimer parece más estable, aunque en esta categoría hay más ensayos que se han interrumpido.
Pero el número de ensayos de Alzheimer que se han interrumpido se ve eclipsado por aquellos en el espacio cardiovascular (ocho de esas filas se muestran a continuación). Es un arco iris de grandes ensayos, y muchos han sido cancelados. A pesar de que la cancelación del ensayo no es necesariamente algo malo (algunos ensayos se terminan antes de tiempo porque se descubre que el fármaco experimental es altamente efectivo), los ensayos no se diseñan con la intención de suspenderlos antes de tiempo. Entonces, un grupo grande de estudios cancelados en un área particular exige una explicación.
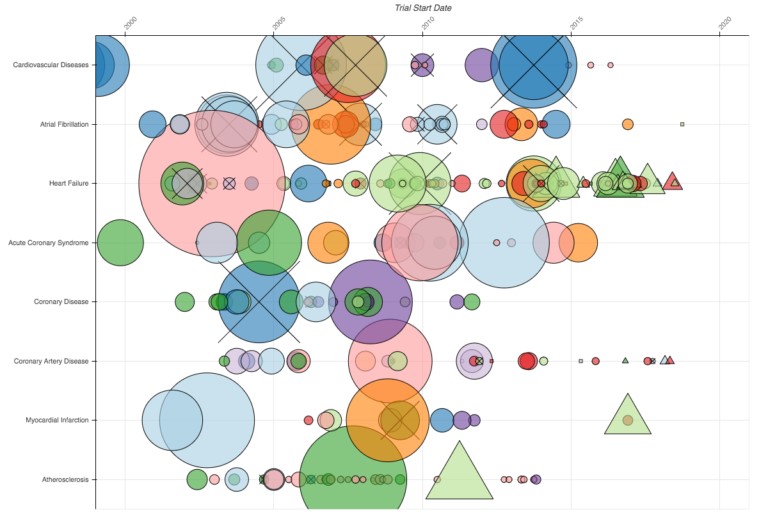
Una de las muchas cosas buenas de ClinicalTrials.gov es que algunos investigadores ya han proporcionado esas explicaciones. En el mapa interactivo, puede hacer clic en el gran ensayo de Pfizer, azul oscuro de 2013, y ver que se canceló porque “el perfil clínico emergente, la evolución del tratamiento y la situación del mercado de los agentes hipolipemiantes” indicaron “que [el fármaco en estudio] no era probable que aportara valor a los pacientes, médicos o accionistas”. El ensayo azul claro de Sanofi en 2006 se canceló “por las exigencias de ciertas autoridades de salud”, mientras que el ensayo verde claro de Novartis de insuficiencia cardíaca en 2006 fue cancelado debido a que surgió una clara señal de que el medicamento era efectivo.
Parte del poder de esta perspectiva a vista de pájaro es que después de ver e interactuar con los datos a esta escala, las preguntas sobre las historias, los patrones y resultados que caracterizan a la investigación en su conjunto se vuelven más concretas y accesibles. Puede ver inmediatamente un patrón de ensayos grandes cancelados en el espacio cardiovascular. Con unos pocos clics del ratón, puede comenzar a comprender el porqué. Esto podría ser muy útil para aquellos que desean mejorar la eficiencia de la investigación, ya que les permite generar ideas sobre lo que sucedió y luego especificar preguntas para hacer más investigación, como “¿Hay oportunidades para repensar cómo planificamos y ejecutamos los ensayos para enfermedades cardiovasculares?”
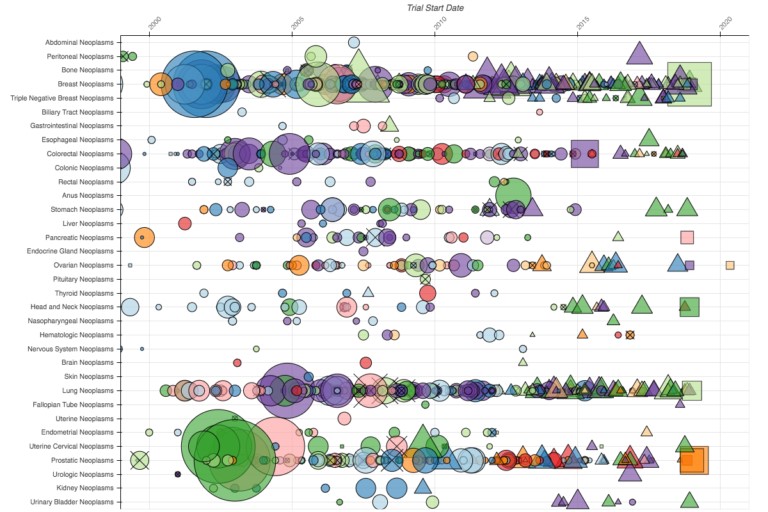
Creo que también es interesante ver cómo el panorama de la investigación del cáncer (arriba) difiere del de otras áreas terapéuticas. El gráfico es un extracto representativo de los ensayos en cáncer: la actividad se extiende a través de muchas filas porque, a diferencia del Alzheimer y el Parkinson, el cáncer no es una enfermedad. El tamaño promedio de los ensayos de en cáncer parece ir disminuyendo con el tiempo, podría explicarse por la transición hacia medicamentos para dianas específicos o de precisión. Y todas las compañías están en algún lugar de este espacio, aunque hay algunos tipos de cáncer en que sólo trabajan una o dos compañías.
Ahora vea el gráfico completo a través de la perspectiva ética. Cada estudio, cada nodo en esta figura, debe estar éticamente justificado, lo que asume que los beneficios que aportarán al conocimiento científico compensarán sus costos sociales y las cargas que imponen a los sujetos de investigación. Eso nos lleva a preguntar: para cada ensayo en este gráfico, ¿por qué tiene (o tenía) sentido dado el panorama de I + D que existía en ese momento? Para los ensayos que están reclutando (los triángulos) ¿está justificada la realización de estos estudios? Si la investigación fuera verdaderamente eficiente y ética, los patrocinadores e investigadores que realizan ensayos siempre deberían tener respuestas convincentes a esas preguntas, y para que las respuestas sean convincentes, deben tener en cuenta el contexto de I + D circundante, un contexto que esta visualización hace más explícita.
La vista panorámica también ayuda a agudizar las preguntas sobre quién tiene el poder y la responsabilidad de intervenir y alterar los patrones en este espacio. En términos generales, los investigadores y los investigadores clínicos, que a menudo son objeto de artículos sobre el desperdicio en la investigación, pueden no tener mucho poder para cambiar significativamente el panorama.
El poder del paciente probablemente es aún más limitado, aunque tanto los pacientes como los investigadores podrían organizarse para abogar por grandes cambios en la política de investigación.
Las pequeñas empresas de biotecnología probablemente tampoco tengan la capacidad de pasar fácilmente de hacer investigación sobre una enfermedad o producto a otro si vieran, por ejemplo, que la actividad en su área de interés se está saturando demasiado.
Pero los reguladores gubernamentales, las grandes compañías farmacéuticas, los inversionistas y las grandes organizaciones que financian investigación tienen cierta capacidad para analizar, intervenir y, por lo tanto, remodelar el panorama de la investigación. Los reguladores, por ejemplo, podrían intervenir para exigir cambios en los diseños de los ensayos si ven que muchos de los que se realizan en un área terapéutica particular se cancelan con frecuencia. La capacidad de identificar patrones y predecir mejor lo que sucederá después (tanto para la propia empresa como para los competidores) debería ser de interés para las grandes compañías farmacéuticas y para los inversionistas. Para las grandes organizaciones que financian investigación, ser capaz de identificar brechas o vacíos en la investigación podría ser una información valiosa para maximizar el impacto de sus inversiones científicas.
Estas observaciones sólo son un acercamiento superficial a lo que pueden revelar nuevas formas de visualizar los ensayos clínicos y las decisiones que se pueden tomar a partir de los conocimientos que ofrecen. Aunque me he centrado en las compañías farmacéuticas, este mismo método podría usarse para comparar y contrastar las carteras de actividades de los grandes financiadores nacionales de investigación o instituciones académicas de investigación. También podría usarse para obtener información sobre la equidad en la investigación de salud, contrastando cómo los tipos de ensayos se relacionan con las cargas de la enfermedad.
Esta prueba de concepto se basa en ClinicalTrials.gov, pero las repeticiones futuras podrían incorporar datos sobre resultados de ensayos, patentes, aprobaciones regulatorias y más, por ejemplo, utilizando la Biblioteca Cochrane o DrugBank.ca. Tal recurso podría ser muy útil para los expertos que realizan revisiones sistemáticas o producen guías basadas en evidencia, ya que les brinda una herramienta rápida e intuitiva para identificar y analizar las poblaciones relevantes de los ensayos.
Una última reflexión: la ciencia y la tecnología que surgió, y está surgiendo, de estos ensayos, nos afecta a todos de alguna manera. Creo que esta perspectiva a vista de pájaro, presentada como una visualización interactiva, puede ayudarnos a comprender mejor los ensayos al revelar el panorama, los bosques y los árboles de los ensayos clínicos, y ayudarnos a comenzar a imaginar nuevas posibilidades de cómo podríamos dar forma al paisaje para responder mejor a todos nuestros intereses.
Referencias