ADVIERTEN
Investigaciones
Uso de benzodiazepinas y riesgo de demencia: estudio prospectivo basado en la población
(Benzodiazepine use and risk of dementia: prospective population based study)
Billioti de Gage S, Bégaud B, Bazin F, Verdoux H, Dartigues JF, Pérès K, Kurth T, Pariente A
http://www.bmj.com/content/345/bmj.e6231
BMJ 2012;345doi: 10.1136/bmj.e6231
Traducido por Emilio Pol Yanguas
Introducción
Las benzodiazepinas están indicadas para el tratamiento a corto plazo de los problemas de ansiedad e insomnio [1] y se prescriben con mucha frecuencia en los países de altos ingresos [2,3]. Los efectos adversos del uso agudo de este grupo de fármacos sobre la capacidad cognitiva son bien conocidos. Una fracción importante de los franceses mayores de 65 años, el 30% [4], utiliza alguno de estos fármacos mientras que en España y Canadá es del 20% y en Australia el 15% de la población en ese grupo de edad las utiliza [5-7]. En EE UU y el Reino Unido también se utilizan pero en menor proporción [8,9]. El consumo de benzodiazepinas se hace frecuentemente de forma crónica [2,10], a pesar que las guías terapéuticas recomiendan utilizarlas por pocas semanas [1, 10-12]. Los efectos cognitivos del empleo de benzodiazepinas a corto plazo están bien descritos [13-16], pero los efectos a largo plazo sobre el efecto de estos medicamentos en la función cognitiva en la población adulta siguen siendo objeto de debate pues los estudios realizados al respecto han mostrado resultados contradictorios [17]. Algunos documentaron un aumento de los casos de demencia y problemas cognitivos entre los consumidores de benzodiazepinas [9, 18-21], mientras otros no pudieron demostrarlo o encontraron que tenían un efecto protector [22-27]. En estudios previos, el momento de la exposición a benzodiazepinas, en relación con el evento de resultado permitió la posibilidad de causalidad inversa. El insomnio, la depresión y la ansiedad (principales indicaciones para la prescripción de benzodiazepinas) pueden ser síntomas de la demencia.
Se espera que en el 2040 haya 81 millones de personas con demencia [29] y que su prevalencia siga aumentando [30], por lo que es importante identificar las causas que contribuyen a su desarrollo. El objetivo de este estudio es establecer de forma prospectiva si hay una relación entre el consumo de benzodiazepinas y el desarrollo de demencia en una cohorte bien definida de población adulta a la que se dio seguimiento durante 20 años.
Métodos
Participantes, diseño y lugar. Para estudiar la asociación entre el inicio de uso de benzodiazepinas y el riesgo subsecuente de desarrollar demencia, se ha realizado un estudio prospectivo en una cohorte bien definida de sujetos mayores con posibilidad de seguimiento de hasta 20 años. La cohorte PAQUID, cuya finalidad es estudiar el proceso de envejecimiento cerebral normal y patológico, está formada por una muestra representativa de 3777 personas de 65 años, o mayores no institucionalizados (es decir que residen en la comunidad), extraída de forma aleatorizada entre 1987 y 1989 en dos regiones de Francia. Los detalles de la muestra se han publicado en otro artículo [31].
Las visitas de seguimiento se realizaron cada 2-3 años, y se dispone de la información de seguimiento durante 20 años. En cada visita, neuropsicólogos entrenados obtuvieron mediante entrevista cara a cara información sobre las características personales y sociodemográficas, hábitos de vida, estado de salud, uso de medicamentos, capacidades funciones, cognición y síntomas depresivos. Los resultados que se incluyen en este artículo corresponden a esta cohorte y a un estudio con un diseño anidado de casos y controles. Los participantes en la cohorte fueron observados durante un periodo de 3 a 5 años antes de iniciar el seguimiento. Los sujetos podía entrar en el estudio si estaban libres de demencia en la vista del 5º año (T5) e informaron sobre la utilización por primera vez (o no uso) de benzodiazepinas en este momento. Por tanto los sujetos elegibles no habían tomado benzodiazepinas al menos hasta la visita de seguimiento al 3º año. Este periodo fue esencial para permitir el ajuste de factores asociados al uso de benzodiazepinas, incluyendo declive cognitivo desde la inclusión en PAQUID (T0) hasta la visita de seguimiento al tercer año (T3), con lo cual se evitaron los factores de confusión asociados con la indicación de medicamento, y la posibilidad de que hubiera una posible relación causal reversa (como habían sugerido algunos estudios previos). En el estudio de casos y controles anidados se incluyó a todos los sujetos elegibles pertenecientes a la cohorte PAQUID (Ver figura 1)
Definición y medida de la exposición. La información sobre el uso de fármacos se obtuvo mediante el empleo de un cuestionario estandarizado, además se interrogó al participante y a su cuidador usual sobre el uso regular de fármacos (de venta libre y de venta con receta) durante las dos semanas previas, esta información fue posteriormente validada por el entrevistador tras inspeccionar los medicamentos del participante. El neuropsicólogo que realizó las entrevistas cara a cara desconocía la hipótesis de este estudio.
Los sujetos fueron clasificados como “expuestos” o “no expuestos” a benzodiazepinas según el resultado de la entrevista a T5 (Ver la Fig. 1). El grupo expuesto estuvo formado por sujetos que declararon que no habían utilizado benzodiazepinas a T0 y T3, pero si a T5, de modo que se hicieron nuevos usuarios entre T3 y T5. En el análisis principal no se consideró el uso posterior de benzodiazepinas al estimar la asociación entre el uso de benzodiazepinas y aparición de demencia. Los sujetos que negaron el uso de benzodiazepinas a T0, T3 y T5 constituyen el grupo control.
Se han tenido en consideración las benzodiazepinas y fármacos similares disponibles en Francia entre 1988 y 2006 (alprazolam, bromazepam, clordiazepoxido, clobazam, clonazepam, clorazepato, clotiazepam, diazepam, estazolam, flunitrazepam, loflazepato, loprazolam, lormetazepam, nitrazepam, nordazepam, prazepam, oxazepam, temazepam, tetrazepam, tofizopam, triazolam, zolpidem, y zopiclona).
Definición y medición de resultados. En cada visita de seguimiento, un neuropsicólogo evaluó sistemáticamente la presencia de demencia según es definida en el DSM-III-R; los casos sospechosos se examinaron posteriormente por un neurólogo para confirmar el diagnóstico. Nuestra variable de resultado fue “demencia confirmada por un neurólogo”. Como las visitas de seguimiento se efectuaron a intervalos de 2 a 3 años, se asignó el punto medio del intervalo entre dos visitas como la fecha índice para la demencia. Se determinaron los casos incidentes de demencia utilizando información de la visita correspondiente al 8º año de seguimiento (T8), indicando cualquier nueva ocurrencia de demencia después de la línea base (T5).
Covariantes: Además de la edad y el sexo, que son factores de riesgo tanto para el uso de benzodiazepinas como para demencia, las covariantes utilizadas para el ajuste basal (T5) incluyeron factores considerados asociados tanto con el uso de benzodiazepinas como con el riesgo de demencia [32, 33]: nivel educativo (duración de la escolarización ≥7 años, vs <7 años), estado marital (soltero o no), consumo de vino (consumo regular vs. abstemio), existencia de diabetes mellitus o presión arterial elevada (definidos según el paciente consuma medicamentos antidiabéticos o antihipertensivos) en la línea basal del estudio (T5), uso de estatinas, de inhibidores de la agregación plaquetaria o anticoagulantes orales y declive cognitivo.
Se utilizaron tres pruebas diferentes para el deterioro cognitivo, el examen mini-mental [34], la prueba de retención visual de Benton [35] y el conjunto de pruebas de Isaac [36]. Para los tres, se consideró la diferencia entre la puntuación obtenida a T3 y a T0 (inclusión en el estudio PAQUID) como variable cuantitativa. Los síntomas depresivos se evaluaron utilizando la escala de depresión del Centro para Estudios Epidemiológicos [37], categorizada conforme a los umbrales validados para la población francesa, con un punto de corte de ≥17 para hombres y ≥23 para mujeres [38], para definir la presencia de síntomas depresivos significativos.
Análisis estadístico
Cohorte, análisis principal: Se compararon las características de los nuevos usuarios de benzodiazepinas con las de los que no las usaron, empleando la frecuencia absoluta y porcentaje para las variables cualitativas, y la mediana y el rango intercuartílico para las variables cuantitativas.
Se utilizaron las curvas de Kaplan-Meier y las pruebas log-rank para los análisis univariados de supervivencia libre de demencia en los grupos expuestos y no-expuestos. Se utilizó el modelo multivariado de riesgo proporcional de Cox ajustado para evaluar la asociación entre el nuevo uso (inicio entre T3 y T5) de benzodiazepinas y riesgo de demencia incidente, ajustado por potenciales factores de confusión.
La variable dependiente fue la ocurrencia de demencia incidente (nuevos casos de demencia).
El modelo se ajustó por los siguientes potenciales factores de confusión (covariables): edad, sexo, nivel educativo, estado marital, consumo regular de vino, cambio en el examen minimental entre T0 y T3, y uso de agentes antidiabéticos, antihipertensivos, estatinas y antiagregantes plaquetarios o anticoagulantes orales.
Como se piensa que los síntomas depresivos pueden potencialmente ser síntomas prodrómicos de demencia [39,40], no se consideraron los síntomas depresivos como un potencial factor de confusión en el estudio. Sin embargo, se incluyó información sobre la presencia de síntomas depresivos en un análisis de sensibilidad debido a que la depresión también se ha descrito como un factor de riesgo de demencia [41]. Se calculó el valor persona-tiempo entre la fecha de la visita de seguimiento al 5º año en PAQUID (momento basal en el estudio que nos ocupa) y la fecha estimada de demencia, muerte, o pérdida de seguimiento o hasta la fecha en que se cumpliera la visita de los 20 años de seguimiento, la que aconteciera antes. Verificamos la suposición de proporcionalidad en el modelo Cox evaluando los residuos Cox-Snell y no se encontró violación de esta suposición.
Se evaluó si la asociación entre uso de benzodiazepinas y demencia se modificaba por la edad (80-84 o ≥85 v 79 70-años), sexo, duración de la escolarización (≥7 v <7 años). Para examinar la significación estadística de la modificación del efecto, se utilizó la prueba de cociente de probabilidades que contrastan el modelo principal con un modelo que incluye términos de interacción apropiados.
Cohorte, análisis secundario. Para tener en consideración la potencial variabilidad temporal en la asociación entre uso de benzodiazepinas y riesgo de demencia, en un segundo análisis, se consideraron nuevas cohortes de usuarios de benzodiazepinas entre la línea basal de este estudio (T5) y los siguientes 15 años los de seguimiento (PAQUID T8 a T20). Se eligió esta aproximación al considerar que el modelo de Cox con información actualizada sobre la exposición podría no permitir una estructura correcta para la inferencia causal [42]. En el momento basal y a cada uno de los cuatro momentos de seguimiento (T8, T10, T13; T15) se crearon cohortes de nuevos usuarios (participantes que informaron uso de benzodiazepinas por primera vez en estas específicas visitas de seguimiento) y se siguió a cada cohorte hasta que sucedía un evento censurador o hasta el final del estudio, según lo que ocurriera antes. Entonces se evaluó la asociación de cada una de estas cohortes con el riesgo de demencia subsecuente comparada con los participantes que no comenzaron a usar benzodiazepinas en un punto del tiempo dado, ajustando por los factores de confusión mencionados anteriormente, incluyendo información sobre síntomas depresivos. La información sobre los factores de confusión fue actualizada en los respectivos momentos de seguimiento. Finalmente, se agruparon las cinco cohortes utilizando un modelo de efecto fijo.
Análisis de casos y controles anidados. Los participantes que continuaban en seguimiento a T8, sin demencia antes de esta fecha y con una fecha exacta de diagnóstico de demencia, fueron elegibles para el análisis de casos y controles anidados en la cohorte PAQUID. Se definieron los casos como los participantes con un diagnóstico incidente de demencia de T8 en adelante, como en el estudio de cohortes. Se consideraron todos los participantes sin un diagnóstico de demencia en el momento en que un caso era diagnosticado (fecha índice) como controles. Entre estos, se seleccionaron de forma aleatorizada hasta cuatro controles y se emparejaron con cada caso por edad (±2 años) y sexo. Los participantes podrían ser utilizados como controles para casos y posteriormente como casos si presentaran un diagnóstico incidente de demencia (muestreo de densidad de incidencia).
Para el estudio de casos y controles anidado, no se excluyó ningún caso prevalente de exposición a las benzodiazepinas. Primero se clasificaron a los participantes como usuarios (si declararon al menos un uso de benzodiazepinas antes de la fecha índice) y no usuarios (declararon no haber utilizado benzodiazepinas antes de la fecha índice). Entre los usuarios, se identificaron los usuarios recientes (informaron sobre su uso en la visita de seguimiento precedente a la fecha índice, pero nunca antes) y usuarios anteriores (informaron del uso al menos tres visitas previas a la fecha índice o anteriormente).
Se utilizó la regresión logística condicional para evaluar la asociación entre uso de benzodiazepinas y riesgo de demencia. Se construyeron dos series de modelos, cada uno considerando una de las definiciones de exposición a benzodiazepinas. Los análisis se ajustaron de forma similar a como se había hecho para el análisis de la cohorte principal, incluyendo síntomas depresivos, Los modelos que no incluían información sobre síntomas depresivos mostraron asociaciones similares. Las potenciales variables de confusión se midieron en tres puntos de seguimiento (siete u ocho años) antes de la fecha índice.
Para todos los análisis se utilizó el paquete estadístico SAS (SAS 9.3 para Windows). Todos los valores de P indicados son a dos colas, y se consideraron estadísticamente significativos cuando p<0,05.
Resultados
Análisis de cohortes. Descripción de la población. De los 3777 participantes en el estudio PAQUID, 2084 continuaban en seguimiento activo en la visita a los 5 años (T5, línea base para el estudio que nos ocupa). Se excluyeron 154 participantes con demencia prevalente en la vista de seguimiento al 5º año, 735 participantes con una historia de uso de benzodiazepinas o uso prevalente, y 132 con información incompleta o cuestionable sobre la historia de uso de benzodiazepinas. La muestra por tanto incluyo 1063 participantes libres de demencia en el momento T5 y sin uso prevalente de benzodiazepinas hasta T3 (ver figura 2).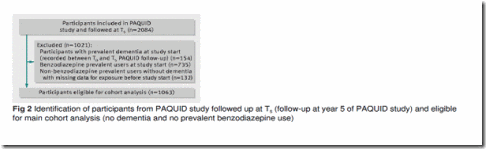
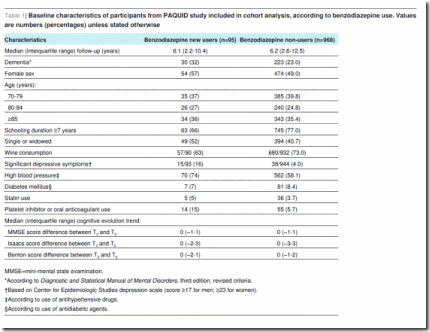
Entre los 1063 participantes elegibles, (8,9%) informaron sobre consumo de benzodiazepinas en la línea basal (T5), indicando que habían empezado a utilizar benzodiazepinas entre T3 y T5. La tabla 1 indica las características de los sujetos participantes en el análisis según el consumo de benzodiazepinas. Comparando los nuevos usuarios (n=95) con los no usuarios (n=968), se observa menor tiempo de escolarización para los primeros (66% vs. 77%, escolarización ≥7 años), ser solteros o viudos (52% vs. 41%), tener más síntomas depresivos significativos (16% vs. 4%), utilizar antihipertensivos (74% vs. 58%), utilizar antiagregantes plaquetarios o anticoagulantes orales (15% vs. 6%) y consumir vino regularmente (63% vs. 73%). No se observaron diferencias entre los nuevos usuarios de benzodiazepinas y los no usuarios en términos de edad, sexo, diabetes mellitus, uso de estatinas y evolución de la función cognitiva entre la inclusión en el estudio PAQUID (T0) y la visita de seguimiento al tercer año (T3).
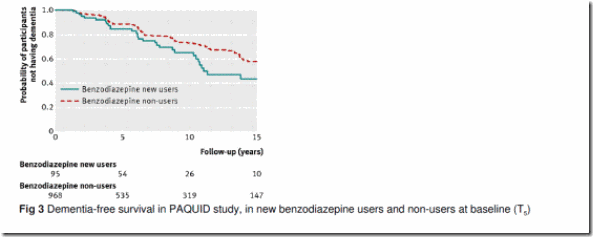
Análisis principal: Durante los 15 años de seguimiento (mediana 6,2; rango intercuartílico 2,6-12,3 años), se confirmaron 253 (23,8%) casos de demencia – 30 (32%) en los usuarios de benzodiazepinas y 223 (23,0%) en no usuarios. Comparados con no usuarios, los nuevos usuarios de benzodiazepinas entre T3 y T5 se asociaron con menor supervivencia libre de demencia en la población estudiada (análisis crudo de supervivencia, log-rank test p=0,03) (ver figura 3). La tasa de incidencia de demencia durante los 15 años de seguimiento fue 4,8 por 100 personas–año en el grupo expuesto comparada con 3,2 por 100 personas-año en el grupo no expuesto. En comparación con los participantes que en la línea base informaron que no utilizaban benzodiazepinas (n=968), los que comenzaron a utilizar benzodiazepinas entre T3 y T5 (n=95) se asociaron con un mayor riesgo de demencia (hazard ratio o cociente de riesgo 1,60; CI95%: 1,08-2,38), después de ajustar por potenciales factores de confusión.
Cuando posteriormente se realizó el ajuste por síntomas depresivos, el resultado no cambió (cociente de riesgo 1,62; IC95% 1,08-2,43) (ver tabla 2). El uso de las pruebas de Isaac o de Benton en lugar del examen-minimental condujo a resultados similares (cociente de riesgo 1.67 y 1.68). De los 1063 participantes incluidos, 57 (5%) tenían valores perdidos para al menos una de las 10 variables utilizadas para el ajuste en el análisis principal–8 (8%) en el grupo expuesto y 49 (5%) en el grupo no expuesto (p=0,17). No se encontró ningún efecto de modificación significativa de la asociación entre iniciar tratamiento con benzodiazepinas y la incidencia de demencia según edad (para la interacción =0,10), sexo (para la interacción = 0,23), o duración de la escolarización (para interacción =0,43).
Análisis secundario. En el análisis secundario, se crearon las cohortes de nuevos usuarios y no usuario basales (T5) y los puntos temporales de seguimiento T8, T10, T13 y T15. Esto añadió un total de 116 nuevos usuarios durante el seguimiento a los 95 nuevos usuarios basales. Se estimó la asociación agregada entre nuevos usuarios de benzodiazepinas y riesgo de demencia incidente a través de las cinco cohortes (basal y 4 cohortes de seguimiento) utilizando un modelo de efecto fijo. El cociente de riesgo agregado multivariable ajustado de demencia fue 1,40 (1,06-1,85). El control adicional de los síntomas de depresión no alteró los resultados (cociente de riesgo 1,46; 1,10 a 1,94) (figura 4).
Análisis de estudio anidado de casos y controles.
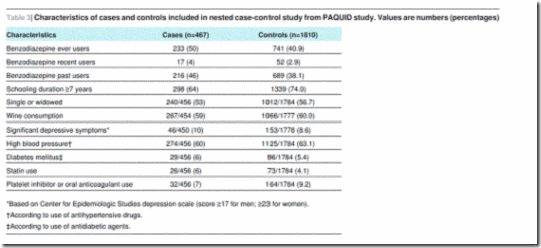
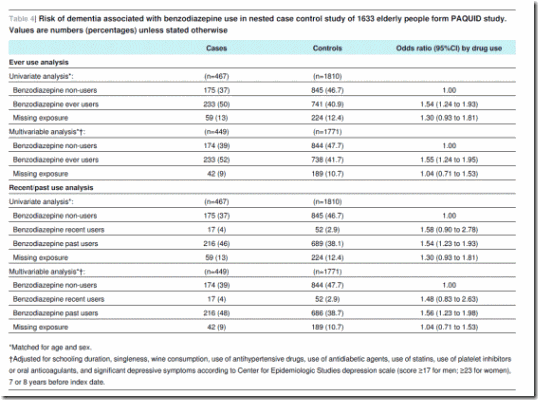
Para el análisis de caso-control anidado, fueron elegibles 1633 pacientes que continuaban en seguimiento a T8 (figura 5). Se identificaron 467 casos de demencia y 1810 controles para el análisis de casos y controles anidados (que no excluye los usuarios prevalentes a T0 o T3, a diferencia del análisis de cohortes). La tabla 3 muestra las características de los casos y de los controles. Los que utilizaron alguna vez benzodiazepinas tuvieron mayor riesgo de demencia (cociente de apuestas ajustado 1,55–1,24 a 1,95). Se encontró una asociación similar en los usuarios anteriores (cociente de apuestas ajustado 1,56–1,23 a 1,98) y usuarios recientes (cociente de apuestas ajustado 1,48–0,83-2,63), pero el resultado fue solo significativo para usuarios anteriores (tabla 4).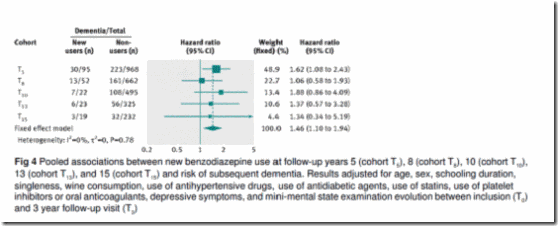

Discusión
En este estudio prospectivo, con una muestra relativamente grande, y basado en la población anciana que estaba libre de demencia y no utilizaban benzodiazepinas durante al menos tres años, el inicio de consumo de benzodiazepinas se asoció con un incremento significativo de aproximadamente el 50% de incremento de riesgo de demencia. Este resultado se ha mantenido estable después de ajustar para potenciales factores de confusión, incluyendo declive cognitivo anterior al inicio del uso de benzodiazepinas y presencia de síntomas de depresión clínicamente significativos. También se mantiene robusto cuando mezclamos cinco cohortes de nuevos usuarios de benzodiazepinas a lo largo de los 15 años del periodo de seguimiento y en un estudio de casos y controles anidado complementario.
Comparación con otros estudios
Los hallazgos de este estudio son consistentes con tres estudios previos de casos y controles, que también mostraron un riesgo aumentado de demencia entre usuarios de benzodiazepinas. Dos de ellos se realizaron en Taiwan usando datos de las compañías de seguros de salud que incluían pacientes de 45 años o más, y encontraron un aumento del riesgo de demencia en usuarios crónicos (>6 meses) (odds ratio o razón de ventaja de ajustada 1,24; 1,01 a 1,53) [18] y usuarios actuales (razón de ventaja ajustada 2,71, 2,46-2,99) [19]. Un estudio de casos y controles anidados, entre franceses de 65 años de edad o más, mostró un aumento del riesgo de demencia entre los que habían sido usuarios (razón de ventaja ajustada 2,3; 1,2-4,5) [21]. Sin embargo, la duración máxima de seguimiento en estos estudios fue de 8 años [18, 19, 21], surgiendo la preocupación de que síntomas de demencia podrían haber influido en el uso de benzodiazepinas [28]. Los resultados del estudio prospectivos de la cohorte Caerphillly, de hasta 22 años de seguimiento, mostró un incremento del riesgo de demencia en gente que alguna vez habían utilizado benzodiazepinas (razón de ventaja ajustada: 2,94; 1,16-7,46). El resultado de este estudio también sugiere que el potencial exceso de riesgo de demencia asociado con benzodiazepinas puede aplicarse a la población con bajo consumo de benzodiazepinas. Sin embargo, los usuarios de benzodiazepinas no pudieron clasificarse como nuevos, o anteriores, y el tamaño de la muestra fue demasiado pequeño como para permitir análisis de subgrupos significativos (por ejemplo, entre los 93 con demencia, 12 participantes habían sido expuestos durante al menos cuatro años) [9].
En contraste con estos resultados, dos estudios no encontraron incremento del riesgo de demencia entre personas ancianas que utilizaban benzodiazepinas. El resultado de un estudio (casos y controles), sin embargo, mostró una estimación del efecto similar al presente estudio, pero sin alcanzar significación estadística (razón de ventaja ajustada 1,5; 0,6 a 3,4), probablemente debido al pequeño tamaño muestral [22]. El otro estudio de cohorte, sugirió un efecto benéfico del uso de benzodiazepinas sobre la demencia (razon de ventaja no ajustada 0,34), pero consideró a los usuarios anteriores como miembros del grupo de referencia, lo que podría haber sesgado el resultado [27]. Una comparación más detallada de los estudios que han explorado la potencial asociación entre uso de benzodiazepinas y riesgo de demencia ser resumen el la tabla suplementaria (web-extra).
El presente estudio incluyó una muestra bastante más grande que los estudios previos a largo plazo sobre el problema [9], y al incorporar periodo de observación de al menos tres años ha permitido hacer el ajuste por factores asociados con el inicio de uso de benzodiazepinas reduciendo así la posibilidad de detectar una causalidad reversa, en este sentido, un exceso de riesgo observado durante la fase temprana de la exposición seria congruente con un sesgo de causalidad reversa, lo que no seria el caso si el riesgo apareciera mucho después del inicio de la exposición.
Las benzodiazepinas también podrían ser vistas como un marcador temprano del riesgo de demencia que podría indicar que hay ese grupo de pacientes tiene un riesgo especial, pero sin jugar ningún papel etiológico en la ocurrencia de la enfermedad. Por ejemplo, la ansiedad persistente durante la mediana edad ha mostrado estar asociada con mayor riesgo de demencia en gente mayor [43]. Por tanto, el uso de benzodiazepinas puede ser un marcador de este escenario y podría ayudar a identificar gente con un riesgo aumentado de demencia, y no de la vía causal que conduce a la demencia. No obstante, en este estudio, dos observaciones argumentan contra esta hipótesis: la fuerza de la asociación no aumenta a través de las cinco cohortes de nuevos usuarios (como podría esperarse en caso de una causalidad reversa, en tanto que el tiempo desde el uso de benzodiazepinas hasta el desarrollo de demencia es corto), y la asociación entre nuevo usuario de benzodiazepinas y demencia incrementa después de aproximadamente siete años de seguimiento (figura 3). No obstante, la causalidad reversa no puede descartarse completamente como una explicación alternativa a los hallazgos de este estudio.
Fortalezas y limitaciones
Este estudio tiene varias fortalezas. Primero, se basa en un largo periodo de seguimiento que permite evaluar efectos demorados de la exposición a benzodiazepinas, lo que no fue posible en estudios previos (excepto uno [9]). En segundo lugar, se define la demencia incidente aplicado criterios validados (DSM-III-R) confirmados por un neurólogo experimentado que fue ciego a la hipótesis del estudio. Tercero, entrevistadores entrenados recogieron y validaron los datos sobre exposición a medicamentos mediante la inspección visual de los medicamentos de los pacientes. Cuarto, la restricción del análisis a nuevos usuarios de benzodiazepinas después de al menos tres años permitió el ajuste a factores fuertemente asociados al inicio del uso de benzodiazepinas- Finalmente el estudio de cohorte tiene una muestra relativamente grande, representativa de ancianos participantes, que permitió hacer ajustes sobre un amplio número de factores de confusión de la asociación uso de benzodiazepinas-demencia
Este estudio también tiene limitaciones. Primera, hay un número limitado de nuevos usuarios en la línea basal (n=95), lo que limita el poder para el análisis de subgrupos e impide la posibilidad de evaluar benzodiazepinas específicas. Sin embargo, la literatura disponible no sugiere que benzodiazepinas específicas tengan un efecto diferencial sobre la cognición o demencia [23]. Segundo, no se pudo realizar un ajuste por separado por ansiedad y problemas de sueño, ambos considerados como pródromos de demencia, consecuencia de la falta de medidas específicas de estos síntomas en el programa PAQUID. Sin embargo, la escala de depresión del Centro de Estudios Epidemiológicos incluye estos ítems en la computación de su puntación global, pero si hubiéramos introducido tres puntuaciones separadas en el modelo nos hubiéramos tenido que preocupar por la colinearidad, ya que los síntomas depresivos están frecuentemente asociados con problemas de sueño y ansiedad, especialmente en ancianos.
Finalmente, las personas para las que no teníamos información sobre el uso de benzodiazepinas durante el periodo de rodaje entre el tercer y quinto año de este estudio, no fueron incluidas, ya que no se podía determinar el estado de la exposición. En la medida que esta falta de datos pudiera estar relacionada con seguimiento deficiente, lo que se ha relacionado con un mayor riesgo subsecuente de demencia [44], se podría haber cometido un potencial riesgo de selección. Sin embargo, estos participantes inelegibles tenían menor nivel de escolarización y era más probable que vivieran solos, dos factores que se sabe que están asociados con mayor riesgo tanto de uso de benzodiazepinas como de incidencia de demencia. Por tanto un potencial sesgo de selección por la exclusión de las personas para las que no teníamos información sobre la exposición antes de la fecha índice debería tender a decrecer la fuerza de la asociación. La disparidad en la incidencia de demencia a lo largo de ventanas de tiempo comparables fue similar a la observada entre los participantes incluidos.
Implicaciones para la práctica clínica y la salud pública
Las benzodiazepinas siguen siendo útiles para el tratamiento de la ansiedad aguda y del insomnio transitorio [45,46]. Sin embargo, una evidencia creciente muestra que su uso puede inducir resultados adversos, principalmente en personas ancianas, tales como caídas graves y fracturas relacionadas con caídas [47, 48]. Los datos de este estudio se añaden a la evidencia acumulada de que el uso de benzodiazepinas se asocia con un incremento del riesgo de demencia, el cual, dado el elevado y frecuentemente crónico consumo de estos fármacos en muchos países [10, 49, 50], podría constituir una preocupación importante de salud pública. Por tanto, los médicos deberían evaluar cuidadosamente los beneficios esperados del uso de benzodiazepinas a la luz de estos efectos adversos y, siempre que sea posible limitar la prescripción a unas pocas semanas como se recomienda en las guías de buena práctica clínica. En particular el uso crónico incontrolado de benzodiazepinas en ancianos debe ser desaconsejado y combatido.
Preguntas pendientes y futuras investigaciones
Futuras investigaciones deberían explorar si el uso de benzodiazepinas a largo plazo en gente menor de 65 años se asocia también con un riesgo aumentado de demencia, y deben estudiarse las posibles correlaciones entre dosis o dosis acumulada a lo largo de la exposición y demencia.
Conclusión
Los hallazgos de este amplio estudio prospectivo muestran que el inicio del uso de benzodiazepinas se asocia con un incremento de aproximadamente el 50% en el riesgo de demencia. Los resultados permanecen robustos después de controlar por potenciales factores de confusión, en el análisis combinado a través del tiempo de seguimiento y en el estudio de casos y controles anidados. Considerando la frecuencia con que las benzodiazepinas se prescriben en la actualidad, los médicos y las agencias reguladores deberían tener en cuenta la creciente evidencia sobre los posibles efectos adversos de esta clase de fármacos en la población general.
Referencias