Investigaciones
Vacunas contra el virus del papiloma humano, síndrome de dolor regional complejo, síndrome de taquicardia ortostática postural y disfunción autonómica – una revisión de la evidencia de la Agencia Europea de Medicamentos
Tom Jefferson, Lars Jørgensen
Indian Journal of Medical Ethics 2017; 2(1):30-37
http://ijme.in/wp-content/uploads/2016/11/251com30_human_papillomavirus_vaccines.pdf
Traducido y resumido por Salud y Fármacos
Resumen
La reciente preocupación por una posible asociación entre la exposición de mujeres jóvenes a las vacunas contra el virus del papiloma humano (VPH) y dos “síndromes disautonómicos” (una serie de signos y síntomas que se piensa que forman parte de una reacción autoinmune) – síndrome de dolor regional complejo (CRPS) y taquicardia postural ortostática (POTS) – llevó a la Agencia Europea de Medicamentos (EMA) a revisar las pruebas existentes. La EMA anunció la revisión el 13 de julio de 2015 y se completó el 4 de noviembre de 2015.
El Comité de Evaluación del Riesgo en Farmacovigilancia de la EMA (PRAC) llevó a cabo la revisión. El proceso de revisión del PRAC fue confidencial. Se llegó a la conclusión de que no había pruebas de que las vacunas contra el VPH se asociaran a el CRPS o al POTS, a pesar de la existencia de grupos de informes independientes o “señales”.
Teniendo en cuenta la importancia de las vacunas contra el VPH para la salud pública y el secreto que rodeó al proceso de revisión de la EMA, este artículo reúne documentos que no se han conocido hasta ahora y documentos de revisión de procedimiento que no han sido censurado de las empresas farmacéuticas y de la EMA para evaluar el proceso de la revisión de EMA y diseminar la información poniendo los documentos a disposición del público.
La revisión del PRAC se llevó a cabo en estrecha colaboración con tres fabricantes de vacunas contra el VPH: GlaxoSmithKline Biologicals, Merck Sharp & Dohme Limited y Sanofi Pasteur MSD. La documentación reunida plantea varias preguntas sobre la calidad de la revisión de la EMA.
Introducción
En 2006 se autorizó la comercialización de la vacuna bivalente bHPV (Cervarix ™) y las cuadrivalentes qHPV (Gardasil ™ y Silgard ™) para la prevención del cáncer cervical y otras enfermedades causadas por el VPH, como las verrugas genitales y el cáncer anal. Se estima que para el 30 de junio de 2015, se habían vendido 57 millones y 190 millones de dosis de bHPV y qHPV, respectivamente (Cuadro 1: C, p 106; E, p 17) (En el Cuadro 1 aparecen las documentos donde se pueden obtener más detalles sobre la información regulatoria). La EMA aprobó las vacunas para su uso en la Unión Europea. Según la legislación europea, los fabricantes son legalmente responsables de la calidad, seguridad y eficacia de sus vacunas contra el VPH. La EMA, a su vez, es responsable de proteger la salud pública y animal a través de la evaluación científica y la supervisión de los medicamentos que aprueba. La cultura de secretismo que impera en la EMA ha sido motivo de preocupación [1] y el Defensor del Pueblo Europeo ha hecho observaciones similares sobre los reglamentos de la EMA [2]. Esto ha hecho que, a partir de 2010, la EMA mejorará la transparencia, principalmente en lo relacionado con la publicación de documentos sobre la implementación de sus regulaciones [3].
El 26 de mayo de 2016, se presentó una queja formal a la EMA (el primer autor de este documento estaba entre los firmantes) respecto a su conclusión de noviembre de 2015 de que no pudo encontrar evidencia de asociación entre las vacunas contra el VPH y dos “síndromes disautonómicos”, colecciones de signos y síntomas que se cree son resultado de una reacción autoinmune y que se desencadenan por estímulos externos como la vacunación [4]. Los dos síndromes disautonómicos mencionados fueron el síndrome de dolor regional complejo (CRPS) y síndrome de taquicardia ortostática postural (POTS) (Nota del Editor: La nota 2 del documento original explica los síntomas y signos que deben estar presentes para establecer el diagnóstico). La denuncia enumeraba una serie de críticas al procedimiento utilizado por la EMA durante la revisión de las vacunas contra el VPH [5].
Este artículo es una síntesis de la evidencia presentada al Comité de Evaluación de Riesgo de Farmacovigilancia (PRAC) de la EMA por los tres fabricantes o titulares de las autorizaciones de comercialización de las vacunas contra el VPH: GlaxoSmithKline Biologicals, Merck Sharp & Dohme Ltd y Sanofi Pasteur MSD. El PRAC, que comenzó a trabajar en julio de 2015, utilizó estas pruebas para concluir que no había asociación entre las vacunas contra el VPH y el CRPS o el POTS.
En este comentario, reunimos documentos relevantes que hasta ahora no se habían hecho públicos y que no estaban censurados ni por parte de los fabricantes ni por la EMA. Algunos documentos se obtuvieron a través de una solicitud amparada en la Ley de Libertad de Información. Se nos entregaron dos documentos. Analizamos estos documentos para evaluar el proceso de revisión de la EMA. Nuestra evaluación plantea cuestiones sobre la transparencia y la confiabilidad de la revisión del PRAC.
Ningún documento puede resumir en pocos miles de palabras la gran cantidad de documentos normativos europeos que se han generado en respuesta al tema de las vacunas contra el VPH y la disfunción autonómica. Por esta razón, hemos puesto los documentos a disposición de los lectores, y en el texto hacemos referencias cruzadas a cada uno de los documentos. El lector puede ir a los documentos originales y obtener más información sobre cualquier aspecto que no hayamos incluido en nuestra revisión.
Miembros de la Unión Europea designados por la Comisión Europea y el Parlamento conforman el PRAC. Generalmente, los miembros sirven por periodos de tres años. Los miembros del comité están obligados a guardar secreto. En las primeras páginas de la guía operacional del Comité se recuerda esta obligación. (Tabla 1: G, p 2) (el énfasis ha sido añadido):

Las posibles “señales”
La práctica de monitorear los efectos de las vacunas o de los fármacos tras su comercialización (concesión de licencias) se llama farmacovigilancia. La farmacovigilancia se basa en “señales”, o informes sobre una posible relación causal entre un evento adverso y una vacuna / fármaco (cuando la relación era previamente desconocida o no estaba completamente documentada).
A partir de 2013, se reportaron tres grupos de señales sobre un posible vínculo entre las vacunas contra el VPH y CRPS y POTS.
En 2013, Kinoshita et al. de Japón informaron sobre 40 mujeres jóvenes (entre 11 y 17 años) que habían desarrollado síntomas disautonómicos después de recibir la vacuna del VPH. Dieciocho fueron diagnosticados con CRPS y cuatro con POTS. Los autores observaron que la vacuna contra el VPH posiblemente había estado implicada en la génesis de CRPS y POTS, ya que el tiempo medio de inicio fue de 5,47 meses ± 5 meses después de la vacunación (Cuadro 1: A, p.23) [6].
En 2015, Brinth et al. de Dinamarca informaron sobre 53 mujeres jóvenes (entre 12 y 39 años) que desarrollaron síntomas disautonómicos durante dos meses posteriores a la vacunación contra el VPH [7]. La mayoría de las mujeres (> 50%) cumplieron con los criterios de diagnóstico POTS. Sin embargo, los autores señalaron: “POTS probablemente debería considerarse como un síntoma secundario a otro problema aún no identificado, y no como una entidad de enfermedad en sí misma” (Cuadro 1: A, p. 23). La nota de los autores se debe probablemente a la gran heterogeneidad en la sintomatología reportada por las mujeres- cefalea (100%), intolerancia ortostática (96%), fatiga (96%), náuseas (91%) y dolor (70%). También se informó en EE UU.se informó sobre una serie similar más pequeña de casos de seis mujeres, (Cuadro 1: D, p 3).
En 2015, el Centro de Monitoreo de la OMS en Uppsala reportó una señal que constaba de 21 mujeres jóvenes (de 11 a 26 años) con sintomatología solapada de CRPS y POTS. Su hipótesis fue que subyacía una etiología autoinmune frecuente. Para 18 de los 21 casos, el tiempo de inicio osciló entre un día y dos años después de la vacunación, con una mediana de 8-13 días. Esto llevó al Centro de Monitoreo de la OMS en Uppsala a recomendar una investigación más profunda, declarando que “… la posibilidad de una patología común [sic]… merece atención” (Cuadro 1: A, pp. 20-2).
El 3 de agosto de 2015, la base de datos del Centro de Monitoreo de la OMS en Uppsala contenía un total de 94 informes de CRPS relacionados con la vacuna contra el VPH, de los cuales 65 fueron descritos como “graves”, y 174 de POTS, de los cuales 117 fueron descritos como “graves” [8] (Cuadro 1: D, pp. 1 – 2).
El procedimiento de referencia de seguridad de la EMA
El 13 de julio de 2015, la EMA anunció que se llevaría a cabo un procedimiento de referencia de seguridad (un proceso utilizado para resolver preocupaciones sobre la seguridad de vacunas o medicamentos) para las vacunas contra el VPH y que sería supervisado por su PRAC (Cuadro 1: B, p 1-2). El PRAC escogió entre sus miembros a los “relatores” y “co-relatores” “que son los que toman la iniciativa en la evaluación científica y tienen la tarea de evaluar a fondo los datos y redactar las recomendaciones que luego se comparten con todos los miembros del PRAC”. Cuadro 1: I, p 4).
Poco después, el PRAC hizo cinco preguntas para que respondieran los fabricantes (Cuadro 1: C, p 4). A las respuestas de los fabricantes se añadieron a la revisión de la evidencia que el PRAC hizo los documentos públicos que se le entregaron y de las bases de datos de farmacovigilancia (como EudraVigilance).
A continuación se presenta una evaluación de las cinco preguntas formuladas por el PRAC (y las respuestas de los fabricantes).
Pregunta 1: Los titulares de los permisos de comercialización deben proporcionar una revisión acumulativa de los datos procedentes de los ensayos clínicos, de la vigilancia post-comercialización y de la literatura para evaluar los casos de CRPS y POTS asociados a su producto. Se deben describir claramente los métodos utilizados para la revisión y la detección de casos, y la evaluación debe discutir si los casos notificados cumplen los criterios de diagnóstico publicados o reconocidos.
Pregunta 2: Proporcione una revisión, a profundidad, de los casos de CRPS y POTS observados en todos los estudios clínicos; comparando los grupos que han recibido la vacuna contra el VPH con los grupos control. Si se observan diferencias, por favor discuta las posibles explicaciones, incluyendo factores de riesgo para el desarrollo de CRPS y POTS.
Los fabricantes respondieron a estas dos preguntas haciendo referencia a su base de datos de los ensayos clínicos (Cuadro 2 para los ensayos qHPV y Cuadro 3 para los ensayos bHPV). Utilizaron métodos muy similares. Buscaron en sus bases de datos los casos que habían sido etiquetados como CRPS y POTS, ya fuera por los responsables de los ensayos clínicos o en los informes de farmacovigilancia, o los casos que tuvieron una o más características sugestivas de cualquiera de los síndromes (Cuadro 1: C, p 8; E, p 35). A continuación, enumeraron y describieron los casos en que CRPS y POTS aparecían como “términos preferidos”. Los números de casos y el país donde se detectaron fueron eliminados de los informes de los fabricantes.
La respuesta a ambas preguntas da una lista de ensayos clínicos. Sin embargo, los criterios para su inclusión o exclusión en el análisis no fueron claramente explicados. Esto impide reproducir los resultados de la revisión, aun teniendo acceso a los informes de los ensayos clínicos.
| Número del estudio | EMA posee el informe del estudio clínico | Está incluido en la revisión del fabricante | Lo tiene EMA y está incluido en la revisión |
| 005 | Y | N | N |
| 007 | N | Y | N |
| 011 | N | Y | N |
| 012 | Y | Y | Y |
| 013 | Y | N | N |
| 015 | Y | Y | Y |
| 016 | Y | Y | Y |
| 018 | Y | Y | Y |
| 019 | Y | Y | Y |
| 020 | Y | Y | Y |
| 024 | N | Y | N |
| 025 | N | Y | N |
| 029* | N | N | N |
| 030* | N | N | N |
Cuadro 3. Estudios bHPV que contribuyen datos a la revisión de los fabricantes
| Número del estudio | EMA posee el informe del estudio clínico | Está incluido en la revisión del fabricante | Lo tiene la EMA y está incluido en la revisión |
| HPV-001 | Y | Y | Y |
| HPV-004 | Y | N | N |
| HPV-005 | Y | N | N |
| HPV-007 | Y | N | N |
| HPV-008 | Y | Y | Y |
| HPV-009 | Y | Y | Y |
| HPV-012 | Y | N | N |
| HPV-013 | Y | Y | Y |
| HPV-014 | Y | N | N |
| HPV-015 | Y | Y | Y |
| HPV-020 | Y | Y | Y |
| HPV-021 | Y | Y | Y |
| HPV-023 | Y | N | N |
| HPV-026 | N | Y | N |
| HPV-029 | Y | Y | Y |
| HPV-030 | Y | Y | Y |
| HPV-031 | N | Y | N |
| HPV-032 | N | Y | N |
| HPV-033 | Y | Y | Y |
| HPV-035 | N | Y | N |
| HPV-036 | N | Y | N |
| HPV-038 | N | Y | N |
| HPV-048 | Y | N | N |
| HPV-049 | Y | N | N |
| HPV-058 | N | Y | N |
| HPV-069 | N | Y | N |
| HPV-070 | Y | N | N |
Por ejemplo, el informe que MSD entregó al Comité dice que “el Titular del Permiso de Comercialización revisó los datos de todos los estudios clínicos de la vacuna qHPV (programa clínico V501) y 9vHPV [vacuna de nueve valencias] (programa clínico V503) en los que se apoyaban las solicitudes de comercialización que se hicieron alrededor del mundo y en donde los participantes recibieron la vacuna qHPV, o la vacuna 9vHPV, o placebo “[énfasis añadido]. No hay una lista exhaustiva de todos los ensayos y la redacción sugiere que sólo se incluyeron los datos de “ensayos útiles” (es decir, sólo los que se utilizan para solicitar la concesión de licencias). La lista de ensayos presentados por MSD al PRAC no parece corresponder a la lista de ensayos con la vacuna qHPV que se sabe han sido entregados a EMA (Cuadro 1: C, p5; E, pág. 34).
Del mismo modo, no está claro el razonamiento para excluir los datos de los ensayos clínicos con la vacuna multivalente (es decir con > 4 tipos de HPV) contra el VPH no registrada. La explicación es: “… estas vacunas de HPV difieren de la vacuna qHPV” y “… ellas [las mujeres jóvenes] habían recibido la vacuna qHPV antes de inscribirse” (Cuadro 1: C, p.6)
Pregunta 3: Tras su comercialización, los Titulares de los Permisos de Comercialización deben proporcionar un análisis del número observado de casos de CRPS y POTS asociados con su vacuna contra el VPH en comparación con los esperados en la población objetivo, y si están disponibles, estratificados por región. El análisis debe discutir las suposiciones hechas con respecto a la incidencia antecedente en la población de blanco y la influencia de la posible sub-notificación de casos asociados con las vacunas del VPH.
Como sugiere la pregunta, los fabricantes calcularon las tasas de incidencia de CRPS y POTS (para “comparar con los esperados en la población objetivo”) utilizando sus propias bases de datos y el número de dosis de vacuna distribuidas como denominador (Cuadro 1: C, p 69, p 94; E, p 80). Las comparaciones se basan en estimaciones de las tasas de incidencia. Los fabricantes tuvieron dificultades para reconstruir tanto las tasas observadas como las esperadas. GlaxoSmithKline estimó la incidencia de POTS entre 15 y 140 / 100.000 en el mejor y peor escenario. GlaxoSmithKline, en el caso del bHPV y debido a la incertidumbre de las dosis administradas, realizó análisis de sensibilidad para las tasas de POTS utilizando las tasas de incidencia anteriormente observadas (Cuadro 1: E, p. 57). Los análisis de sensibilidad son útiles para evaluar el impacto de la incertidumbre en las conclusiones. Dichos análisis se basan en diferentes escenarios con diferentes hipótesis (en este caso las posibles tasas de incidencia de POTS). Al variar las tasas de incidencia, el análisis puede identificar cambios en las conclusiones.
Los fabricantes, tras describir los posibles casos de CRPS y POTS que conocían, señalaron debilidades sistemáticas en los datos (definiciones de caso incompletas, sub-notificación de casos, ausencia de denominadores y descripciones rudimentarias). Posteriormente concluyeron que la información evaluada era insuficiente para proporcionar pruebas de una posible asociación entre CRPS / POTS y la exposición a las vacunas contra el VPH.
Pregunta 4: Los Titulares del Permiso de Comercialización deben entregar una evaluación crítica de la calidad de la evidencia de la asociación causal entre la vacuna contra el VPH y CRPS y POTS. Esto debe abarcar la literatura publicada disponible, incluyendo estudios epidemiológicos y las posibles causas y fisiopatología de CRPS y POTS, y discutir si existe una base biológica para una posible asociación causal.
Los fabricantes respondieron haciendo un análisis de los estudios publicados disponibles (incluidos los grandes estudios observacionales) y los mecanismos fisiopatológicos que se habían propuesto como posibles involucrados en la génesis de CRPS y POTS. La conclusión general de los fabricantes fue que no encontraron evidencia de que hubiera un mecanismo biológico de asociación entre las vacunas contra el VPH y CRPS y POTS. Sin embargo, la conclusión de GlaxoSmithKline proporciona algunas explicaciones: “… la explicación más convincente para el CRPS apunta hacia una respuesta exagerada a traumas menores, mientras que en el caso de POTS no puede excluirse el papel de una variedad de autoanticuerpos. Dada la diversidad de síntomas y los mecanismos causales propuestos, no es obvio que haya un vínculo con la vacuna contra el VPH en ninguna de las dos situaciones. En el caso del CRPS, no se puede excluir el papel que podría jugar el mecanismo de administración: inyección con aguja “(Cuadro 1: E, p. 86).
Pregunta 5: Los titulares del permiso de comercialización deben discutir la necesidad de utilizar herramientas para minimizar los riesgos y proporcionar propuestas según corresponda.
Los fabricantes respondieron indicando que, a pesar de la falta de evidencia, continuarían analizando los informes de casos de CRPS y POTS y la sintomatología relacionada (Cuadro 1: C, p 174; E, p 90).
La revisión del PRAC de la EMA: una síntesis de las respuestas de los fabricantes a las cinco preguntas del PRAC
El informe de evaluación preliminar de los co-relatores fue compartido como “nota informativa” con el grupo asesor de las partes interesadas (Cuadro 1: G). Se esperaba que los co-relatores “… tomaran la iniciativa en la evaluación científica” y se les dio “… la tarea de evaluar a fondo los datos y redactar sus recomendaciones”. El grupo asesor de las partes interesadas entregó al PRAC de EMA la perspectiva de los expertos para complementar la perspectiva de la red reguladora “(Cuadro 1: H, p. 6).
Después de la consulta del PRAC con el grupo asesor de las partes interesadas, se produjo un informe actualizado de la evaluación y se distribuyó a todas las partes involucradas, incluyendo a los fabricantes.
El PRAC entonces “… tras una discusión plenaria consensuó su recomendación científica”. Esta recomendación fue incluida en el informe final de evaluación del PRAC, que resumió todos los datos evaluados por el PRAC para llegar a su conclusión (Cuadro 1: I, p 5)
Las recomendaciones fueron luego enviadas al Comité de Medicamentos para Uso Humano de la EMA, que lo revisó y discutió en plenaria y luego emitió sus conclusiones. Por último, la Comisión Europea emitió la Decisión de la Comisión por la que aprobaba el procedimiento de referencia de seguridad (Cuadro 1: I, p.5)
Se puso a disposición en línea un informe de evaluación de 40 páginas [9]
La contribución de los relatores
Como experto de EMA, el relator está “… obligado a mantener la confidencialidad durante toda la vida. El deber de confidencialidad se aplica a toda la información protegida por la obligación de secreto profesional… “[énfasis añadido] (Cuadro 1: G, p 2).
El informe confidencial de los relatores o la nota informativa para el grupo consultivo de las partes interesadas en la revisión del VPH, fechada el 13 de octubre de 2015 (Cuadro 1: G), se basa en gran parte en las revisiones de los fabricantes. Por ejemplo, las conclusiones de los relatores son similares a las de los fabricantes y recomiendan el “mantenimiento del permiso de comercialización” (es decir, el statu quo) (Cuadro 1: G, p 7-8, p 241).
Sin embargo, hubo desacuerdo entre los relatores. “El relator está de acuerdo con la mayoría de las conclusiones del co-relator de Cervarix, con la excepción de las recomendaciones relativas a una evaluación más detallada de CRPS y POTS”. El relator atribuye las mayores tasas de notificación de Dinamarca y Japón a la “publicidad entorno a la seguridad de la vacuna” y concluye que faltan “señales “claras tanto para CRPS como para POTS (Cuadro 1: G, p 247). Por lo tanto, no hay necesidad de cambiar la razón beneficio-riesgo de las vacunas (Cuadro 1: G, págs. 7-8).
También se discuten las opiniones de dos médicos holandeses (el Dr. Luc Kiebooms y el Dr. Andre Devos), y el PRAC las rechaza. Los médicos destacan aspectos sobre la eficacia y el perfil de seguridad de las vacunas contra el VPH. Recomiendan que el monitoreo de los daños se realice independientemente de los fabricantes (Cuadro1: G, p 171-7).
Los relatores también reprodujeron un cuadro de “tasas de notificación de CRPS por millón de vacunados” directamente de las presentaciones de los fabricantes (Cuadro 1: G, p 48). Aproximadamente la mitad de la información que había en el cuadro fue borrada en la revisión del PRAC antes de que se vieran obligados a divulgarla por las reglas de la Libertad de Información (Cuadro 1: C, p 69). La información de los cuadros se reproduce a continuación.
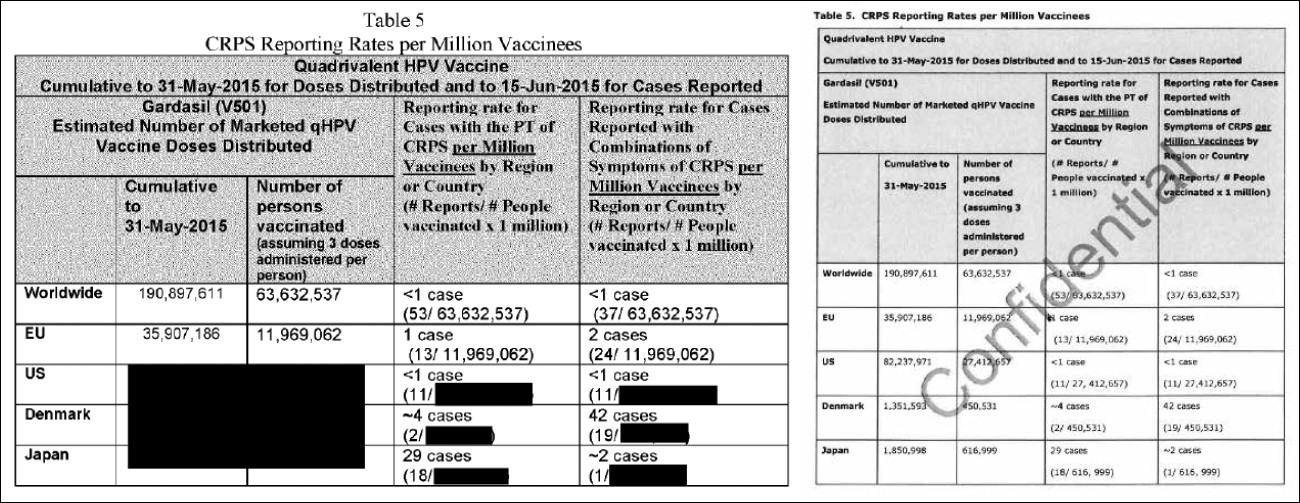
Discusión
Los documentos aquí presentados son numerosos y complejos. Sus datos provienen de diferentes fuentes. No podemos discutir las fortalezas y limitaciones del contenido de los documentos en detalle, pero sobresalen algunos puntos.
Los límites de la farmacovigilancia en relación con la revisión del PRAC de EMA. Los límites y las consecuencias de la farmacovigilancia son bien conocidos. La farmacovigilancia incluye los resultados más confiables (los resultados de ensayos clínicos aleatorios), así como la medida quizás menos confiable de eventos adversos: los informes espontáneos ad hoc.
Los ensayos clínicos se diseñan y realizan para probar hipótesis específicas. El diseño del estudio, la elección del comparador (por ejemplo, la vacuna comparada con el placebo) y la presentación de informes son elementos clave para evaluar un ensayo y su riesgo de sesgo.
La presencia de comparadores y la posibilidad de comparar las vacunas con placebo, tras asignar a los participantes al azar y cegar a los involucrados, presentan oportunidades únicas para responder preguntas difíciles sobre eventos adversos, como las planteadas por el PRAC. El diseño correcto del ensayo asegura que las diferencias de resultados que se observen entre los brazos sean probablemente únicamente debida a la intervención (en este caso vacunas de VPH).
Sin embargo, la revisión de la EMA se centra en gran medida en los informes de caso de CRPS y POTS. A diferencia de los ensayos, los informes de casos carecen de controles. Consecuentemente, no se pueden hacer declaraciones inferenciales, aunque se pueden generar hipótesis.
La mayoría de los informes de casos de CRPS y POTS se obtuvieron en clínicas con una gran carga de trabajo y a menudo carecían de detalles, lo que impedía compararlos con una definición preestablecida. Por otra parte, las tasas de notificación de CRPS y POTS probablemente se relacionaron con el conocimiento local sobre las vacunas, y pueden haberse originado en países o centros de atención que por alguna razón prestaron atención a los casos de CRPS y POTS.
Sin embargo, a pesar de que algunos de los eventos reportados fueron motivo de preocupación, el PRAC no consideró que las señales fueran lo suficientemente fuertes, sin importar su procedencia. Aunque algunas de las críticas a la calidad de los datos son fundadas, si la farmacovigilancia sólo puede producir datos de mala calidad, no tiene comparadores y, por consiguiente, no puede ayudar en situaciones similares ¿para qué recopilar estos datos? ¿Por qué continuamos con la farmacovigilancia?
Los límites de la farmacovigilancia son los mismos que algunos de los límites de la epidemiología moderna en su estado actual de desarrollo. Estos son: dificultad para generalizar de unos cuantos casos a una población y viceversa (en este caso del puñado de casos reportados de ciertos estados a una población mundial de decenas de millones); pruebas de significancia estadística que en el caso de eventos raros requiere de grandes bases de datos; y la falta de integración entre todos los tipos de evidencia (in vitro, animal y humano). Esto significa que no se puede hacer una evaluación definitiva sobre los posibles daños como CRPS y POTS.
El tema del posible daño de la vacuna contra el VPH plantea una situación difícil, porque la vacuna se ofrece – y en algunos lugares es obligatoria- a las mujeres sanas.
Los límites de la revisión del PRAC
El PRAC basó su análisis en datos agregados que proporcionaron los fabricantes. No revisó los resultados de los fabricantes, ni realizó un análisis independiente, ni obtuvo acceso a las bases de los datos de los ensayos clínicos que los fabricantes mencionaron en sus respuestas. Además, existen contradicciones fundamentales en la documentación, y no hay indicios de que el PRAC haya realizado análisis independientes de los datos proporcionados por los fabricantes. Es probable que el PRAC no evaluara una parte importante de los datos de los fabricantes. Esto es evidente cuando se observa de cerca el proceso:
En primer lugar, la EMA declaró en la carta que anunciaba el estudio de seguridad (fechada el 13 de julio de 2015) que “… no abordaría la cuestión de si los beneficios de las vacunas contra el VPH superan sus riesgos” (Cuadro 1: B, p 1). Por lo tanto, sorprende que la EMA decidiera responder a esta pregunta en su informe final de la evaluación que puso disposición del público (con fecha del 11 de noviembre de 2015): “… los beneficios de las vacunas contra el VPH continúan superando sus riesgos” (Ver [9], p 39). De hecho, esto parecía ser una conclusión inevitable.
En segundo lugar, los criterios para incluir los ensayos no son claros y parecen contradictorios. Uno de los relatores comentó este hecho (Cuadro 1: G, p. 29).
En tercer lugar, el PRAC no evaluó una cuarta parte de los ensayos que aportaron datos al análisis de los posibles casos de CRPS y POTS. Para la vacuna qHPV, el denominador combinado (el número total de mujeres) de los ensayos clínicos presentados por Merck Sharp & Dohme es 44.793 (Cuadro 1: C, p 7). Al cruzar la información sobre el número de ensayos clínicos de la vacuna contra el VPH con el archivo de ensayos de EMA queda claro que la EMA no tiene los informes de los ensayos clínicos: V501-007, V501-011, V501-024 y V501-025 (ver Cuadro 2). El denominador total (número de mujeres) en estos ensayos es 4.427. Esto representa que el PRAC no parece haber comprobado el 12% del conjunto de datos de los fabricantes (4427/36796, 12%). En el caso de los ensayos de bHPV hay un desajuste similar (Cuadro 3).
Cuarto, al menos cuatro ensayos incluidos en el archivo de EMA sobre qHPV (o que EMA sabe que existen) (ver Cuadro 2) no están incluidos en la lista de los fabricantes (Cuadro 1: C, p 7).
Finalmente, el PRAC reprodujo, de forma acrítica, las tasas de incidencia de CRPS y POTS construidas por los fabricantes (Cuadro 1: C, p. 69, p. 94, E, p 80, G, p 48).
Trascendencia
Puede ser que el desajuste entre los ensayos que EMA tiene archivados y los ensayos incluidos por los fabricantes en sus solicitudes de comercialización sean perfectamente razonables. Sin embargo, los reguladores y los fabricantes deben darse cuenta de que tanto la falta de claridad como el no divulgar toda la información generan teorías conspirativas. Esto perjudica la confianza del público y distorsiona sus opiniones sobre las vacunas o los medicamentos y el uso de estos productos.
El rechazo de los argumentos de los dos médicos holandeses, los requisitos de confidencialidad de los relatores y la renuencia del PRAC a revelar la identidad de sus relatores y sus conflictos de intereses generan inquietud por el secretismo que rodea la revisión (Cuadro 1: G, p 2, p. 171 – 7).
Hipotéticamente, los fabricantes podrían haber llegado a la conclusión (después de evaluar todos los datos post-comercialización) de que el riesgo era mayor que el beneficio potencial. Entonces, ¿por qué la EMA llevaría a cabo la revisión si no iba a cuestionar si los beneficios de las vacunas contra el VPH superan sus riesgos?
Nuevas preguntas sobre la regulación de la vacuna contra el VPH por EMA
Los documentos del Cuadro 1 plantean interrogantes sobre la naturaleza y la calidad con que la EMA regula la vacuna contra el VPH. Parece que el resultado del proceso de revisión de la EMA se decidió antes de su inicio. El PRAC de la EMA parece haber reproducido las respuestas de los fabricantes sin realizar un análisis independiente de las pruebas. Esto puede generar la sospecha de que el proceso de revisión de la EMA había prejuzgado su resultado. Una intervención de salud pública (como las vacunas contra el VPH), que se dan a millones de mujeres sanas, necesita una evaluación transparente de su función en la salud pública. Ninguna intervención de salud pública debe estar envuelta en tanto secreto que genere sospecha. La EMA debería considerar alternativas a sus requisitos de confidencialidad y cultivar un proceso de revisión más transparente, que afirme la confianza del público en su evaluación. La EMA ha progresado mucho hacia una mayor transparencia al publicar millones de páginas de informes de ensayos y otros documentos. Sin embargo, si no hay transparencia completa no merecerá la confianza del público y de los profesionales de la salud.
Nota de los editores de Salud y Fármacos
Los autores han declarado los conflictos de interés que se pueden leer en la versión inglesa. Las notas del artículo también se pueden leer en la versión inglesa.
Referencias