Agencias Reguladoras y Políticas
Agencias Reguladoras
EE UU y Canadá
Un número creciente de empresas están utilizando una vía de aprobación por parte de la FDA que se consideraba sospechosa (An Increasing Number of Companies Are Using a Once-Obscure FDA Drug Approval Pathway)
Alexander Gaffney
Regulatory Affairs Professionals Society, 8 de abril de 2015
http://www.raps.org/Regulatory-Focus/News/2015/04/08/21933/An-Increasing-Numbers-of-Companies-Are-Using-a-Once-Obscure-FDA-Drug-Approval-Pathway/?utm_source=Email&utm_medium=Informz&utm_campaign=RF%2DToday
Traducido por Salud y Fármacos
Una revisión de Thompson Reuters ha documentado que las compañías está utilizando cada vez más un mecanismo poco conocido para conseguir la aprobación de la FDA de nuevas dosis, formulaciones o combinaciones de medicamentos.
En EE UU, los productos farmacéuticos se suelen aprobar utilizando una de estas tres estrategias:
La mayoría de los productos que hay en el mercado se han aprobado a través de una de estas tres vías. Hay, sin embargo, varias otras que se pueden utilizar para obtener la aprobación de un fármaco.
Una de las vías alternativas más populares es la 505 (b)(2), que está diseñado para permitir la aprobación de un medicamento que no es nuevo, pero se diferencia en varios aspectos significativos. Como se describe en el documento de orientación de la FDA de 1999, Applications Covered by Section 505(b)(2), una solicitud 505(b)(2)
“[E]s una solicitud en la que una o más de las investigaciones invocadas en la solicitud de aprobación ‘no se llevaron a cabo por o para el solicitante y el solicitante no ha obtenido el derecho a hacer referencia o utilizar de información de la persona por o para los cuales se llevaron a cabo las investigaciones. ‘”
En términos sencillos, en la vía 505 (b)(2) el patrocinador se basa en datos clínicos o literatura producidas por otras empresas o entidades.
Pero, ¿por qué una empresa quiere confiar en esos datos? La razón más frecuente es que el patrocinador de la 505 (b) (2) ha hecho “cambios a los fármacos aprobados previamente”, incluyendo su dosis recomendada, su formulación, su vía de administración, su potencia, o en la combinación de medicamentos que incluye.
El vía 505 (b)(2) se ha creado con la intención de “fomentar la innovación sin crear la necesidad de duplicar el trabajo y refleja el mismo principio que la solicitud 505(j): llevar a cabo estudios para demostrar lo que ya se conoce sobre un medicamento es un derroche y es innecesario “, explicó la FDA en su guía.
Por ejemplo, si una empresa quisiera reformular un medicamento para ser administrado sólo una vez por día en lugar de tres veces al día, se podría utilizar la vía 505 (b)(2) para minimizar la cantidad de datos originales que tendría que presentar en apoyo de su nuevo medicamento. Los reguladores podrían confiar en datos existentes mostrando que el fármaco de referencia es seguro y eficaz, y centrarse en determinar si los cambios realizados en el nuevo fármaco modifican su seguridad o eficacia.
Un vía cada vez más popular
La vía 505 (b)(2) puede ser poco conocida, pero ya se usa mucho. Un nuevo informe de esta semana de Thompson Reuters considera que la FDA revisa cada año más solicitudes 505 (b)(2) que 505 (b)(1) (es decir, nuevos usos de medicamentos).
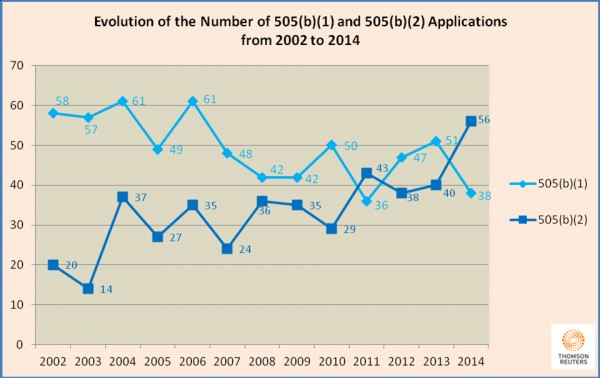
En 2014, por ejemplo, la FDA revisó 56 solicitudes 505 (b)(2), la cifra más alta desde al menos 2002, y posiblemente la más alta de la historia.
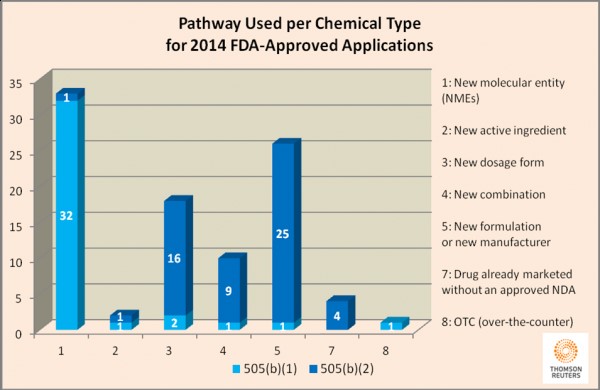
El aumento de aprobaciones 505 (b)(2) ha ocurrido por diversos factores, halló Thompson Reuters. Veinticinco de las 56 505 (b)(2) aprobadas en 2014 eran nuevas formulaciones de medicamentos existentes, mientras que 16 de los 56 eran nuevas dosis de los medicamentos existentes. En cuatro casos, los fabricantes solicitaron la aprobación de un medicamento no aprobado previamente en base a resultados de estudios existentes que no siempre habían sido enteramente realizados por el patrocinador.
Thompson Reuters también encontró que a pesar de que se requiere menos evidencia para aprobar una solicitud 505 (b)(2, los tiempos de aprobación no son necesariamente más rápidos que los medicamentos aprobados a través de la vía 505 (b)(1).
| Días que tardan en conseguir la aprobación (mediana) | |||
| 505(b)(1) | 505(b)(2) | Diferencia | |
| Revisión no acelerada | 549 | 503 | 46 |
| Revisión acelerada | 354 | 378 | 24 |
La aprobación de solicitudes por la vía 505 (b)(2) tardaban en promedio 46 días más que las de los medicamentos aprobados por la vía estándar (Nota del Editor: pensamos que aquí el escritor se ha equivocado y quiere decir 46 días menos), y eran 24 días más lentas para los medicamentos de revisión expedita.
“Esto significa que es más atractivo para un patrocinador proporcionar los datos completos para apoyar la aprobación de su producto como si lanzase una [Nueva Entidad Molecular], mientras se benefician de un proceso de revisión expedita, en lugar de seguir el proceso 505 (b)(2) aplicación sin que se le conceda un proceso de revisión acelerada “, explicó Thompson Reuters.
Ese análisis, sin embargo, no tiene en cuenta el coste de realizar los estudios clínicos o el ahorro de tiempo al no llevar a cabo los estudios. Reuters señala que es importante que estos costes “se tengan en consideración, especialmente porque la aprobación por parte de la FDA no está garantizada”. La vía 505 (b)(2) puede ser un poco más lenta, pero también mitiga muchos de los riesgos de desarrollo de fármacos que enfrentan las empresas, añade el informe.