LA AMENAZA GLOBAL DE LOS MEDICAMENTOS FALSOS: RAZONES QUE OBLIGAN A LA INDUSTRIA Y A LOS GOBIERNOS A COMUNICAR EL PELIGRO
(The global threat of counterfeit drugs: Why industry and governments must communicate the dangers)
Cockburn R, Newton PN, Kyeremateng Agyarko E, Akunyili D. White NJ (a)
PloS Medicine abril 2005;2(4)
Traducido por Carlos E. Cermignani
Introducción
La producción de fármacos falsificados y de medicamentos que no cumplen con los estándares de calidad constituye un problema grave que, además, se notifica poco y que afecta especialmente a los países pobres. Constituye una causa importante de morbilidad y mortalidad innecesaria y de pérdida de la confianza pública en los medicamentos y en las estructuras sanitarias. La presencia de medicamentos falsificados parece estar aumentando (véase “La escala del problema”) y no ha sido contrarrestada con una cooperación más estrecha entre las compañías farmacéuticas, los gobiernos y las organizaciones internacionales relacionadas con el comercio, la salud, los derechos aduaneros y los impuestos internos y las falsificaciones.
En este artículo sugerimos que muchas compañías farmacéuticas y gobiernos son reticentes a difundir el problema, tanto a los equipos de salud como al público, aparentemente motivados por la creencia de que la publicidad afectaría negativamente las ventas de los productos de marca en un mercado ferozmente competitivo. Públicamente, al menos, varias fuentes comerciales afirman que la justificación del resguardo de la información se basa en el intento de evitar todo tipo de alarma que podría determinar que los pacientes no tomen los medicamentos que necesitan y que son de buena calidad. Nosotros sostenemos que el secretismo y la consiguiente falta de advertencias de salud pública están poniendo en situación de riesgo a los pacientes y que esto puede afectar negativamente los intereses a largo plazo de la industria farmacéutica legítima. Proponemos que se haga una modificación al sistema obligatorio de notificación a las autoridades gubernamentales, quienes a su vez deberían tener la obligación legal de investigar, elaborar advertencias al público apropiadas y compartir la información más allá de las fronteras. Este rol no debe dejarse en manos de la industria farmacéutica pues hay un serio conflicto de interés.
Mientras que algunas compañías farmacéuticas han difundido advertencias al público para proteger a los pacientes, otras han sido criticadas por retener la información y en un reciente episodio acaecido en los EE.UU. fueron llevadas a la corte por no actuar. La industria está comenzando a preocuparse por este problema. En 2003, las compañías farmacéuticas estadounidenses establecieron un acuerdo con la Food and Drug Administration (FDA) por el cual notificarían a la misma toda sospecha de falsificación de medicamentos dentro de los cinco días de su detección (véase “Compañías que han advertido”), aunque éste aún es un compromiso voluntario. En muchos países pobres, donde el problema es aún peor, no hay iniciativas similares, sean gubernamentales o de la industria.
La magnitud del problema
Se ha estimado que hasta un 15% de los medicamentos vendidos son falsificaciones y que en algunos lugares de Africa y Asia esta cifra excede el 50% ([1,2,3,4,5,6,7]; R. Jones, vocero de la FDA, informe por e-mail, 18 de noviembre de 2004). La FDA estima que las falsificaciones comprenden aproximadamente el 10% del mercado global de medicamentos (Jones, vocero de la FDA, informe por e-mail, 18 noviembre de 2004). Esta estimación sugiere que las ventas anuales delictivas exceden la suma de US$ 35.000.000.000 [1,2]. El número de investigaciones de posibles medicamentos falsificados efectuadas por la FDA ha crecido de aproximadamente cinco por año en los ’90 a más de 20 por año desde 2000 (Figura 1).
La mayor parte de la bibliografía sobre medicamentos falsificados deriva de investigaciones periodísticas locales [6,8,9,10,11,12,13,14], siendo escasas las investigaciones científicas desde la salud pública con respecto a la enorme magnitud de esta empresa criminal. Los efectos sobre los pacientes de los medicamentos falsificados resultan difíciles de detectar y cuantificar y la mayoría quedan ocultos en las estadísticas de salud pública. El estimado de 192.000 muertes de pacientes producidas por medicamentos falsificados en China durante 2001 brinda una indicación de la escala del sufrimiento humano.
Confidencialidad y medicamentos falsificados
La mayoría de los datos epidemiológicos de los medicamentos falsificados los mantiene la industria farmacéutica y las agencias gubernamentales en secreto. Las compañías farmacéuticas emplean investigadores para descubrir el origen de la mercadería y facilitar el cierre de las industrias falsificadoras, pero esto ocurre especialmente en privado.
No existen bases de datos realmente asequibles mediante las cuales los trabajadores de la salud o el público puedan acceder a datos actualizados sobre cuáles son los productos falsificados que se están vendiendo en una localidad. Mientras es obvio que la información sobre las estrategias anti-falsificaciones y de las fuentes encubiertas de inteligencia no deben revelarse, también creemos que la información sobre cuál medicamento está siendo falsificado y dónde debería ser de conocimiento público [1].
Renuencia gubernamental
Los gobiernos a menudo son renuentes a difundir los problemas referidos a la calidad de los medicamentos existentes en el mercado de sus respectivos países. Esto se refleja en gran parte del mundo en inactividad frente al problema de las falsificaciones, sobre todo cuando se compara con el gran impacto que tiene este problema en la salud pública. La Organización Mundial de la Salud (OMS) posee un sistema de notificaciones y parte de la información está a disposición pública [15]. Sin embargo, la información que la OMS pone a disposición del público excluye un elemento crucial: el país o región en la cual se identificó la falsificación. Por otra parte, la OMS no ha recibido notificaciones de medicamentos falsificados por parte de los países miembros después del año 2002 y sólo recibió 84 notificaciones entre 1999 y 2002 [16,17].
En algunos países, se ha acusado a los funcionarios gubernamentales de estar involucrados en la certificación falsa de medicamentos falsificados y en otros se ha criticado a las agencias gubernamentales por suprimir información [9,18]. La OMS, está planeando un sistema de alerta rápido para acelerar la distribución de advertencias e informaciones a los gobiernos de la región del Pacífico occidental, un área seriamente afectada por los medicamentos falsificados.
Vigilancia de la industria farmacéutica
Escribimos al Pharmaceutical Security Institute (PSI) (véase el Recuadro 1), que compara la información sobre fármacos falsificados obtenida por la industria, preguntándoles si habitualmente remiten las notificaciones de medicamentos falsificados a los gobiernos correspondientes y a la OMS. Esta pregunta no fue contestada, pero el PSI (en una carta fechada el 29 de julio de 2003) nos informó que “Desde sus comienzos, se reconoció que una gran parte de esta información que el PSI posee permanecería confidencial y no sería diseminada. Hay información relacionada con la patente que no puede ser revelada, ya sea a otras compañías o al público en general. Consecuentemente, la difusión de la información en este momento… es restringida y limitada.” La carta agregaba que el PSI alienta a sus miembros a que notifiquen los casos de falsificación a las autoridades correspondientes y apoya totalmente la notificación voluntaria a la FDA. También escribimos a 25 grandes compañías, de las más de 70 que poseen oficinas en el Reino Unido, pidiéndoles información sobre las políticas de las mismas en relación a las acciones que deberían tomarse y a quién debería informarse cuando se detectara la falsificación de uno de sus productos. Recibimos respuestas de seis compañías, una (Merck Sharp and Dohme) declinó dar todo tipo de información, mientras que tres (GlaxoSmithKline [GSK], Bristol-Myers Squibb y Novartis) informaron que si tuviesen conocimiento de que alguno de sus productos estaba siendo falsificado notificarían a la autoridad reguladora de medicamentos correspondiente.
Escasez de advertencias sobre medicamentos falsificados
El escaso número de advertencias en relación a la magnitud del problema muestra que la mayoría de las compañías farmacéuticas, organizaciones profesionales y gobiernos, tanto de los países desarrollados como de aquellos en vías de desarrollo, no difunden información al respecto. La historia de secretismo de la industria en referencia a la información sobre la falsificación de medicamentos y los alegatos de una motivación comercial se remonta a más de 20 años. Un vocero de la Association of the British Pharmaceutical Industry dijo: “Es difícil denunciar el problema [de la falsificación de un medicamento] sin dañar un negocio legítimo” [13]. Esta percepción de que hay que guardar secreto se apoya en propuestas históricas como la siguiente: “La Society [Royal Pharmaceutical Society de Gran Bretaña] no remite notas de prensa [sobre medicamentos falsificados] porque considera que en tanto sea posible debe mantenerse entre bambalinas (…) y no debe buscarse una gran publicidad porque podría dañar la confianza pública en los medicamentos” [19]. Sin embargo, la Royal Pharmaceutical Society de Gran Bretaña ha revisado recientemente su posición. David Pruce, Director de Mejoramiento en Práctica y Calidad de la organización nos dijo (correo electrónico, 14 de febrero de 2005), “Si existe el riesgo de que a un paciente se le haya dispensado un medicamento falsificado, es de vital importancia que el paciente afectado sea informado. Recientemente, en Gran Bretaña se han producido dos casos en los cuales los medicamentos falsificados aparecieron en la cadena legal de dispensación farmacéutica. El anuncio público del problema de los medicamentos falsificados fue por consiguiente totalmente apropiado y necesario.” Agregó que “Es importante que las noticias de este tipo se manejen responsablemente, de modo tal que no se afecte la confianza del público en sus medicamentos. Esto podría determinar que los pacientes dejen de tomar los medicamentos de calidad.”
Esta valoración, que los peligros de causar alarma en el público general puede superar los beneficios de la difusión de la información, sigue siendo ampliamente compartida por empleados de los estamentos públicos. Un vocero de la Association of British Pharmaceutical Industries, Marjorie Syddall, escribió (correo electrónico, 20 de octubre de 2003), “Una compañía debería estar completamente convencida de que un medicamento es falsificado antes de informar a las autoridades, pero aún más importante, antes de difundir la información al público -de modo tal que no se cause ninguna alarma innecesaria.”
Motivación comercial – “Competencia a degüello”
Chris Jenkins, miembro fundador del PSI y actualmente Director Asociado de Pinkerton Consulting and Investigations, nos dijo (informe por e-mail, 9 de diciembre de 2004): “Es necesario mantener la confidencialidad de la información sobre medicamentos falsificados por razones comerciales (…) para evitar la difusión a los medios y para prevenir la posibilidad de que compañías farmacéuticas rivales tomen una ventaja comercial desleal con respecto a la compañía víctima.” Explicó que “Al principio, nosotros [el PSI] estábamos en contra de tener datos online que cualquiera pueda consultar (…) Si un paciente entra en riesgo como resultado de un producto falsificado, la buena reputación de la compañía está en peligro de desaparecer, junto con la pérdida de la confianza en sus productos (…) Lo único que estamos intentando hacer, con mucho esfuerzo, es mantener [los datos] fuera del alcance del personal de publicidad de cualquiera de las compañías (…) La importancia de alcanzar los objetivos de venta es tal que incluso se puede detectar una competencia a degüello entre diferentes divisiones operativas de la misma compañía, mucho más cuando se trata de dos compañías que compiten en el mismo mercado con medicamentos similares.”
Las guías de la OMS de 1999 para desarrollar medidas destinadas a combatir los medicamentos falsificados establecen que “la reticencia de la industria farmacéutica, droguerías y vendedores minoristas para notificar la falsificación de medicamentos a las autoridades reguladoras nacionales podría impedir a dichas autoridades la adopción de medidas exitosas contra la falsificación” y sugieren “la notificación obligatoria a las autoridades pertinentes de cualquier incidente en el cual se detecte o esté relacionado con falsificaciones” [20]. Una revisión reciente de la legislación sobre los medicamentos falsificados exhorta a “erradicar de la situación de clandestinidad a los registros y a informar sobre medicamentos falsificados” [21]. En la International Conference of Drug Regulatory Authorities efectuada en Madrid en febrero de 2004, la OMS estableció que “la industria farmacéutica tiene una gran cantidad de datos pero es ‘muy reticente a hacerlos disponibles’” [17].
Información estrictamente confidencial
En los EE.UU. se informó que había sido “muy difícil obtener información fáctica citable acerca de la extensión del problema de los medicamentos falsificados. Las compañías farmacéuticas mantienen la información que poseen en un status estrictamente confidencial” [22]. En 1989, el British Department of Health y Glaxo (ahora parte de GlaxoSmithKline) fueron criticados por no publicar información sobre el descubrimiento, en Gran Bretaña, de inhaladores falsificados de Ventolin Glaxo. The Times de Londres obtuvo la licencia del Ventolin falsificado y los números de lotes para elaborar una nota periodística, lo que ocasionó que se publicase la información. Glaxo y el Department of Health elaboraron cartas de alerta que se enviaron a los 14.000 farmacéuticos de Gran Bretaña a las cinco semanas de haberse descubierto el fraude [8]. En 1998, la compañía Schering do Brasil fue acusada de mantener en secreto durante 30 días el descubrimiento de anticonceptivos orales fabricados con harina de trigo, en tanto llevaban a cabo sus propias investigaciones [23]. De acuerdo al Far Eastern Economic Review, el gobierno brasilero impusó una multa a la compañía de US$2,5 millones [6]. Schering do Brasil nos informó (correo electrónico, 17 de febrero de 2005) que “la Justicia Federal canceló la multa en el año 2002 después de la apelación de la compañía”. En Nigeria, en 1995, una de las vacunas contra la meningitis que fue falsificada llevaba etiquetas como si hubiera sido fabricada por SmithKline Beecham, pero Le Monde informó que la compañía no actuó contra los falsificadores, temerosa de que ello podría dañar el comercio [24].
Medicamentos antimaláricos pediátricos falsificados
La necesidad de hacer pública la información sobre medicamentos falsificados se torna aguda en Africa, donde se estima que el resurgimiento de la malaria está matando a un millón de personas por año, la gran mayoría de ellos niños menores de cinco años [25]. Un ejemplo ilustra los problemas que se observan. Uno de nosotros (K. Agyarko) encontró falsificaciones del jarabe pediátrico antimalárico de halofantrina (Halfan, Glaxo) en agosto de 2002 en Ghana. Ese mes, él preparó una advertencia de salud pública. Agyarko y su comisionado le dijeron a la BBC [26] que también alertaron al representante de GSK en Ghana, quien lo visitó acompañado de un staff de GSK de la central de Londres y se llevaron muestras del Halfan falsificado. Agyarko declaró públicamente (el 23 de septiembre de 2002, en el First Global Forum on Pharmaceutical Anticounterfeiting en Ginebra, Suiza) [26] que GSK le pidió que retirara su alerta al público porque podría “dañar” a su producto. Después de su reunión con GSK, no se emitió ninguna advertencia. En una declaración por escrito (correo electrónico, 24 de octubre de 2003), GSK negó haber recibido el alerta de Agyarko y expresó que a la compañía “las autoridades de Ghana no le suministraron ninguna muestra del producto falsificado”.
Luego de un año de averiguaciones, que dieron como resultado un programa radial de la BBC (BBC Radio 4, “File on 4”, el 5 de octubre de 2004) [26], GSK cambió su posición y afirmó que su agente local “se encontró casualmente” con Agyarko y que había recibido su alerta y muestras falsificadas del jarabe Halfan. En una nueva declaración (correo electrónico, 5 de octubre de 2004) GSK dijo que “En ningún momento se presionó a las autoridades de Ghana para que no emitieran una advertencia pública sobre el Halfan falsificado.” El vicepresidente de comunicaciones de GSK, Louise A. Dunn, nos dijo (correo electrónico, 6 de octubre de 2004): “Existió alguna confusión con respecto a las interacciones con el Sr. Agyarko. El punto clave es que nada estuvo mal hecho…”
Sin embargo, el incidente de Ghana se tiene que analizar en el contexto del amplio comercio ilegal de jarabe Halfan que se ha detectado en Africa occidental y la reticencia de GSK a darnos detalles sobre ese comercio. Le preguntamos a GSK si había difundido algún tipo de advertencia pública acerca de la falsificación de jarabe Halfan, pero la pregunta no fue contestada. La única referencia de dominio público que fuimos capaces de identificar con respecto al jarabe de halofantrina falsificado había sido publicada por el Medicines Research Centre de GSK en una revista técnica especializada y describía el análisis por espectrometría de los jarabes falsificados de halofantrina [27]. En el artículo se demostraba que los jarabes falsificados contenían dos sulfonamidas potencialmente peligrosas pero no contenían halofantrina. Escribimos una carta a GSK (carta del 20 de junio de 2003) preguntándoles cuándo y dónde se habían descubierto las falsificaciones de Halfan y quienes les habían informado al respecto. GSK nos dijo solamente que “el Halfan falsificado se encuentra presente en Nigeria y Sierra Leona” (carta del 21 de julio de 2003). No nos brindó ningún detalle del tipo de preparación ni datos del descubrimiento.
El jarabe Halfan GSK falsificado lo descubrió la Nigerian National Agency for Food and Drug Administration and Control (NAFDAC) en Nigeria en junio de 2002, quién alertó a GSK y difundió una advertencia de salud pública en junio de 2002 en el boletín habitual de la NAFDAC sobre medicamentos falsificados [28], brindando los detalles que identificaban al Halfan jarabe falsificado. Dora Akunyili, del NAFDAC, relató en el programa de radio de la BBC (5 de octubre de 2004): “Es más peligroso no alertar al público. Nosotros seguiremos difundiendo advertencias incluso si descubrimos la falsificación en un solo comercio. Si uno detecta un producto falsificado sólo en un comercio, puede estar seguro que está en muchos pueblos (…) No defendemos las compañías. Estamos defendiendo a las personas” [26].
El Pharmaceutical Board de Sierra Leona, que maneja los casos de falsificación de medicamentos, no había sido informado por GSK de ningún descubrimiento de jarabe Halfan falsificado, según informó su director Michael J. Lansana (correo electrónico, 21 de enero de 2004), aunque él sí recibió una notificación de GSK sobre la falsificación de tabletas de Halfan adultos. Posteriormente, GSK nos dijo (correo electrónico, 3 de octubre de 2004) que el jarabe Halfan falsificado que habían analizado se había encontrado en Sierra Leona a fines de 2001 y que habían informado del hallazgo al Ministro de Salud y Sanidad de Sierra Leona.
En el informe de la OMS, Counterfeit Drug Reports for 1999 – October 2000 [15], sólo figura una única notificación de halofantrina falsificada, sin que se especificaran detalles del tipo de preparado o la localización.
Riesgos y cooperación a través de las fronteras
Los casos de jarabe Halfan falsificados resaltan la importancia de la comunicación y la cooperación a través de las fronteras y la necesidad de la industria y los gobiernos de informar a los países vecinos cuando se detecta una falsificación. La distribución global y la escala del fraude sistemático en la falsificación de cápsulas de Halfan para adultos quedó clara en diciembre de 2000, cuando agentes aduaneros belgas incautaron 57.600 cajas de cápsulas falsificadas de Halfan (GSK) (y 4.400 cajas de Ampiclox [ampicilina GSK] falsificado y 11.000 cajas de Amoxil [amoxicilina GSK]) también falsificado) que estaban siendo transportadas desde China a Nigeria. Se constató que, en China, los falsificadores estaban preparándose para exportar 43 toneladas de 17 marcas registradas de medicamentos de siete compañías farmacéuticas internacionales [29].
Compañías que han publicado advertencias
Algunas veces las compañías farmacéuticas han publicado información para alertar a los trabajadores de la salud y a los pacientes de los peligros de los productos falsificados. Por ejemplo, Johnson and Johnson, Serono, Hoechst, Wellcome Foundation (ahora parte de GSK), GSK y Genentech han publicado información sobre los fármacos que ellos producen y que han sido falsificados o adulterados. En 1982, el paracetamol adulterado criminalmente con un compuesto de cianuro causó la muerte de siete personas en los EE.UU. La compañía farmacéutica cuyo producto había sido adulterado, Johnson and Johnson, publicó alertas y cooperó con la investigación, y aunque el costo financiero para la compañía fue grande, su reputación a largo plazo probablemente mejoró. Otras compañías, al menos inicialmente, no se aprovecharon del desastre para incrementar sus propias ganancias económicas [30]. En 2002, Johnson and Johnson a la semana de haberse notificado un grave problema de falsificación envió 200.000 cartas a los profesionales de la salud en los EE.UU. advirtiéndoles de la falsificación de Procrit (eritropoyetina) [31]. En 1982, Hoechst voluntariamente colocó alertas en las revistas libanesas para avisar a los farmacéuticos y a la población sobre la falsificación de su medicamento Daonil (glibenclamida), utilizado en el tratamiento de la diabetes mellitus [13]. En 2001, la FDA solicitó que Serono publicase una advertencia dirigida a hospitales, clínicas y pacientes de siete estados de EE.UU. tras descubrirse una falsificación de su medicamento Serostim, hormona de crecimiento humana [32]. En 1984, en Tailandia, la Wellcome Foundation (hoy parte de GSK) publicó el descubrimiento de falsificaciones de su antibiótico Septrin (cotrimoxazole), que carecían de cualquier tipo de ingrediente activo, y los esfuerzos de la compañía para detener su producción. Wellcome también recibió informes de que los productos falsificados estaban siendo exportados hacia el Reino Unido, información que hizo pública junto con la advertencia que había enviado a la Embajada Británica en Bangkok [14]. En 2002, GSK publicó el descubrimiento de falsificaciones de su medicamento para el tratamiento del VIH Combivir (zidovudine + lamivudine) [32] y Genentech publicó información sobre falsificaciones de Neupogen (filgramostim) [33].
La Pharmaceutical Research and Manufacturers of America anunció en abril de 2003 que, a partir del primero de mayo de 2003 sus 60 miembros notificarían voluntariamente a la FDA “dentro de los primeros cinco días laborables después de haber determinado que existen pruebas suficientes para sospechar que su producto está siendo falsificado” [34]. Esto constituye un importante desarrollo local pero debería incluir obligatoriedad legal y debería convertirse en un estándar global. Más aún, no hemos encontrado un solo país en el cual las compañías farmacéuticas tengan la obligación legal de notificar los descubrimientos de falsificaciones de sus productos a las autoridades de salud pública o de comercio.
Compartiendo información sobre medicamentos falsificados
Nosotros sugerimos que la industria farmacéutica, cuyo objeto es mejorar la salud, está poniendo en riesgo tanto a los pacientes como a sí misma al no alertar enérgicamente al público sobre la aparición de productos falsificados. Además del imperativo moral, existe la posibilidad de incrementar la presión legal sobre las compañías farmacéuticas para que asuman su responsabilidad por las falsificaciones de sus productos. En Gran Bretaña, existen propuestas para introducir un cargo de “crimen corporativo” para aquellas compañías que contribuyan a la muerte de clientes [35], estos cargos también pueden aplicarse a las compañías farmacéuticas cuando no toman medidas razonables para advertir al público sobre la existencia de medicamentos falsificados.
Compañías farmacéuticas demandadas en los EE.UU.
En los EE.UU. ya se ha presentado el primer caso judicial contra dos compañías farmacéuticas por no proteger a sus clientes de la falsificación de un medicamento. En 2003, un farmacéutico de la ciudad de Kansas fue enjuiciado por diluir los antineoplásicos Gemzar (gemcitabine) y Taxol (paclitaxel). Las víctimas y los familiares de los pacientes fallecidos demandaron a las compañías farmacéuticas Eli Lilly y Myers Squibb por no implementar acciones para detener al farmacéutico. Las compañías argumentaron que ellas no tenían ninguna obligación de proteger a los demandantes de los actos criminales del farmacéutico, pero un periódico informó que Eli Lilly and Myers Squibb llegaron a un acuerdo extrajudicial, aparentemente por US$72 millones, evitando el precedente legal que podría haber establecido que las compañías farmacéuticas son responsables por no difundir dicha información [36, 37].
Chris Jenkins sugiere que el PSI puede enfrentar una disputa legal que le obligue a abrir sus bases de datos de medicamentos falsificados (correo electrónico, 9 de diciembre de 2004): “Sólo el PSI tiene una visión global del fraude conocido (…) En teoría, cada caso de falsificación de medicamentos notificado por las compañías farmacéuticas debería encontrarse allí”. El PSI teme que los investigadores privados puedan acabar siendo responsables de los datos de medicamentos falsificados que obtienen para las compañías que los contratan.
Los gobiernos deben exigir la responsabilidad legal
Consideramos que la industria, conjuntamente con los farmacéuticos, los trabajadores de la salud y las entidades gubernamentales necesitan pasar de entablar la lucha contra las falsificaciones “entre bambalinas” y darle un enfoque público colaborativo con la responsabilidad legal de notificar las sospechas de falsificaciones a las autoridades reguladoras, de un modo similar al mecanismo utilizado para la notificación de las enfermedades infecciosas “de notificación obligatoria”. Las autoridades reguladoras de medicamentos, responsables ante los consumidores de medicamentos, deberían tener la obligación estatutaria de investigar y difundir la información, teniendo como principal preocupación los intereses de los pacientes. Las autoridades reguladoras de medicamentos de los países económicamente pobres necesitarán un apoyo financiero adicional.
Reconocemos que la información falsa puede dañar seriamente a una compañía, y que la información tiene que someterse a un proceso de verificación y tiene que utilizarse con prudencia. También reconocemos que al informar al público se tendrán que tomar medidas para evitar que los pacientes no dejen de utilizar los productos de calidad, pero consideramos que esto se puede lograr si las compañías farmacéuticas alerten al público en colaboración con las agencias gubernamentales (véase más arriba). La decisión de advertir al público no debe estar a cargo únicamente de la industria farmacéutica, quién tiene un serio conflicto de interés. Consideramos que los intereses a largo plazo, tanto de los pacientes como de la industria, se resguardan mejor con más apertura y responsabilidad social hacia la salud pública. Los empleados de la compañía y los grupos de interés no deberían asumir la resolución de conflictos entre la ganancia comercial y la salud pública -dicha adjudicación debería estar en manos de los departamentos gubernamentales responsables ante el público.
Modelo de la industria de la aviación
La Autoridad de la Aviación Civil del Reino Unido proporciona un modelo: las piezas de aviones sospechosas de no haber sido aprobadas deben, por ley, ser notificadas a la misma [38]. Cuando el informe sobre un fármaco falsificado es confirmado, las autoridades reguladoras deberían ser responsables de evaluar la importancia de la información para la salud pública y decidir cuándo y cómo alertar a las autoridades policiales, comerciales y aduaneras y al público, y también a las autoridades reguladoras de otros países que pueden verse afectados, con la asistencia de Interpol cuando sea necesario. Si la autoridad reguladora está segura, por ejemplo, de que el medicamento falsificado ha sido interceptado antes de llegar a las farmacias, la alerta al público puede no ser necesaria. La “confusión” referida en relación al jarabe Halfan de GSK ilustra la gran importancia, tanto para las compañías como para los organismos gubernamentales, de que haya un registro seguro de documentación de la información de modo tal que resulte claro qué ha ocurrido y cuándo.
La compañía farmacéutica también es una víctima de la falsificación y si notifican rápidamente esos eventos deberían recibir el apoyo de las autoridades gubernamentales. Los individuos que notifican sobre la presencia de medicamentos falsificados deberían permanecer en el anonimato y ser protegidos de las organizaciones de falsificadores en el mundo, que pueden buscar la venganza. El establecimiento de acuerdos internacionales entre las compañías para evitar que un competidor se aproveche de la desventura de una compañía, cuando aparecen rumores de falsificación o se confirma la presencia de medicamentos falsificados, puede facilitar una mayor cooperación entre las industrias farmacéuticas.
Convención Internacional contra los Medicamentos Falsificados
La reunión de Madrid en el año 2004 consideró una propuesta presentada por la OMS con respecto al desarrollo de una red o sistema internacional sobre medicamentos falsificados, para promover la cooperación internacional y el intercambio de información [17]. Si se concreta, esta podría ser una contribución muy importante para mejorar la calidad de los medicamentos. El control efectivo de la epidemia global de falsificaciones y medicamentos subestándares no será fácil y necesitará un enfoque multifacético: la provisión de medicamentos efectivos, disponibles y baratos; el fortalecimiento de la regulación de los medicamentos; una mayor apertura de los gobiernos acorde a la escala del problema; acciones policiales más eficaces contra los falsificadores y aquellos que puede ser aliados corruptos dentro del gobierno y la industria; incremento de la cooperación entre la industria, la policía, los agentes aduaneros y los reguladores de medicamentos y un aumento de la educación de los pacientes, vendedores de medicamentos y trabajadores de la salud [4,5,20]. Alentamos a la industria y a los gobiernos a actuar, compartiendo la información crucial sobre salud pública, para facilitar la protección de los pacientes y mejorar la calidad de un suministro de medicamentos aparentemente en deterioro.
Conferencia sobre Medicamentos Falsificados en París
Del 15 al 17 de marzo de 2005, el Segundo Foro Global sobre Antifalsificaciones Farmacéuticas se reunirá en París, donde representantes de las principales compañías farmacéuticas, gobiernos, profesionales médicos y científicos, agencias de ejecución legal, organizaciones no gubernamentales e investigadores privados se reunirán para discutir el creciente problema que amenaza a los pacientes y a la industria farmacéutica.
Agradecimientos
Estamos muy agradecidos al Dr. Lembit Rago, WHO Essential Drugs and Medicines Department; al Dr. Allan Schapira, WHO Roll Back Malaria Department; a John Anderson, Chairman of the Global Anti-Counterfeiting Group; a Mark Morris, Kansas City Star; a Erik Madsen, Interpol; a Danièle Letoré, Genevensis; y a Marie Ose, Agence France Presse. Estamos muy agradecidos al Profesor Marcus Reidenberg, Cornell University y a Michael Lansana, Head of the Pharmaceutical Board of Sierra Leone, por su apoyo para las argumentaciones utilizadas en este artículo. PN y NJW son apoyados por el Wellcome Trust del Reino Unido.
Contibuciones de los autores. Todos los autores investigaron la información para esta revisión, RC and PNN redactaron el primer manuscrito y todos los autores contribuyeron a la redacción de la versión final del manuscrito.
Ejemplos recientes de medicamentos falsificados
1. Aproximadamente entre un tercio y la mitad de los envases de tabletas de artesunato, el medicamento antimalárico clave para salvar vidas, adquirido recientemente en el sudeste asiático eran falsificaciones y no contenían ningún tipo de ingrediente activo. Una organización no gubernamental de un país del sudeste asiático compró 100.000 tabletas baratas de “artesunato” sólo para descubrir que las mismas eran falsificadas [7,39]. Véase en la Figura 2 ejemplos de artesunato falsificado que se vende en el sudeste asiático continental.
2. Se informó que un total de 192.000 pacientes chinos murieron en 2001 por medicamentos falsificados y en el mismo año las autoridades chinas “clausuraron 1.300 fábricas mientras investigaban 480.000 casos de medicamentos falsificados por un valor de 57 millones de US$” [12]. En 2004, las autoridades chinas arrestaron a 22 productores de leche en polvo pediátrica groseramente subestándar y cerraron tres fábricas después de la muerte de más de 50 niños [40].
3. En EE.UU., recientemente se ha informado sobre falsificaciones de atorvastatina [41], eritropoyetina [41], hormona de crecimiento [33], filgramostim [33,41], gemcitabina [36,37] y paclitaxel [36,37].
4. Nigeria recientemente amenazó con prohibir la importación de todo tipo de medicamentos de la India, su mayor proveedor, por la alta prevalencia de falsificaciones entre las importaciones [42].
5. En Haití, Nigeria, Bangladesh, e India, más de 500 pacientes, predominantemente niños, han muerto por el uso del tóxico dietilenglicol en la manufactura de jarabe de paracetamol falso [43,44,45].
6. Durante la epidemia de meningitis de 1995 en Niger, las autoridades recibieron la donación de 88.000 vacunas de Pasteur Merieux y SmithKline Beecham desde la vecina Nigeria. Se comprobó que los medicamentos eran falsificaciones, sin trazas del principio activo. Aproximadamente 60.000 personas fueron inoculadas con las vacunas falsificadas [24].
El reciente descubrimiento de antirretrovirales falsificados (stavudina-lamivudina-nevirapina y lamivudina-zidovudina) en Africa central [46] plantea la posibilidad de un retroceso desastroso en el tratamiento del HIV-SIDA en el Africa sub-sahariana, salvo que rápidamente se tomen acciones vigorosas.

Nota:
a. Robert Cockburn es un escritor y ex periodista de The Times, Londres, Reino Unido. Paul N. Newton se desempeña en el Centre for Clinical Vaccinology and Tropical Medicine, Churchill Hospital, Universidad de Oxford, Reino Unido. E. Kyeremateng Agyarko es Jefe Ejecutivo del Food and Drug Board, Accra, Ghana. Dora Akunyili es Directora General de la National Agency for Food and Drug Administration and Control, Lagos, Nigeria. Nicholas J. White se desempeña en la Faculty of Tropical Medicine, Mahidol University, Bangkok, Thailand y en el Centre for Clinical Vaccinology and Tropical Medicine, Churchill Hospital, University of Oxford, Reino Unido.
Conflictos de interés: NJW integra la junta editorial de PLoS Medicine. RC, PNN, EKA y DA declaran que no tienen conflictos de intereses.
Publicado el 14 de marzo de 2005.
DOI: 10.1371/journal.pmed.0020100
Copyright: © 2005 Cockburn et al. Este es un artículo de libre acceso distribuido bajo los términos de la Creative Commons Attribution License, que permite la utilización no restringida, la distribución y la reproducción en cualquier medio, en tanto el trabajo original sea adecuadamente citado.
Abreviaturas: FDA, Food and Drug Administration de los EEUU; GSK, GlaxoSmithKline; NAFDAC, Nigerian National Agency for Food and Drug Administration and Control; PSI, Pharmaceutical Security Institute; OMS, Organización Mundial de la Salud.
Cita bibliográfica: Cockburn R, Newton PN, Agyarko E, Akunyili D, White NJ (2005) The Global Threat of Counterfeit Drugs: Why Industry and Governments Must Communicate the Dangers. PLoS Med 2(4): 100.
A quien debe dirigirse la correspondencia. E-mail: rcockburn@libero.it
Estos autores contribuyeron por igual en este trabajo.
Referencias:
1. Cockburn R (2002) Crime, fear and silence: Making public the fake pharmaceutical drug racket [presentación]. First Global Forum on Pharmaceutical Anticounterfeiting 2002 Septiembre 22-25. Geneva, Switzerland.
2. (2003, noviembre 11) Global rise in use of fake drugs. London: BBC News. Disponible en: new.bbc.co.uk/go/em/fr/2/hi/health/3261385.stm. Acceso el 17 de noviembre de 2003.
3. World Health Organization (1992) Counterfeit drugs -Report of a WHO/IFPMA Workshop, 1992. WHO/DMP/CFD/92. Geneva: World Health Organization. 26 p.
4. World Health Organization (1998) Report of the International Workshop on Counterfeit Drugs. WHO/DRS/CFD/98.1. Geneva: World Health Organization.
5. Newton PN, Rozendaal J, Green M, White NJ (2002) Murder by fake drugs -Time for international action. BMJ 324: 800-801.
6. Saywell T, McManus J (2002, febrero 21) What’s in that pill? Far East Econ Rev 34-40.
7. Newton PN, Proux S, Green M, Smithuis F, Rozendaal J, et al. (2001) Fake artesunate in southeast Asia. Lancet 357: 1948-1950.
8. Cockburn R (1989, abril 18) Warnings delayed over fake asthma inhalers. The Times. (London): 8.
9. (2001, septiembre 4-10) Bad medicine. Tempo. (Jakarta): issue 52.
10. Crampton T (2003, agosto 25) Fake malaria pills haunt Asians. International Herald Tribune 1.
11. Chakravarty S, Unnithan S, Ram A (2001, enero 29) Deadly doses. India Today. 58-61.
12. Fackler M (2002, julio 29) China’s fake drugs kill thousands. San Francisco Examiner.
13. Cockburn R (1982, diciembre 10) Counterfeit drugs -The other killer in Lebanon. The Guardian. (London): 18.
14. Cockburn R (1984, junio 29) Counterfeit drugs that are kill rather than cure. Guardian. (London): 20.
15. World Health Organization (2001) Counterfeit drug reports: 1999 – October 2000 [tabla]. Disponible en: www.who.int/medicines/library/pnewslet/pn300cfd.html . Acceso el 17 de junio de 2003.
16. Rago L (2002) Counterfeit drugs: Threat to public health [presentation]. First Global Forum on Pharmaceutical Anticounterfeiting; 2002 September 22-25 Geneva, Switzerland.
17. Gibson L (2004) Drug regulators study global treaty to tackle counterfeit drugs. BMJ 328: 486. Asequible “online”
18. (2003, octubre 1) Lok Ayukta indicts former Karnataka DC and two senior officials, recommend dismissal from service. Mumbai (India): Pharmabiz.
19. (1989, noviembre 29) More UK debate on counterfeits. Scrip 1468: 3. Asequible “online”.
20. World Health Organization Department of Essential Drugs and Other Medicines (1999) Counterfeit drugs: Guidelines for the development of measures to combat counterfeit drugs. Geneva: World Health Organization. Disponible en: whqlibdoc.who.int/hq/1999/WHO_EDM_QSM_99.1.pdf. Acceso el 18 de febrero de 2005.
21. Moken MC (2003) Fake pharmaceuticals: How they and relevant legislation or lack thereof contribute to consistently high and increasing drug prices. Am J Law Med 29: 525-542. Asequible “online”
22. Reidenberg MM, Conner BA (2001) Counterfeit and substandard drugs. Clin Pharmacol Ther 69: 189-193. Asequible “online”
23. Csillag C (1998) Epidemic of counterfeit drugs causes concern in Brazil. Lancet 352: 553. Asequible “online”
24. Broussard P (1996, octubre 26) Du Nigeria au Niger, d’étranges vaccins contre la méningite. Le Monde.
25. Hay SI, Guerra CA, Tatem AJ, Noor AM, Snow RW (2004) The global distribution and population at risk of malaria: Past, present, and future. Lancet Infect Dis 4: 327-336. Asequible “online”
26. Chryss J producer (2004) Transcript of “File on 4”: Counterfeit drugs [transcript of radio program]. Program number 04VY3040LHO. London: British Broadcasting Corporation. Available: news.bbc.co.uk/nol/shared/bsp/hi/pdfs/fileon4_05102004_ counterfeitdrugs.pdf. Acceso el 9 de febrero de 2005.
27. Wolff JC, Thomson LA, Eckers C (2003) Identification of the ‘wrong’ active pharmaceutical ingredient in a counterfeit Halfan drug product using accurate mass electrospray ionisation mass spectrometry, accurate mass tandem mass spectrometry and liquid chromatography/mass spectrometry. Rapid Comm Mass Spectrom 17: 215-221. Asequible “online”
28. Nigerian National Agency for Food and Drug Administration and Control (2002, junio) List of identified fake products [June 2002]. NAFDAC ref 20-12. Abuja (Nigeria): Nigerian National Agency for Food and Drug Administration and Control.
29. (2003, abril 7) GlaxoSmithKline case study. Judicial Protection of IPR in China. Disponible en: www.chinaiprlaw.com/english/news/news14.htm. Acceso el 22 de febrero de 2005.
30. Dunea G (1983) Death over the counter. BMJ 286: 211-212. Asequible “online”.
31. Schwab D (2003, septiembre 21) Protecting Procrit. Sunday Star-Ledger 1, 8, 9.
32. James JS (2001, mayo 31) Counterfeit drugs: Check Combivir, Serostim, Epogen. AIDS Treat News Disponible en: www.aegis.com/pubs/atn/2002/ATN38003.html. Acceso el 2 de febrero de 2005.
33.Charatan F (2001) Fake prescription drugs are flooding the United States. BMJ 322: 1443. Asequible “online”.
34.US Food and Drug Administration (2003, abril 22) FDA commends drug industry commitment to report counterfeit drugs. Disponible en: www.fda.gov/bbs/topics/NEWS/2003/NEW00894.html. Acceso el 23 de noviembre de 2004.
35. (2003) Who will take responsibility for corporate killing? Lancet 361: 1921. Asequible “online”.
36. Morris M (2002, diciembre 6) Pharmacist gets 30 years for diluting medicines. Kansas City Star, Sect A 1.
37. Margolies D (2037. 03, febrero 9) Payments set for Courtney victims. Kansas City Star, Sect A 1.
38. UK Civil Aviation Authority (2001, octubre 29) The problem of bogus parts. Airworthiness Notice number 19. London: UK Civil Aviation Authority. Disponible en: www.caa.co.uk/docs/33/CAP455.PDF. Acceso el 19 de noviembre de 2003.
39. Dondorp AM, Newton PN, Mayxay M, Van Damme W, Smithuis FM, et al. (2004) Fake antimalarials in Southeast Asia are a major impediment to malaria control: Multinational cross-sectional survey on the prevalence of fake antimalarials. Trop Med Int Health 9: 1241-1246. Asequible “online”.
40.Yardley J (2004, mayo 5) Infants in Chinese city starve on protein-short formula. New York Times, Sect A 3 (col 1).
41. Rudolf PMM, Bernstein IBG (2004) Counterfeit drugs. N Engl J Med 350: 1384-1386. Asequible “online”.
42.Raufu A (2003) India agrees to help Nigeria tackle the import of fake drugs. BMJ 326: 1234. Asequible “online”.
43. (1995) Fake drugs: A scourge of the system. WHO Drug Inf 9: 127-129. Asequible “online”.
44. Hanif M, Mobarak MR, Ronan A, Rahman D, Donovan J, et al. (1995) Fatal renal failure caused by diethylene glycol in paracetamol exlixir: The Bangladesh epidemic. BMJ 311: 88-91. Asequible “online”.
45. O’Brien KL, Selanikio JD, Hecdivert C, Placide MF, Louis M, et al. (1998) Epidemic of pediatric deaths from acute renal failure caused by diethylene glycol poisoning. JAMA 279: 1175-1180. Asequible “online”.
46. Ahmad K (2004) Antidepressants are sold as antiretrovirals in DR Congo. Lancet 363: 713. Asequible “online”
47. (2005, enero) Warning: At least seven types of fake artesunate are being sold in mainland SE Asia. Wellcome Trust SE Asian Tropical Medicine Research Units. Disponible en: www.jr2.ox.ac.uk/ndm/Tropical_Medicine/News.htm. Acceso el 22 de febrero de 2005.
Figura 1. El número de investigaciones de posibles falsificaciones de medicamentos efectuadas por la FDA ha ido en aumento
(Figura: Margaret Shear, Public Library of Science, adaptada de [39])
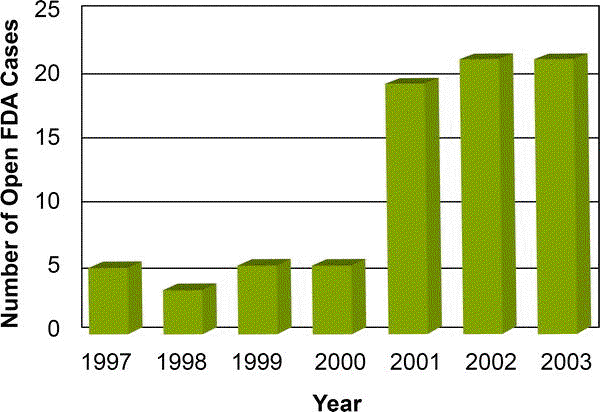
Figura 2. Hologramas del envase de artesunato Guilin Pharma genuino y falsificado encontrado en el sudeste asiático continental

(A) El holograma genuino está adherido a los envases del legítimo artesunato Guilin Pharma. La flecha roja señala una leyenda que dice “GUILIN PHARMA”, “que es visible al ojo desnudo como una fina faja debajo de las ondas y que sólo puede ser leída con un microscopio (las letras son de aproximadamente 0,1 mm de alto).
(B) Un holograma falsificado del envase de artesunato: el círculo rojo superior muestra que el holograma tiene mediaslunas, en vez de una línea pálida continua, entre las montañas y las ondas, y el círculo inferior muestra que no existe la leyenda “GUILIN PHARMA”.
(C) También es un holograma de un evase falsificado de artesunato: el círculo rojo indica que la leyenda “GUILIN PHARMA” está presente pero las letras corresponden a un tamaño de fuente mucho más grande que la del holograma genuino y puede ser leída a simple vista (las letras tienen aproximadamente 0,3 mm de alto). Una hoja de advertencia con más detalles y fotografías está disponible en [47].
(Fotos: Paul Newton, Wellcome Trust SE Asian Tropical Medicine Research Units)