En diciembre de 2020, la agencia reguladora de medicamentos de EE UU (FDA) concedió la autorización de uso en emergencia a la vacuna de ARNm Covid-19 de Pfizer con datos limitados de los ensayos de fase III.
En medio de la urgencia de la pandemia, se revisaron los datos de los ensayos más rápidamente de lo habitual. La FDA hizo en 108 días lo que normalmente le toma una media de 10 meses.
Inmediatamente, surgieron dudas sobre la rapidez con la que la agencia tomó su decisión.
En agosto de 2021, la FDA concedió la aprobación total a la vacuna de ARNm de Pfizer (Comirnaty), sin hacer público el conjunto de datos para que se pueda hacer un escrutinio independiente.
Los expertos se preocuparon porque toda la información disponible públicamente sobre un medicamento autorizado provenía de artículos de revistas, comunicados de prensa y evaluaciones de las agencias reguladoras, todo lo cual está sujeto a conflictos de intereses y sesgos.
Los científicos se movilizan por la transparencia
Un grupo de más de 80 funcionarios de salud pública e investigadores médicos formaron una alianza para tratar de obtener y difundir los datos que la FDA revisó para autorizar la vacuna de Pfizer.
El grupo sin ánimo de lucro, denominado Profesionales de la Salud Pública y la Medicina por la Transparencia (PHMPT), presentó una demanda ante el Tribunal de Distrito de Estados Unidos, en Fort Worth, Texas, en septiembre de 2021. El Dr. Aaron Kheriaty, es uno de los miembros que lidera la petición.
“A un grupo de nosotros nos preocupaba el diseño del ensayo, su corta duración y el sistema desorganizado de vigilancia de los eventos adversos durante el periodo de post-cormecialización “, dijo el Dr. Kheriaty.
Por ejemplo, a Pfizer se le permitió eliminar su grupo de control después de sólo dos meses. “El grupo de placebo se eliminó básicamente porque la vacuna se ofreció a todos los que habían recibido el placebo, por lo que no pudieron mantener un grupo de control”, dijo el Dr. Kheriaty.
La demanda de la Ley de Libertad de Información (FOIA) estipulaba que, según la ley federal, los datos y la información de los documentos presentados ante la FDA debían ponerse a disposición del público, excepto en circunstancias extraordinarias.
El objetivo era garantizar la transparencia y la rendición de cuentas por parte del gobierno.
El profesor Tom Jefferson es otro de los miembros del PHMPT y del Grupo de Trabajo de Investigación sobre Prevención y Control de Infecciones Covid-19 de la OMS. Según él, no se puede exagerar la importancia de hacer una revisión independiente de los datos científicos.
“La censura y la falta de transparencia siempre han sido los enemigos del progreso. En el caso de las vacunas Covid-19, la importancia de la transparencia se ve acentuada por su administración masiva a poblaciones sanas y sus desconocidos efectos a largo plazo”, afirma el profesor Jefferson.
“Dado que los ensayos clínicos fueron insuficientes y se hicieron de forma apresurada, y la cultura del secreto, es discutible que el consentimiento informado sea válido, antes que se publiquen todos los documentos que la FDA tiene en su poder”, añadió.
La vacuna de Pfizer ha sido objeto de un intenso debate, se ha afirmado que no se han notificado los efectos adversos, que se han falsificado los datos y que no es eficaz.
La FDA pide retrasar la publicación de documentos
Aunque la FDA dice que está comprometida con la transparencia, la agencia propone hacer públicos los documentos de Pfizer a lo largo de varias décadas.
Los abogados del Departamento de Justicia (DOJ) que representan a la FDA pidieron al juez federal que les diera 75 años para procesar la solicitud de los documentos a través de la ley de acceso a la información (FOIA), por lo que no tendríamos acceso a todos los documentos hasta 2096.
Argumentaron que la publicación inmediata de 451.000 páginas de documentos sería demasiado onerosa porque la agencia no tiene suficiente personal y que sólo podría publicar 500 páginas al mes, porque tiene que editar (redactar) lo que no hay obligación de compartir con el público, como los secretos comerciales.
“La idea de que la FDA, con 18.000 empleados y un presupuesto de US$6.500 millones no pueda producir los documentos de forma más rápida es absurda”, afirma Aaron Siri, abogado estadounidense que representa a PHMPT, el demandante.
“La FDA no ha dicho que no deba presentar estos documentos”, dijo el Sr. Siri, “sino que propone hacerlo a un ritmo tan lento que los documentos no estarán completamente disponibles hasta que casi todos los científicos, abogados y la mayoría de los estadounidenses que recibieron el producto de Pfizer, hayan muerto.”
En su refutación, la FDA dijo que no es razonable esperar que satisfagan las demandas porque sólo tiene 10 empleados que procesan las solicitudes FOIA. El Sr. Siri dice que eso no es excusa: “Hay muchas otras agencias que, cuando tienen que responder de forma rápida, transfieren o contratan más personal, para cumplir rápidamente con sus obligaciones legales”.
De hecho, la respuesta del DOJ a la corte, admitió que desde 2018, la FDA ha respondido a las citaciones federales, con plazos rápidos incluso cuando han tenido que entregar cientos de miles de páginas cada vez que responden a una solicitud.
¿Qué mostró la liberación inicial de documentos?
La FDA ya ha liberado un lote de los documentos de Pfizer.
El Dr. Kheriaty dijo que los medios de comunicación dieron mucho bombo al significado de los documentos, pero que todavía falta mucha información y, por tanto, es prudente no hacer muchas interpretaciones.
Por ejemplo, se afirmó que los documentos mostraban que 1.223 personas habían muerto a causa de la vacuna, en los primeros 90 días de su aplicación, pero la realidad es más matizada.
“Básicamente, sólo tenemos cifras en bruto. Si se mira ese documento, se redactó la información sobre cuántas dosis de Pfizer se habían enviado. Por lo tanto, si no sabemos cuántas dosis totales se administraron, no podemos establecer qué porcentaje de personas que recibieron la vacuna podrían haber tenido esos efectos adversos”, explicó el Dr. Kheriaty, pero el número de muertes “notificadas” en las primeras fases de la distribución de la vacuna sí que le pareció “elevado y debe tomarse como una señal de seguridad importante”.
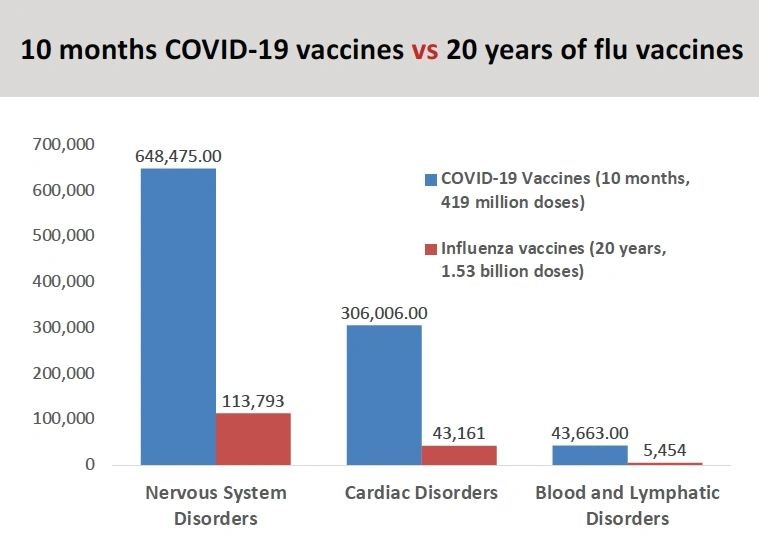
“Si se observan los efectos adversos de las vacunas covid que se han notificado en comparación con la vacuna contra la gripe en los últimos 20 años, hemos visto un número de órdenes de magnitud mayor de efectos adversos, incluidas las muertes, notificadas”. (ver gráfico)
Además, señaló el apéndice de uno de los documentos de Pfizer (página 30) que enumeraba nueve páginas de acontecimientos adversos notificados.
Aunque no se puede inferir la causalidad, el Dr. Kheriaty sugirió que hay algunas señales preocupantes en la lista. “Veo muchos problemas neurológicos y veo muchos problemas autoinmunes”, dijo.
“Si se mira la hoja informativa que se entrega a las personas que reciben la vacuna de Pfizer, se enumeran algo así como 21 posibles efectos secundarios que surgieron durante el ensayo, la mayoría de ellos benignos. En cambio, los acontecimientos adversos notificados en esos primeros 90 días de vigilancia posterior a su comercialización son muy preocupantes.”
Hasta que no se publique la totalidad de los datos, no se podrá hacer una evaluación definitiva.
El profesor Jefferson tiene una opinión similar.
Es probable que los documentos que Pfizer entregó a la FDA sigan una estructura estándar internacional, denominada Documento Técnico Común (CTD), que consta de cinco módulos.
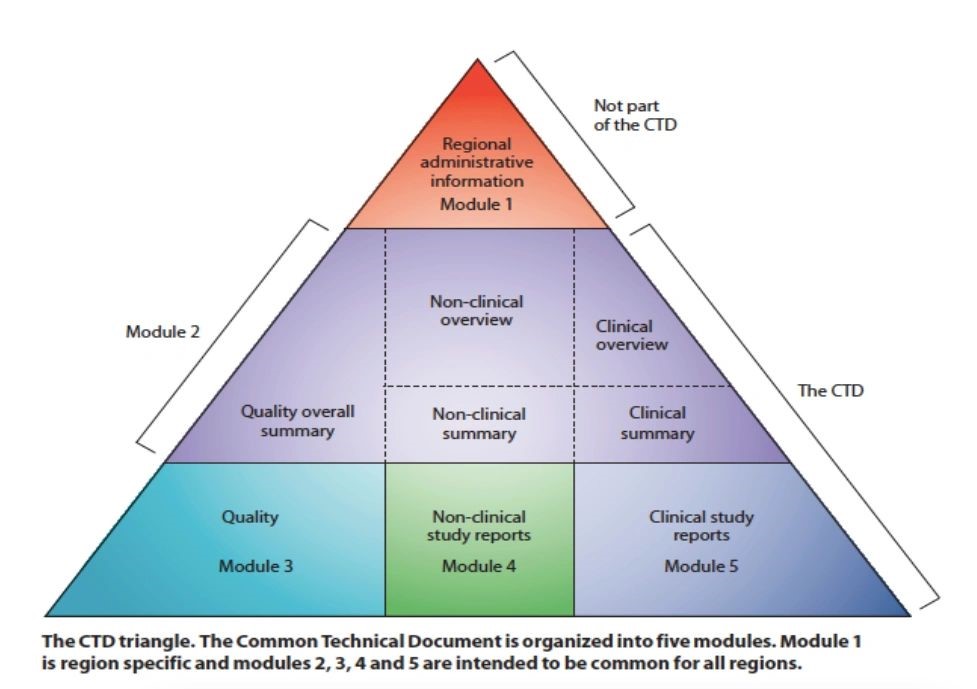
“La publicación parcial, incompleta o por lotes de partes del DTC impide evaluar la solicitud de forma coherente y puede dar lugar a errores en la interpretación de su contenido”, afirma el profesor Jefferson.
La publicación de los módulos fuera de secuencia -que es lo que está haciendo ahora la FDA- adulterará el análisis. “La falta de un solo conjunto de datos podría corromper cualquier análisis de los científicos que pretendan realizar una revisión adecuada de los datos de Pfizer, por eso deberían publicarse todos inmediatamente”, afirma.
¿Y ahora qué?
Aunque la FDA ya ha publicado un lote de documentos de Pfizer, el Sr. Siri dice que el juez todavía tiene que decidir cómo debe proceder la FDA. “Todavía no se ha dictado ninguna decisión en este caso y todos los documentos presentados hasta la fecha han sido entregados por la FDA aparentemente con la esperanza de suavizar cualquier decisión que pueda dictar el Tribunal”, afirma.
La decisión final del juez sobre el plazo en el que la FDA debe hacer públicos sus documentos podría determinarse dentro de unas semanas, a menos que se aplace la vista.