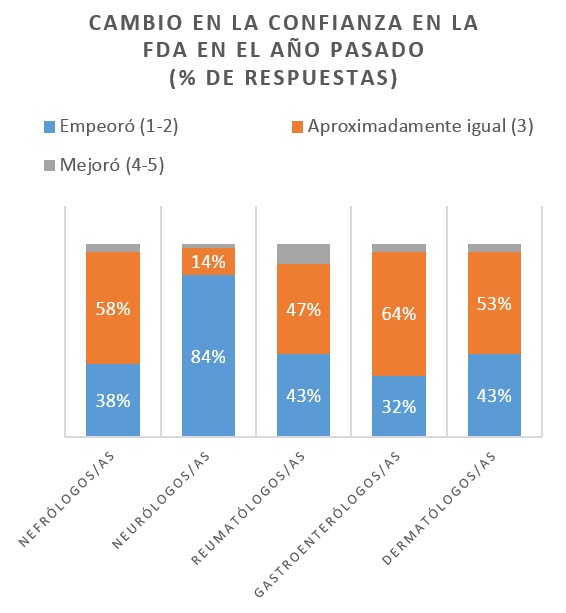
Según una encuesta reciente de Spherix Global Insights, la confianza de los médicos en la FDA está cayendo en picado. Más del 40% de los 252 médicos encuestados dijeron que su confianza en la FDA ha disminuido durante el último año. Los médicos encuestados eran nefrólogos, neurólogos, dermatólogos, reumatólogos y gastroenterólogos [1, 2].
La queja más importante es que la FDA ha sido errática al tomar decisiones. En el pasado, si los ensayos clínicos mostraban que el medicamento había alcanzado los criterios de efectividad establecidos, la FDA estaba de acuerdo con el diseño de los estudios y no había ningún resultado alarmante, se podía anticipar que la FDA autorizaría su comercialización. LA crisis de confianza está liderada por los nefrólogos y neurólogos desconcertados por la aprobación del fármaco para el Alzheimer (Adulhem), a pesar del decisivo voto negativo de un comité asesor de expertos y el sorpresivo rechazo del tenapanor de Ardelyx en la enfermedad renal crónica [2].
El 82% de los neurólogos no estuvo de acuerdo con la aprobación de Adulhem, y cuestionaron el sorpresivo rechazo al Nuplazid para tratar las alucinaciones en la psicosis relacionada con la demencia [3].
Otras decisiones que han generado desconcierto son las relacionadas con los inhibidores de la JAK. En agosto pasado, la FDA rechazó filgotinib de Gilead para tratar la artritis reumatoide. Rinvoq de AbbVie, Eli Lilly, Olumiant de Incyte, y abrocitinib de Pfizer están esperando a que la FDA termine el análisis de un estudio de seguridad post comercialización de Xeljanz. Los reumatólogos y dermatólogos están de acuerdo en que está bien escudriñar a la clase, pero cuestionan por qué la FDA está reteniendo tres medicamentos JAK en la dermatitis atópica, además de las solicitudes de Rinvoq y Xeljanz en reumatología [2].
Por otra parte, no se ha encontrado evidencia de que el número de aprobaciones y/o rechazos de la FDA haya cambiado [2], aunque si se ha publicado otro estudio destacando la falta de memoria histórica de la agencia y la dispersión en la toma de decisiones.
Un estudio financiado por la FDA y publicado en Annals of Internal Medicine analizó las decisiones la FDA que tomó al revisar las 912 solicitudes de comercialización que se presentaron entre 2013-2018 [4]. De ellas, 117 se sometieron a múltiples ciclos de revisión, y 22 se analizaron más detalladamente “por cuestiones relacionadas con la eficacia clínica”. A continuación, recogemos algunos puntos importantes que destacó Medpage de lo que sucedió con estos 22 productos [5].
Los rechazos iniciales se debieron a una serie de problemas que los autores agruparon en 12 categorías diferentes: uso de criterios de valoración inapropiados; estudios con dosis diferentes; estudios con muy pocos pacientes; un análisis estadístico deficiente; y la afirmación de no inferioridad basada en márgenes excesivamente amplios.
En 15 de los 22 casos con problemas de eficacia, los fabricantes aportaron datos adicionales, a veces procedentes de estudios pivotales completamente nuevos. Pero no fue así en el caso de los otros siete, que solo requirieron presentar nuevos análisis de datos.
En ocho casos, los productos que se aprobaron finalmente sin documentar la resolución de todos los problemas identificados en los rechazos iniciales fueron:
Estas solicitudes presentaban inicialmente deficiencias en hasta siete categorías distintas.
Janiaud y sus colegas analizaron una de ellas en detalle: las cápsulas de droxidopa, para las que el fabricante, Chelsea Therapeutics, presentó su primera solicitud en 2011 y fue aprobada en 2014. Los funcionarios de la FDA identificaron varios problemas, entre ellos que el criterio de valoración final en el estudio pivotal inicial no era el que se había acordado originalmente, que la magnitud del efecto sobre el criterio de valoración elegido era solo de “importancia clínica marginal”, y que incluso ese efecto no demostró durar más de una semana.
El Chelsea presentó un estudio pivotal adicional, pero cambió el criterio de valoración principal a mitad de camino, y el personal de la FDA determinó que el beneficio del tratamiento era marginal. Sin embargo, un comité consultivo se mostró favorable a la aprobación en gran medida por los “testimonios de los pacientes”, y el director de la oficina correspondiente de la FDA aprobó el fármaco porque la solicitud se presentó a través de la vía de aprobación acelerada, según la cual un producto puede recibir el visto bueno si los datos indican que el beneficio clínico es “razonablemente probable”.
Esa concepto – “razonablemente probable”- también se citó en la decisión sobre el aducanumab. En ese caso, según Janiaud y sus colegas, la FDA podría haber establecido la conexión con la aprobación de la droxidopa como un precedente relevante. El hecho de que no lo hiciera indica un problema mayor de la agencia: que “cada decisión [en los casos analizados] invocaba un razonamiento a medida”, a menudo sin hacer el más mínimo esfuerzo para demostrar que hay coherencia en la forma como se aplican las normas.
En estos ocho casos, “Ningún memorando de decisión hizo referencia al razonamiento utilizado en otras aprobaciones, lo que significa que la FDA no tiene una tradición o estructura que garantice la coherencia en sus decisiones”, escribió el grupo.
Y la razón de esto, continuaron, es que la agencia no tiene forma de identificar posibles precedentes, aunque quisiera. “La base de datos electrónica de la FDA está en gran medida desestructurada, y se tarda horas o días en leer la documentación de los casos. Es muy difícil encontrar casos relacionados, lo que requiere que se resuman y codifiquen las características de los ensayos y las incertidumbres, como en las tablas y figuras” que Janiaud y sus colegas aportaron en su artículo [4].
Otro problema, según el grupo, es lo que denominaron la “balcanización” de la FDA, con centros separados y divisiones dentro de los centros que, en gran medida, funcionan como feudos independientes. En varios de los 22 casos analizados en el estudio, los patrocinadores de medicamentos volvieron a presentar sus solicitudes a una división diferente. “Múltiples líderes del personal de la FDA y colaboradores confirmaron que la FDA tiene estructuras débiles para apoyar la memoria institucional”, escribieron los autores.
Esta falta de preocupación por los precedentes podría haber ayudado a que el aducanumab obtuviera la aprobación: los funcionarios no tuvieron que considerar que su justificación ad hoc podría influir en futuras revisiones del producto.
Janiaud y sus colegas reconocieron que su análisis tenía una importante limitación, y es que se basaba en los paquetes de aprobación de medicamentos disponibles en la FDA, que no incluyen las comunicaciones literales entre la agencia y los solicitantes, ni los detalles completos de las deliberaciones internas de la agencia.
Referencias