Corresponde al Appendix 4 del documento de la GAO. covid-19: Additional Actions Needed to Improve Accountability and Program Effectiveness of Federal Response. Report to Congressional Committees. GAO-22-105051 https://files.gao.gov/reports/GAO-22-105051/index.html
Antecedentes
La supervisión que realiza la FDA de las plantas de manufactura es clave para la estrategia de la agencia para garantizar la calidad de fabricación de las vacunas, incluyendo las utilizadas para prevenir el covid-19.
La FDA generalmente autoriza la comercialización de las vacunas en EE UU mediante la aprobación de una solicitud de licencia de un biológico (BLA). Las BLA contienen la información que respalda la solicitud, incluyendo los datos de los estudios no clínicos y los estudios clínicos sobre la seguridad y la eficacia del producto, así como los datos y la información sobre la fabricación. Según la FDA, parte de la revisión de cada BLA consiste en evaluar los procesos de fabricación, los establecimientos implicados en la fabricación y la calidad y consistencia del producto.
La FDA también inspecciona las plantas de manufactura de vacunas, como parte del proceso de revisión de la BLA o después de que el producto esté autorizado para el mercado estadounidense. Estas inspecciones incluyen visitas oficiales a los establecimientos para determinar el cumplimiento de la ley y la normativa aplicable. Las inspecciones pueden resultar en observaciones escritas que se entregan a cada fabricante y una clasificación de la inspección, que se basa en la evaluación de la gravedad de las observaciones que se han documentado durante la inspección. Según la FDA, en aproximadamente el 20% de los casos se requieren inspecciones previas a la concesión de licencias y a la aprobación, normalmente en los casos en los que un establecimiento tiene un historial de problemas de cumplimiento o cuando la FDA no ha inspeccionado previamente el establecimiento [66].
En determinadas circunstancias, como en el caso de la pandemia de covid-19, la FDA puede permitir temporalmente el uso de un producto sin licencia a través de una autorización de uso de emergencia (AUE), siempre que se cumplan ciertos criterios legales [67]. Por ejemplo, la FDA puede emitir una AUE si es razonable creer que el producto puede ser eficaz y los beneficios conocidos y potenciales del producto superan los riesgos conocidos y potenciales. Las guías de la FDA indican que las empresas que solicitan AUEs deben proporcionar información sobre los procesos de fabricación y sobre los controles a los establecimientos que participan en la fabricación. La FDA puede llevar a cabo inspecciones de los establecimientos de fabricación antes de emitir una AUE, pero los criterios legales para las AUEs no exigen que la FDA realice dichas inspecciones antes de su emisión. La guía de la FDA para las vacunas covid-19 establece que se espera que cualquier empresa de vacunas que reciba inicialmente una AUE realice más investigaciones y siga trabajando para presentar una BLA lo antes posible.
Resumen de las cuestiones clave
Para ayudar a garantizar la calidad de la fabricación de las vacunas covid-19 autorizadas para uso de emergencia, la FDA revisó la documentación y realizó revisiones in situ. En agosto de 2021, la FDA había autorizado tres vacunas covid-19 (Pfizer, Moderna y Janssen) para uso de emergencia, y una de estas vacunas (Pfizer) también había recibido la autorización convencional [68] Para evaluar cada uno de los 18 establecimientos que fabricaban estas vacunas covid-19, la FDA tomó una serie de medidas, incluyendo la revisión de los documentos que entregaron las empresas productoras como parte de sus solicitudes de AUE y revisando los informes de inspecciones previas [69].
Documentación entregada en las solicitudes de AUE. Según la FDA, la agencia revisó la documentación y los datos que cada una de las empresas de vacunas covid-19 incluyó en sus solicitudes de AUE sobre los establecimientos utilizados en la fabricación de las vacunas. Ejemplos de información clave sobre la fabricación que la FDA revisó fueron
La documentación de las inspecciones previas de la FDA. En el caso de la revisión de las AUE, la FDA no estaba obligada a realizar inspecciones que analizaran específicamente la fabricación de la vacuna covid-19 en ninguno de los establecimientos antes de autorizar las tres vacunas para uso de emergencia, y no lo hizo [71]. Sin embargo, la FDA revisó la historia de inspección de los establecimientos.
Nuestra revisión encontró que, desde octubre de 2011 hasta la fecha en que se presentó a la agencia la solicitud inicial de AUE para la vacuna covid-19, 14 de los 18 establecimientos que fabrican vacunas covid-19 habían sido inspeccionados previamente al menos una vez por la FDA [72]. Esto representa un total de 90 inspecciones. Los 14 establecimientos, excepto uno, habían recibido la inspección más reciente en los últimos 4 años. (Ver figura.)
Establecimientos que fabrican vacunas covid-19, fecha de la inspección de la FDA más reciente antes de la solicitud inicial (AUE) y el tipo de fabricación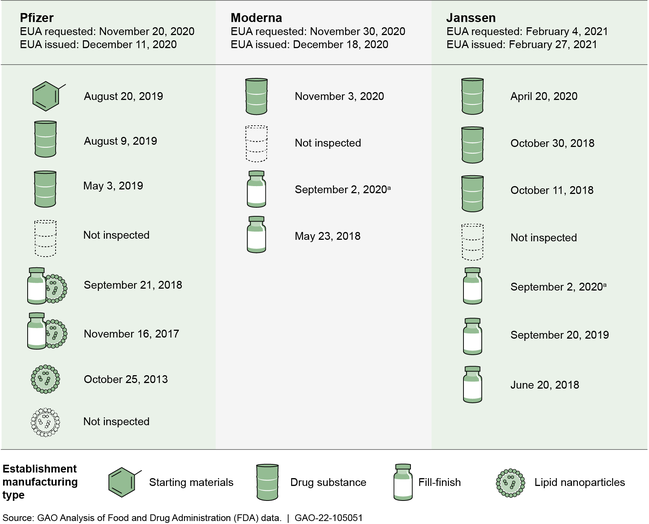
Notas: Cada icono o grupo de iconos es un establecimiento identificado por las empresas de vacunas como fabricante de las vacunas covid-19 para el mercado estadounidense a partir del 30 de junio de 2021. Excluimos los establecimientos que en junio de 2021no se utilizaban en el proceso de fabricación, así como los que se utilizaban para el envasado, el almacenamiento y el trabajo de laboratorio. Los datos corresponden a las inspecciones de establecimientos biológicos y de medicamentos realizadas desde octubre de 2011 hasta la fecha en que cada empresa de vacunas solicitó inicialmente una AUE. La FDA modificó posteriormente las AUE de las vacunas de Pfizer y Moderna para ampliar su uso, por ejemplo, para diferentes grupos de edad o pacientes con determinadas afecciones. La sustancia farmacológica se refiere a las cantidades a granel de la sustancia activa no formulada y el llenado-acabado se refiere a la transferencia de la vacuna en envases estériles. Las nanopartículas lipídicas se añaden a la sustancia farmacológica para estabilizar el ARNm. (a) Este establecimiento fabrica las vacunas de Moderna y Janssen.
La FDA clasifica las inspecciones en función de la gravedad de las deficiencias identificadas durante las mismas. La FDA clasificó las 90 inspecciones previas de estos establecimientos, realizadas antes de las solicitudes iniciales de la AUE, de la siguiente manera:
Otras fuentes de información. Según sea necesario, además de revisar las solicitudes de AUE y los documentos de inspecciones previas, la FDA también utilizó varias otras fuentes de información, incluyendo las revisiones in situ, las solicitudes de registros, los informes de los reguladores extranjeros y las inspecciones para recopilar más información sobre los establecimientos que fabrican las vacunas covid-19 y evaluarlos. La FDA utilizó algunas de estas fuentes antes de emitir las AUE iniciales, así como después.
En agosto de 2021, la FDA había hecho cinco investigaciones y tres visitas in situ para evaluar la calidad de fabricación de las vacunas covid-19 en tres establecimientos. Por ejemplo, la FDA realizó una visita al sitio antes de emitir una AUE en un establecimiento que no había sido inspeccionado por la FDA en los últimos 9 años.
Una de estas seis inspecciones fue para un establecimiento contratado por Janssen (Emergent) en abril de 2021. Este establecimiento había sido inspeccionado previamente en abril de 2020 y la FDA indicó que había encontrado graves deficiencias. La inspección de abril de 2021 se produjo a raíz de un informe de contaminación con una sustancia farmacológica para otra vacuna covid-19 que no estaba autorizada en EE UU (AstraZeneca) [78]. Esta inspección identificó múltiples deficiencias graves relacionadas con los sistemas de control de calidad de la fabricación, el diseño del edificio, el equipo y la formación del personal. Tras la inspección de abril de 2021, se detuvo la fabricación de nuevos lotes de la sustancia farmacológica para la vacuna de Janssen en el establecimiento y la distribución de los lotes existentes. También se interrumpió la fabricación de la vacuna de AstraZeneca. Posteriormente, Emergent presentó un plan de acción correctiva y trabajó con la FDA para corregir las deficiencias. En julio de 2021, la FDA informó a Emergent de que no se oponía a reanudar la fabricación de la vacuna covid-19 de Janssen en el establecimiento de Emergent, según los funcionarios de la FDA.
La FDA analizó la calidad de fabricación de las otras tres vacunas covid-19 que no han recibido la AUE ni la autorización convencional. En agosto de 2021, otras tres empresas de vacunas (AstraZeneca, Novavax y Sanofi/GSK) que también participaron en el Grupo de Aceleración de Contramedidas covid-19 del HHS-DOD (HHS-DOD covid-19 Countermeasures Acceleration Group anteriormente conocido como Operación Warp Speed) no habían solicitado AUE ni presentado BLAs [79]. Los funcionarios de la FDA nos dijeron que han estado analizando la calidad de fabricación de los establecimientos que fabrican estas vacunas como parte del proceso de ensayo clínico.
La FDA utilizó información de inspecciones previas de la FDA y la complementó con información de revisiones e inspecciones in situ, según fuera necesario, para los 13 establecimientos que fabrican estas vacunas [80].
Historial de inspecciones. Al analizar la historia de las inspecciones de la FDA a estos establecimientos, descubrimos que desde octubre de 2011 hasta mayo de 2021, la FDA había inspeccionado previamente 11 de los 13 establecimientos que fabricaban estas vacunas covid-19 [81]. Hicieron un total de 73 inspecciones. Todos los establecimientos que habían sido inspeccionados lo fueron en los últimos 3 años (Ver figura).
Establecimientos que fabrican las vacunas covid-19 sin AUE o licencia, por fecha de inspección de la FDA más recientes y tipo de fabricación, mayo de 2021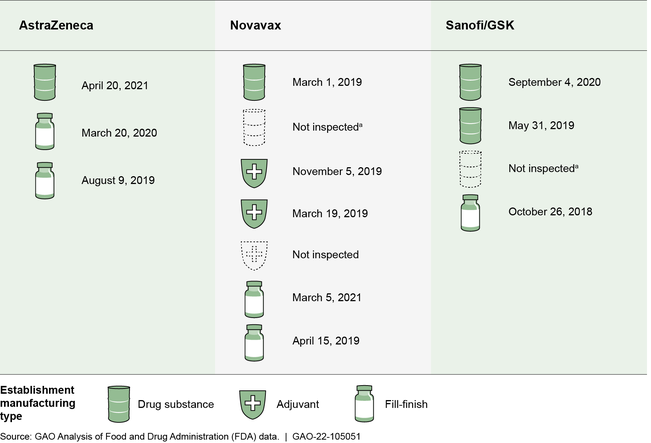
Notas: Cada icono o grupo de iconos es un establecimiento identificado por las empresas de vacunas como fabricante de las vacunas covid-19 para el mercado estadounidense hasta el 30 de junio de 2021. Excluimos los establecimientos que en junio de 2021 no se utilizaban en el proceso de fabricación, así como los utilizados para el envasado, el almacenamiento y el trabajo de laboratorio. Los datos corresponden a las inspecciones de establecimientos que producen productos biológicos realizadas desde octubre de 2011 hasta el 26 de mayo de 2021, y a las inspecciones de establecimientos de medicamentos realizadas desde octubre de 2011 hasta el 29 de abril de 2021. En agosto de 2021, AstraZeneca, Novavax y Sanofi/GSK no habían solicitado AUE ni habían presentado solicitudes de licencia biológica (BLA) para sus vacunas covid-19. Los funcionarios de la FDA nos dijeron que han estado analizando la calidad de fabricación de los establecimientos que fabrican estas vacunas como parte del proceso de ensayo clínico. La sustancia farmacéutica (Drug Substance) se refiere a las cantidades a granel de la sustancia activa no formulada y el llenado-acabado (fill-finish) se refiere a la transferencia de la vacuna en envases estériles. Un adyuvante es un ingrediente utilizado en algunas vacunas que ayuda a crear una respuesta inmunitaria más fuerte en las personas que reciben la vacuna. (a) Este establecimiento fabrica tanto las vacunas de Novavax como las de Sanofi/GSK.
La FDA clasificó estas 73 inspecciones de la siguiente manera
Revisiones in situ. Hasta agosto de 2021, la FDA había realizado siete investigaciones AUE y dos visitas in situ a seis establecimientos que fabricaban estas vacunas. Por ejemplo, la FDA llevó a cabo una investigación AUE relacionada con una vacuna covid-19 en marzo de 2021 en un establecimiento que no había sido inspeccionado por la FDA en casi 10 años. Este establecimiento está contratado por la Universidad de Texas A&M, que es uno de los tres centros de la Autoridad de Investigación y Desarrollo Biomédico Avanzado del HHS destinados a desarrollar y fabricar contramedidas médicas para el gobierno federal.
Inspecciones. La FDA también informó que realizó inspecciones específicamente para las vacunas covid-19 en dos establecimientos en abril y julio de 2021.
Metodología
Para llevar a cabo este trabajo, obtuvimos información de las seis empresas de vacunas covid-19 que participan en el Grupo de Aceleración de Contramedidas covid-19 del HHS-DOD (HHS-DOD covid-19 Countermeasures Acceleration Group) sobre los establecimientos que participaban en la fabricación de sus vacunas para el mercado estadounidense en junio de 2021. Utilizamos esta información en nuestro análisis de las inspecciones de la FDA utilizando el Sistema de Seguimiento de Cumplimiento y Realizaciones de Campo de la agencia (Field Accomplishments and Compliance Tracking System). En concreto, revisamos los datos de la FDA sobre las inspecciones de vacunas y otros productos biológicos realizadas entre el 1 de octubre de 2011 y el 26 de mayo de 2021 y los datos sobre las inspecciones de medicamentos que se hicieron entre el 1 de octubre de 2011 y el 29 de abril de 2021. Analizamos los datos desde el 1 de octubre de 2011, para tener un rango lo suficientemente amplio como para captar las actividades de inspección a lo largo del tiempo. También revisamos guías y documentos de la agencia, así como las entrevistas y respuestas escritas de funcionarios de la FDA relacionadas con las actividades de supervisión de vacunas que hizo la agencia durante la pandemia de covid-19.
Para evaluar la fiabilidad de los datos, realizamos pruebas de datos electrónicos para detectar datos faltantes y valores atípicos, revisamos la documentación pertinente y obtuvimos información de funcionarios de la agencia con conocimiento de causa. Consideramos que los datos eran suficientemente fiables para nuestros fines.