Resumen ejecutivo
La Orden Ejecutiva 14036 del Presidente Biden, “La promoción de la competencia en la economía estadounidense” (la Orden Ejecutiva sobre la Competencia), señala a la falta de competencia como principal impulsor de los problemas en todos los sectores de la economía. Este informe presenta los principios para hacer una reforma equitativa de los precios de los medicamentos a través de la competencia, la innovación y la transparencia; describe abordajes legislativos prometedores; y resume las acciones que ya están en marcha o que está considerando el Departamento de Salud y Servicios Humanos. Durante la preparación del Informe, el secretario Xavier Becerra, otros funcionarios del HHS y el personal del HHS escucharon a los grupos que defienden a los consumidores, a personal de la Comisión Asesora de Pagos de Medicare (Medicare Payment Advisory Commission MedPAC), a expertos e investigadores independientes, y a partes interesadas de todo el sistema de atención médica.
Los estadounidenses gastan más de US$1.500 por persona en medicamentos de venta con receta y pagan precios muy superiores a los de cualquier país comparable. Los precios de los medicamentos de marca aumentan más rápidamente que la inflación. El costo de los medicamentos impide que muchos estadounidenses puedan consumirlos tal y como se les han recetado, con el consiguiente perjuicio para su atención médica y su salud. La falta de competencia es un factor clave en el elevado costo de los medicamentos.
El informe identifica tres principios rectores para la reforma de los precios de los medicamentos:
Apoyar decisiones legislativas audaces. El informe destaca posibles proyectos legislativos que el Congreso podría discutir para promover los principios descritos anteriormente, entre ellos:
Tácticas administrativas para lograrlo. También hay muchas herramientas administrativas que el HHS puede utilizar para promover la competencia y reducir los precios de los medicamentos con el propósito de avanzar en la implementación de los principios de la administración, incluyendo:
El objetivo general de la Administración Biden-Harris es fomentar la innovación, aumentar la competencia y mejorar las condiciones de mercado, todo ello para reducir el gasto en medicamentos de los consumidores y de todo el sistema de salud. Y lo que es más importante, estas acciones protegerán a los pacientes y mejorarán su acceso a medicamentos asequibles, contribuyendo a mantener a los estadounidenses más sanos y con mayor seguridad económica.
Resumen
La Orden Ejecutiva 14036 del Presidente Biden, “Promoviendo la competencia en la economía estadounidense” (la Orden Ejecutiva sobre la Competencia), señala a la falta de competencia como un impulsor clave de los problemas en todos los sectores de la economía [1]. Al igual que en los otros ámbitos de política que se abordan en la Orden Ejecutiva sobre la competencia, las soluciones a los elevados precios de los medicamentos de venta con receta pasan necesariamente por reestablecer o generar competencia. El presente informe (el informe) responde a la disposición contenida en la sección 5(p)(iv) de la Orden Ejecutiva sobre la competencia, según la cual el secretario de Salud y Servicios Humanos:
… presentará un informe al Asistente del Presidente para la Política Interior y Director del Consejo de Política Interior y al Presidente del Consejo de Competencia de la Casa Blanca, que incluya un plan para seguir esforzándose en luchar contra los precios excesivos de los medicamentos de venta con receta y mejorar las cadenas nacionales de suministro farmacéutico, para con ello reducir los precios que paga el Gobierno federal por dichos medicamentos, y abordar el problema recurrente de la especulación de precios [2].
Este informe presenta los principios para una reforma equitativa de los precios de los medicamentos a través de la competencia, la innovación y la transparencia; describe estrategias legislativas prometedoras y resume las acciones que ya están en curso o que se están considerando en el Departamento de Salud y Servicios Humanos (HHS).
Durante la preparación de este Informe, el Secretario Becerra, otros funcionarios y personal del HHS escucharon a los grupos que defienden los intereses de los consumidores, a los miembros de la Comisión Asesora de Pagos de Medicare (MedPAC), a expertos e investigadores independientes y a otras partes interesadas de todo el sistema de atención médica. Agradecemos a los participantes por su tiempo y por compartir con nosotros su compromiso con reducir los precios de los medicamentos para todos los estadounidenses. Hemos incorporado en este informe muchas de las ideas que nos aportaron.
Introducción
Los estadounidenses pagamos demasiado por los medicamentos de venta con receta. Pagamos los precios más altos del mundo, lo que conlleva mayores gastos. Este aumento del gasto provoca que los proveedores privados y gubernamentales tengan que aumentar las primas o a reducir las prestaciones. Las barreras financieras para acceder a los medicamentos de venta con receta y a otros servicios de salud conllevan peores resultados en salud.
En EE UU, los precios de los medicamentos son demasiado elevados porque hay múltiples factores que frenan la competencia. El sector de los medicamentos de venta con receta se caracteriza por múltiples fallas del mercado, como la ausencia de nuevos oferentes, la presencia de incentivos para la inflar los precios de lista con el fin de aumentar los reembolsos y las tarifas, las alzas de los precios de los genéricos que cuentan con un solo proveedor, el gasto en investigación y desarrollo de medicamentos “yo también” (me-toos) en lugar de tratamientos y curas innovadoras, y otros comportamientos monopolísticos u oligopolísticos. El sistema tampoco consigue reducir los precios debido a los abusos legales, como el pago por demora, las marañas de patentes, los saltos entre productos (Nota de Salud y Fármacos: producto hopping o salto de productos es una estrategia para impedir el uso de genéricos, en este caso las empresas sacan versiones ligeramente modificadas de los medicamentos que están a punto de perder la patente, estas versiones nuevas no añaden mucho pero logran captar una buena parte del mercado) y la explotación de las disposiciones de la Estrategia de Evaluación y Mitigación de Riesgos (REMS) [3].
Los pacientes de otros países comparables pagan por lo general mucho menos por los medicamentos de venta con receta que los estadounidenses. Los medicamentos de venta con receta cuestan en EE UU más del doble (son 2,56 veces más altos) que los de otros países miembros de la Organización para la Cooperación y el Desarrollo Económico (OCDE) (ver la Figura 1). Incluso teniendo en cuenta las rebajas y otros descuentos, EE UU paga al menos 1,9 veces más [4]. La diferencia de precios entre EE UU y otros países es aún mayor para algunos medicamentos críticos. Los precios de la insulina, por ejemplo, son unas cuatro veces más altos en EE UU que los de otros países comparables, incluso después de los descuentos [5].
Figura 1. Precios de los medicamentos de venta con receta en EE UU como porcentaje de los precios en otros países seleccionados, todos los medicamentos, 2018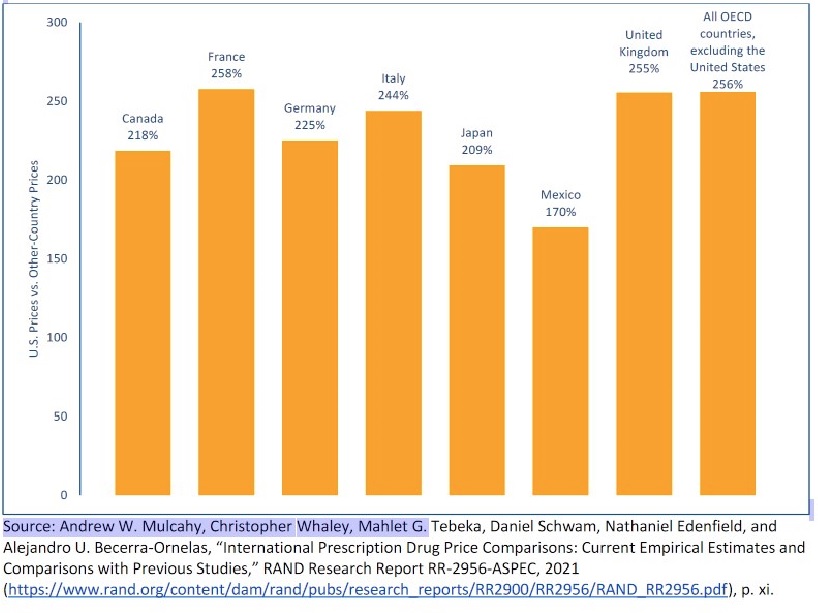
Los elevados precios de los medicamentos representan un reto para su asequibilidad y dificultan el acceso de muchos estadounidenses. El 24% de los adultos que toman medicamentos de venta con receta dicen que tienen dificultades para pagarlos [6], y casi el 10% de los adultos informan de que no se adhieren al tratamiento para ahorrar dinero [7]. Algunos han muerto como consecuencia de ello [8]. Además, para muchas enfermedades, hay disparidades generalizadas de acceso según grupo étnico y estatus socioeconómico [9]. Como declaró el presidente Biden, los altos precios de los medicamentos “han presionado a demasiadas familias y las han despojado de su dignidad”, obligándolas a elegir entre mantener su salud, pagar el alquiler o la hipoteca, o poner comida en la mesa [10].
Los más perjudicados por los elevados precios de lista de los medicamentos son los que carecen de seguro y los infra asegurados. El aumento del gasto en medicamentos dificulta el poder pagar un seguro, y presiona a los gestores de los seguros a ofrecer prestaciones menos generosas. El gasto en medicamentos de venta con receta que se efectúa en las farmacias (es decir, al por menor) alcanzó los US$369.700 millones en 2019 (un promedio de US$1.128 por persona), y los pacientes pagaron US$53.700 millones de ese total como gastos de bolsillo (un promedio de US$164 por persona, incluyendo tanto a las personas con cobertura en salud como a los no asegurados) [11]. En 2019, este gasto representó el 10% del gasto nacional en salud, y el 13% del gasto de bolsillo [12]. Algunos estadounidenses gastan mucho más que el promedio en medicamentos de venta con receta, incluso cuando tienen cobertura de salud. Por ejemplo, en 2019 el 5% de los estadounidenses de 65 años o mayores que están cubiertos por la Parte D de Medicare y que tuvieron mayor gasto en medicamentos pagaron de su bolsillo un promedio de US$1.490 por los medicamentos de venta con receta [13]. El gasto total en medicamentos de venta con receta en las farmacias, neto de reembolsos y otros descuentos, aumentó un 5,7% entre 2018 a 2019 (los datos más recientes disponibles), y el gasto de bolsillo aumentó un 3,5% [14]. Los precios al por menor de los medicamentos de marca más utilizados han aumentado más rápidamente que la inflación [15].
En 2015, los medicamentos administrados en hospitales o consultorios médicos, que no están incluidos en los anteriores totales de venta al por menor, representaron el 28% del gasto total en medicamentos [16]. Esto sugiere que en este momento el gasto en los medicamentos que no se venden en farmacias debe ser de unos US$144.000 millones (un promedio de US$439 por persona, incluyendo tanto a las personas con cobertura médica como a las no aseguradas), y el gasto total en medicamentos de venta con receta de US$1.567 por persona y por año. Es posible que estas cifras estén subestimadas, ya que el gasto en medicamentos no destinados a la venta en farmacias ha aumentado de forma más marcada que el gasto en las farmacias, y los datos sobre dichos gastos no están muy bien informados [17].
En EE UU, los precios de los medicamentos no sólo son demasiado elevados, sino que, en el caso de los medicamentos de marca, suelen aumentar mucho más rápidamente que la inflación. El sistema actual permite que, con el trascurso del tiempo, los fabricantes de medicamentos de venta con receta vayan subiendo los precios de sus productos, sin que los precios tengan que guardar relación con el valor clínico del medicamento y a menudo superando con creces la inflación. En muchos de los casos relacionados con fármacos más antiguos, aunque sus patentes hayan caducado hay pocos incentivos para sacar productos que compitan con los existentes, por lo que sus fabricantes enfrentan escasa o nula competencia de biosimilares, genéricos o alternativas de marca. En estos casos, la ausencia de competencia permite que esos pocos fabricantes impongan precios mucho más elevados y sigan subiendo los precios a discreción [18].
Los mercados monopolísticos también han contribuido a los exorbitantes aumentos de precios, que para algunos medicamentos de venta con receta han estado muy por encima de la tasa de inflación. La pirimetamina, por ejemplo, se comercializó para tratar la toxoplasmosis bajo la marca Daraprim en 1953. Aunque la FDA había aprobado muchas versiones genéricas del medicamento, en el 2015 todos los fabricantes estadounidenses habían abandonado el mercado de la pirimetamina menos uno. Esto otorgó el monopolio a Turing Pharmaceuticals, que en ese momento dirigía Martin Shkreli, y en 2015 el precio pasó de US$13,50 por pastilla a US$750 por pastilla [19]. También se registran aumentos significativos de precios en la Parte B de Medicare; por ejemplo, el gasto promedio en cada factura de Humalog administrado a través de una bomba de insulina aumentó de US$274,53 en 2015 a US$1.130,77 en 2019 [20].
Todos los estadounidenses pagan por el aumento del gasto en medicamentos, a través de las primas de seguros y de los impuestos. Estos últimos pagan los medicamentos cubiertos por los programas públicos como Medicare, Medicaid, el Programa de Seguro Médico para Niños (CHIP), la Administración de Salud para Veteranos (VA) y el Servicio de Salud Indígena (IHS). En el programa Medicare, el gasto en medicamentos está creciendo más rápidamente que el de los otros servicios que ofrece el programa: el 5,9% anual en los medicamentos de la Parte B de Medicare (pago por servicio) y de la Parte D, en comparación con un incremento de 5,3% en el costo total del programa [21]. Desde 2006, el gasto en medicamentos por beneficiario de la Parte B de Medicare, que cubre los medicamentos administrados en los consultorios médicos y en los servicios ambulatorios de los hospitales, ha ido aumentado alrededor de un 8% al año, y casi un 10% entre 2017 y 2018, en comparación con aproximadamente un aumento anual del 6% en el gasto general de la Parte B [22]. El gasto en medicamentos de la Parte B de Medicare ha crecido de forma más abrupta en los últimos años [23]. La Parte D de Medicare no incluye un límite máximo al gasto de bolsillo, por lo que los beneficiarios que necesitan medicamentos caros o muchos medicamentos diferentes para tratar enfermedades crónicas pueden verse especialmente afectados: en 2019, casi 1,5 millones de beneficiarios tuvieron que hacer frente a un gasto de bolsillo superior al umbral catastrófico que actualmente está establecido en US$6.550; y US$3,6 millones de beneficiarios tuvieron que asumir, al menos durante un año, un gasto de bolsillo superior al umbral catastrófico en el periodo comprendido entre 2010 y 2019 [24].
Las personas de bajos ingresos, aquellas con discapacidades y las comunidades en las que residen se llevan la peor parte de los elevados precios de los medicamentos, por la falta de competencia en su cadena de suministro. Las personas con ingresos bajos tienen más probabilidades de no estar aseguradas que el resto de los estadounidenses [25]. Las comunidades de color podrían tener más probabilidades de tener que superar barreras geográficas y financieras para acceder a los medicamentos de venta con receta. Es más probable, por ejemplo, que vivan en “desiertos farmacéuticos” y que viajar grandes distancias para obtener los medicamentos necesarios [26]. Es fundamental fomentar la equidad en Medicare, Medicaid, CHIP y en el mercado de seguros privados, incluyendo el Marketplace (parte integral de la reforma de salud de Obama).
En la compleja cadena de suministro de medicamentos de venta con receta participan múltiples actores, y cada uno de ellos reclama su parte del gasto farmacéutico del país [27]. Más concretamente, los fabricantes producen medicamentos de venta con receta, los médicos los recetan y los pacientes los compran en las farmacias; los mayoristas acarrean los medicamentos entre los fabricantes y las farmacias; las empresas de seguros de salud, los administradores de beneficios farmacéuticos (PBM) y otros intermediarios organizan y financian la cobertura. Las conductas anticompetitivas y los oligopolios, en los que unas pocas empresas dominan el mercado, están presentes en todo el sector farmacéutico. Por ejemplo, las tres empresas que controlan la venta de la mayoría de los productos de insulina en todo el mundo han aumentado sus precios en EE UU más del 1.200% desde la década de 1990 [28]. Los fabricantes de medicamentos de marca a veces se aprovechan de las patentes y de su exclusividad en el mercado, que se establecieron para promover la innovación, y adoptan comportamientos que acaban generando “marañas de patentes”, “saltos de productos” (product hopping), “pagos por demora” y otras prácticas anticompetitivas para mantener fuera del mercado a los genéricos y biosimilares más baratos. También pagan a los administradores de beneficios de farmacia (PBM) para que incluyan a sus medicamentos, sin garantía de que el ahorro se traslade a los pacientes. Estos gestores utilizan su poder de mercado para cobrar tarifas a las farmacias independientes. Los tres PBM que gestionan el 77% de las facturas de recetas se han unido a las principales compañías de seguros de salud, y una de ellas es propietaria de la mayor cadena de farmacias que surte pedidos por correo [29]. Las empresas que forman parte de la cadena de suministro farmacéutico actualmente tienen poco o ningún incentivo para reducir los costos de los medicamentos y desafiar las acciones anticompetitivas.
Aunque el presente informe se centra en las estrategias federales para reducir los precios de los medicamentos, muchos esfuerzos estatales son coherentes con los principios expuestos en este informe, incluyendo los programas de importación de medicamentos de venta con receta, los topes al copago de la insulina y otros medicamentos vitales, los requisitos de transparencia en los precios de los medicamentos, las leyes para regular lo que los PBMs reembolsan a las farmacias, las estrictas leyes contra la especulación de precios, y las juntas de asequibilidad de los medicamentos de venta con receta [30]. Ni la Ley de Seguridad de los Ingresos de Jubilación de los Empleados (Employee Retirement Income Security Act o ERISA, por sus siglas en inglés) [31] ni la llamada “Cláusula de Comercio inactiva” (dormant Commerce Clause) [32] impiden que los estados tomen medidas para controlar los precios de los medicamentos. Pero se necesita también un fuerte liderazgo federal para catalizar y coordinar los cambios en las áreas del sistema de atención médica que quedan fuera de las competencias estatales.
Principios rectores del plan de precios de los medicamentos de la Administración Biden-Harris
En el presente informe se analiza la estrategia para reducir los precios de los medicamentos que se basa en los tres principios que se resumen en la Figura 2 y que se explican con mayor detalle a continuación.
|
Los elevados precios de los medicamentos se traducen en mayores gastos de bolsillo para los consumidores, así como en el encarecimiento de las primas de los seguros y mayores gastos para el gobierno y el sector privado. Estos costos representan una carga más pesada para las personas sin seguro, que tienen mayor probabilidad de tener ingresos más bajos, en las personas discapacitadas y con enfermedades crónicas, que a menudo deben hacer frente al aumento de precio de los medicamentos de venta con receta, y a las comunidades de color, que enfrentan barreras económicas y geográficas para acceder a los medicamentos.
La Orden Ejecutiva del Presidente Biden sobre la competencia afirmaba: “También es parte de la política de mi administración apoyar reformas legislativas agresivas que reduzcan los precios de los medicamentos de venta con receta, incluyendo autorizar a Medicare para que negocie los precios de los medicamentos” [33]. La reducción de los precios de los medicamentos a través de la negociación es clave para reducir los gastos de bolsillo de los consumidores, el gasto de los gobiernos y el gasto total en medicamentos. De lo contrario, las fallas del mercado por la falta de competencia logran que los altos precios de los medicamentos simplemente se trasladen a los trabajadores, a los empleadores y a los contribuyentes, que pagan las primas y financian los programas de seguros públicos. Permitir que la Secretaría del HHS negocie los precios para los beneficiarios de Medicare permitirá tener precios justos, cuando los mercados no lo consigan. Permitir que los proveedores comerciales, incluyendo los planes de los empleadores y los que participan en el Marketplace, accedan a esos precios extenderá los ahorros a más consumidores. Una política de negociación eficaz debe establecer criterios para determinar el fracaso del mercado, definir un precio justo, proporcionar al secretario herramientas y directrices para negociar un precio justo, e incentivar a las empresas farmacéuticas a participar en el proceso de negociación [34].
La falta de competencia adecuada ha permitido que los fabricantes de los medicamentos de marca que están incluidos en la Parte D de Medicare, en los últimos 20 años, hayan subido sus precios en más del doble de la tasa de inflación general [35]. Para controlar esta forma de fijar los precios, la Administración Biden-Harris apoya los esfuerzos bipartidistas del Congreso de imponer un impuesto especial cuando los fabricantes suban los precios de sus productos más rápidamente que la tasa de inflación.
Las medidas para reducir los precios de los medicamentos a través de la negociación, los reembolsos por la inflación y otros métodos que refuercen la competencia serán totalmente coherentes con la Orden Ejecutiva 13985, “Fomento de la equidad racial y apoyo a las comunidades desatendidas a través del Gobierno Federal” [36]. Tal y como se define en dicha Orden Ejecutiva, equidad significa:
el trato justo, equitativo e imparcial, coherente y sistemático, de todas las personas, incluyendo a las que pertenecen a comunidades desatendidas a quienes se les ha negado dicho trato, incluyendo a las personas negras, latinas, indígenas y nativas americanas, asiático-americanas e isleñas del Pacífico y a otras personas de color; a los miembros de minorías religiosas; a las personas lesbianas, gays, bisexuales, transexuales y queer (LGBTQ+); a las personas en situación de discapacidad; a las personas que viven en zonas rurales; y a aquellas que se ven afectadas negativamente por la pobreza persistente o la desigualdad [37].
La misma Orden Ejecutiva define a las comunidades desatendidas como “poblaciones que comparten una característica particular, así como comunidades geográficas a las que se les ha negado sistemáticamente la oportunidad de participar plenamente en aspectos de la vida económica, social y cívica” [38]. Como se señala en la introducción de este Informe, los elevados precios de los medicamentos generan cargas desproporcionadas de asequibilidad a las comunidades desatendidas, por lo que corregir estas desigualdades es una prioridad central.
Las políticas que aplican un tope a los gastos de bolsillo, como propone el presidente Biden para la Parte D de Medicare [39], ya figuran en el mercado de los seguros a través del empleo e individuales, incluyendo en los planes de Marketplace, que se crearon con la Ley de Asistencia Médica Asequible (Affordable Care Act, ACA u Obamacare). Estos topes son especialmente ventajosos para las personas con enfermedades crónicas costosas. Otras políticas para mantener o aumentar la competencia en el sector farmacéutico ayudarán a las personas de bajos ingresos y a las que viven en zonas rurales a obtener los medicamentos que necesitan cerca de su lugar de residencia.
Conforme al compromiso con la equidad, el HHS apoyará los esfuerzos por mejorar el Programa de reembolso de medicamentos de Medicaid. Esto también es coherente con la Orden Ejecutiva 14009 del Presidente Biden, “Fortaleciendo Medicaid y la Ley de Asistencia Médica Asequible (ACA)”, que compromete a la Administración a garantizar el funcionamiento de estos programas vitales [40].
Por último, hay bastante inquietud por las implicaciones que el uso de ciertas metodologías tiene para la equidad, como los años de vida ajustados por calidad (QALYs) para las personas de todas las edades con discapacidad y afecciones crónicas [41]. Las reformas a los precios de los fármacos deben evitar la utilización de metodologías que repercutan negativamente en el acceso de las poblaciones vulnerables a los medicamentos necesitan.
Para facilitar la competencia, es importante reducir los retos regulatorios para la aprobación de los productos nuevos. Las reformas deben abordar las tácticas de la industria y los desafíos regulatorios que retrasan o desincentivan la competencia al demorar la aprobación de productos genéricos y biosimilares que compitan con los originales de marca. Al mejorar la competencia a través de estos métodos se logrará tener una industria de medicamentos de venta con receta más resistente y transparente que la actual, lo que a su vez debería abaratar los precios.
Para mejorar la competencia en el sector de los medicamentos de venta con receta hay que promover el desarrollo y la disponibilidad de productos biosimilares y biosimilares intercambiables [42], así como de medicamentos genéricos. Garantizar que haya claridad en los procesos de la FDA puede agilizar su aprobación y mejorar la disponibilidad de los biosimilares, incluyendo los biosimilares intercambiables, y los genéricos. Dado que las licencias de biosimilares y la aprobación de genéricos pueden aumentar la competencia directa, deberían reducirse los obstáculos regulatorios a su aprobación. En el caso de los biosimilares, se estableció una vía para otorgar las licencias de biosimilares hace más de una década. Nos hemos comprometido a reexaminar el contexto normativo y a utilizar la experiencia acumulada durante esta década para agilizar el proceso de autorización. Ahora algunos medicamentos genéricos son más complejos que cuando entró en vigor su proceso de aprobación hace casi 40 años, ya sea por sus principios activos, su formulación, su vía de administración o su forma de dosificación. También es importante garantizar que se simplifique el proceso de aprobación de las versiones genéricas de los medicamentos complejos y que se aborden los desafíos específicos que enfrenta la FDA a la hora de evaluar estos productos.
También es importante promover el uso de los biosimilares, biosimilares intercambiables y genéricos una vez hayan sido aprobados. Un mayor uso de estos productos de menor costo no sólo ahorrará dinero, sino que también promoverá el futuro desarrollo de dichos productos. Las reformas deben promover el uso de biosimilares, biosimilares intercambiables y genéricos en los programas de Medicare, Medicaid, CHIP y en el Marketplace.
Las políticas deben evitar que los fabricantes utilicen estrategias para manipular el proceso regulatorio. Estas estrategias reducen la competencia y mantienen el poder de mercado, como se ha observado en el contexto de los medicamentos para tratar trastornos por consumo de opiáceos [43]. Las políticas tienen que reducir la probabilidad de que los fabricantes de marcas manipulen el mercado, para garantizar que los nuevos biosimilares y genéricos tengan acceso al mercado. Como se indica en la Orden Ejecutiva sobre la Competencia, la FDA trabajará con el presidente de la Comisión Federal de Comercio (FTC) para identificar y entrentar cualquier intento de obstaculizar la competencia de los medicamentos genéricos y biosimilares, incluyendo, entre otras cosas, las declaraciones falsas, engañosas o que inducen a error sobre la seguridad o la eficacia de los medicamentos genéricos y biosimilares [44].
Disponer de varios productos de marca que compitan en el mercado es fundamental para fomentar la competencia antes de que se comercialicen los productos genéricos y biosimilares. Cuando los incentivos están bien alineados, múltiples productos de marca pueden competir entre sí para reducir los precios. Sin embargo, los fabricantes pueden encontrar obstáculos a la hora de incentivar la realización de nuevos ensayos clínicos para desarrollar un medicamento que se convierta en segunda opción en el mercado cuando ya existe una terapia disponible. Esto permite que los productos de primera clase permanezcan en el mercado sin ningún competidor. Debemos estudiar la forma de mejorar el proceso para que salgan al mercado más productos, sin dejar de garantizar la aplicación de normas rigurosas de seguridad y eficacia.
El sistema de patentes también afecta el costo de los medicamentos de venta con receta. Con el trascurso del tiempo, el número de patentes sobre cada producto farmacéutico ha ido creciendo, por lo que se han generado marañas de patentes para un determinado producto. Por ejemplo, a más del 70% de los 100 medicamentos más vendidos entre 2005 y 2015, se les amplió la protección de la patente al menos una vez, y a casi el 50% se le amplió la protección de la patente más de una vez [45]. Durante este período, el 78% de los medicamentos que obtuvieron nuevas patentes eran fármacos existentes que ya estaban comercializados [45]. Estas marañas de patentes dificultan la comercialización de biosimilares y genéricos, aun cuando las patentes se declaren inválidas, inaplicables o cuando el competidor no las infrinja. Un caso extremo es el de los fabricantes que “eternizan o perennizan” sus patentes (evergreening), que es el proceso por el cual los medicamentos originales obtienen periodos adicionales de protección por patente por cada cambio que hagan a su producto, aunque sea de poca importancia, lo que les ayuda a estar evitando continuamente la competencia. Cuando las patentes que impugnan los tribunales, o se adoptan comportamientos anticompetitivos, como los acuerdos de “pago por demora” – que es cuando los fabricantes de productos de marca pagan a los competidores de genéricos para que no saquen sus productos al mercado-, se limita aún más la comercialización oportuna de productos competidores. La Administración Biden-Harris apoya las medidas para garantizar que los fabricantes de medicamentos no puedan utilizar injustamente el sistema de patentes para desalentar la competencia. La FDA y la Oficina de Patentes y Marcas de los Estados Unidos (USPTO) trabajarán conjuntamente para desarrollar soluciones, tal como lo solicita la Orden Ejecutiva sobre la competencia [46]. Un componente importante de esta colaboración es la carta que envió la FDA al Subsecretario de Comercio para la Propiedad Intelectual y al director de la USPTO en relación con la manera en que el sistema de patentes puede seguir incentivando la innovación y acelerar la disponibilidad de biosimilares y genéricos. Una mayor relación entre la FDA y la USPTO logrará que conozcan mejor como se complementa el trabajo de las dos agencias y aportará eficiencia a sus respectivos flujos de trabajo.
La competencia en la cadena de suministro es fundamental para reducir los costos de los productos y garantizar que los medicamentos estén disponibles cuando los pacientes los necesiten. Una cadena de suministro de medicamentos con capacidad de adaptación es diversa (depende de fabricantes que se diferencian en tamaño, concentración geográfica y tipos de productos que ofrecen), redundante (hay varios fabricantes para cada producto) y produce medicamentos de alta calidad. Por lo tanto, promover la adaptabilidad (resilience) favorece también la competencia. Sin embargo, en las últimas décadas, la fabricación de productos farmacéuticos se ha convertido en un negocio cada vez más global, provocando una disminución de la adaptabilidad de la cadena de suministro. Las Órdenes Ejecutivas del presidente Biden 14001 “Una cadena de suministro sostenible para la salud pública ” y 14017, “Las cadenas de suministro de EE UU”, comprometen a la Administración a promover cadenas de suministro adaptables, diversas y seguras para garantizar la prosperidad económica y la seguridad nacional [47]. Cadenas de suministro menos robustas, junto con la creciente consolidación de los mercados de medicamentos, han representado costos más altos para los consumidores y retrasos potencialmente mortales en los tratamientos. Esto puede ocurrir cuando no se dispone de medicamentos económicos y los consumidores deben recurrir a fármacos más costosos. Por el contrario, cuando el mercado recompensa las inversiones en fabricación de calidad que fortalecen la cadena de suministro, garantizamos en mayor medida la disponibilidad de productos farmacéuticos seguros, eficaces y de alta calidad. Por lo tanto, se debe mejorar la transparencia en la cadena de suministro e incentivar su adaptabilidad; revitalizar y reconstruir la capacidad nacional y la disponibilidad de medicamentos esenciales; y mantener el liderazgo de EE UU en la investigación y el desarrollo (I+D) promoviendo las inversiones en medicamentos innovadores.
Los mercados competitivos que funcionan bien son transparentes, lo que significa que todas las partes conocen y comprenden los precios de los productos y los servicios que se intercambian. La falta de transparencia puede contribuir a fallos en el mercado: por ejemplo, cuando un médico prescribe un medicamento sin patente pensando que su precio es razonable y sin darse cuenta de que ha aumentado. La Administración Biden-Harris está trabajando intensamente para aplicar la Ley Sin Sorpresas en todo el sistema de salud de EE UU, para proteger a los pacientes afiliados a planes grupales de salud y a los seguros individuales de los cobros sorpresivos por haber hecho uso de servicios médicos de emergencia y ambulancias que están fuera de la red de proveedores que ofrece su seguro, y por los servicios que no son de emergencia, que les prestan proveedores que están fuera de la red sin haber notificado previamente a la aseguradora [48]. La Orden Ejecutiva de Competencia exige que el secretario del Departamento de Salud (Secretary of HHS) “apoye las iniciativas existentes de transparencia de precios que deben implementar los hospitales, otros proveedores y las aseguradoras, así como cualquier nueva iniciativa de transparencia de precios” [49].
En este compromiso con la transparencia de precios se incluyen los medicamentos de venta con receta. Los pacientes deben saber, tanto cuando acuden el mostrador de la farmacia, como cuando se atienden el consultorio del médico o en el servicio de atención ambulatoria del hospital, lo que tienen que pagar de su bolsillo por una receta, si pueden obtenerla a un precio más bajo fuera de la cobertura de su seguro o por otros medios, y las transferencias que se producen entre terceros a raíz de sus transacciones. Los proveedores de servicios, incluyendo los planes que ofrecen las empresas y las agencias estatales de Medicaid, deben saber cuánto les cuestan realmente los medicamentos que compran. Tal como ocurre en otros mercados, donde los que los consumidores pueden comparar el precio de los productos antes de comprarlos, los precios de los medicamentos deben ser transparentes.
También podemos reducir los costos de comercializar innovaciones fortaleciendo la inversión gubernamental en promover la investigación necesaria para crear medicamentos de vanguardia. Como parte de este compromiso, la Administración Biden-Harris ha propuesto la creación de la Agencia de Proyectos de Investigación Avanzada para la Salud (ARPA-H) [50]. Esta agencia se encargaría de generar capacidades para hacer investigación de alto riesgo y alta recompensa, e impulsaría los avances biomédicos que ofrezcan soluciones transformadoras a los pacientes. Al igual que otros programas gubernamentales, como la Agencia de Proyectos de Investigación Avanzada en Defensa (DARPA) y la Autoridad de Investigación y Desarrollo Biomédico Avanzado (BARDA) que incluían como parte de su misión el fomentar innovaciones médicas clave, y las inversiones en la Administración Nacional de Aeronáutica y del Espacio (NASA) resultaron en descubrimientos tecnológicos que, en última instancia, estimularon la innovación privada, ARPA-H contribuirá a descubrir nuevas curas y tratamientos para los pacientes. ARPA-H comenzará centrándose en el cáncer y en otras enfermedades como la diabetes y el Alzheimer [51]. Así, ARPA-H continuará la colaboración entre los sectores público y privado que aceleró la disponibilidad de las vacunas contra el covid-19, que desarrollaron los fabricantes a partir de las investigaciones previas de los NIH, DARPA y BARDA. Las vacunas covid-19 se compraron con fondos del Gobierno federal y se pusieron a disposición de todos los estadounidenses sin que los pacientes tuvieran que compartir los gastos.
Un análisis reciente muestra que los NIH (Institutos Nacionales de Salud) contribuyeron al desarrollo del 100% de las Nuevas Entidades Moleculares (NME) aprobadas por la FDA, pues financiaron la investigación relacionada con los objetivos de las NME o, en menor medida, las propias NME [52]. Mientras ARPA-H y otros programas gubernamentales se vayan aprovechando de estas inversiones clave, los consumidores saldrán beneficiados.
Apoyo a una acción legislativa audaz
El aumento del precio de los fármacos de venta con receta es una preocupación acuciante para muchos estadounidenses que dependen de poder pagar sus medicamentos para sobrevivir o mantener su calidad de vida, y cuenta con un amplio apoyo de todo el espectro político para actuar al respecto. La Administración Biden-Harris está dispuesta a trabajar con el Congreso para promulgar propuestas sólidas y transformadoras que reformen el mercado farmacéutico estadounidense y aporten el alivio que tanto necesitan los estadounidenses por los altos precios de los medicamentos.
Legislación para reducir los pagos de bolsillo de los medicamentos y el gasto general en fármacos
El aumento vertiginoso de los precios de lista está disparando los gastos de bolsillo de los pacientes e impulsando el aumento del gasto global en medicamentos. Los nuevos productos farmacéuticos están saliendo al mercado a precios sin precedentes. En algunos casos, se pueden justificar los altos precios por el importante beneficio clínico que ofrecen a los pacientes. En otros casos, su elevado precio supera con creces lo que podría considerarse razonable en función de los beneficios clínicos que aportan. La tendencia hacia el desarrollo y la comercialización de medicamentos de gran éxito es uno de los principales impulsores de los recientes aumentos en el gasto farmacéutico [53, 54]. El desarrollo de medicamentos innovadores proporciona enormes beneficios, pero la tendencia constante a aumentar los precios de lista es insostenible. La Administración Biden-Harris apoya la legislación que reduzca los costos de bolsillo para los pacientes y el gasto general en medicamentos de venta con receta, al permitir que Medicare negocie directamente los precios, facilitar que los seguros comerciales accedan a esos precios, rediseñar los beneficios de Medicare y reducir los incentivos que fomentan la sobreutilización de medicamentos de alto costo.
Según el sistema actual de la Parte D de Medicare, éste contrata a patrocinadores de planes privados para que gestionen el plan de beneficios de los medicamentos de venta con receta y les otorga la autoridad para negociar los precios de los medicamentos con las compañías farmacéuticas. Una disposición de la ley que estableció el programa de la Parte D de Medicare prohíbe específicamente que el Secretario del Departamento de Salud y Servicios Humanos (HHS) interfiera en las negociaciones con los fabricantes de medicamentos, las farmacias y los patrocinadores del plan, que exija un formulario específico o que establezca una estructura de precios para el reembolso de los medicamentos cubiertos por la Parte D. Esta restricción es exclusiva de la Parte D y contrasta con el modo en que se determinan los precios de los medicamentos en otros programas federales, como por ejemplo el sistema de precios máximos que utiliza la Administración de Veteranos y los reembolsos obligatorios en Medicaid, que han logrado que los medicamentos de marca sean más baratos en comparación con los de la Parte D de Medicare [55]. La restricción también contrasta con el modo en que Medicare paga otros servicios, como los que prestan los hospitales y los médicos.
La Parte B de Medicare también tiene restricciones en cómo se pagan los medicamentos de venta con receta que se facturan por separado y que se administran en consultas médicas, en los servicios ambulatorios de los hospitales y por otros proveedores. En el caso de los fármacos administrados por los médicos, la Parte B tiene que aceptar los precios establecidos, y en la mayoría de los casos paga el 106% del Precio Medio de Venta (PMP), que es el precio promedio que el fabricante establece para todos los compradores de EE UU (con limitadas excepciones), incluyendo los reembolsos y otros descuentos. Este sistema basado en porcentajes genera incentivos perversos para que los fabricantes aumenten sus precios y para que los proveedores utilicen medicamentos más costosos y/o más medicamentos. La negociación de los precios de los medicamentos cubiertos por la Parte B, junto con más incentivos para que los hospitales y los médicos administren biosimilares u otros medicamentos de menor costo cuando estén disponibles, produciría un ahorro para los beneficiarios y para el Gobierno [56]. Los medicamentos de la Parte B también pueden generar gastos de bolsillo exorbitantes [57]. Por ejemplo, en 2017, los usuarios de la Parte B de Medicare tuvieron que pagar como promedio anual más de US$31.500 dólares por el eculizumab, que se utiliza para tratar formas raras de enfermedades sanguíneas, renales y musculares [58]. Además de reducir los costos de bolsillo, autorizar al Secretario del Departamento de Salud y Servicios Humanos (HHS) para que pueda negociar precios justos en nombre de Medicare podría ahorrar cientos de miles de millones de dólares al gobierno federal [59]. La autoridad para negociar directamente con los fabricantes de medicamentos permitiría al Secretario aprovechar el poder adquisitivo de estos programas más eficazmente, en particular en el caso de los medicamentos más caros que no tienen competidores, y con quienes los planes o proveedores privados pueden tener mayores dificultades para negociar precios más baratos. Las reducciones de precios que se obtengan en estas negociaciones se traducirán en menores costos para los pacientes en el consultorio médico (Parte B) y en el mostrador de la farmacia (Parte D), y en primas de seguro más baratas [60].
Según este plan, los beneficios de la negociación de precios no se limitarían a Medicare. Estos precios más bajos y justos también podrían aplicarse a los pacientes cubiertos a través de su lugar de trabajo, del Marketplace de la Ley de Asistencia Médica Asequible (ACA) y a los que tienen otros tipos de cobertura individual, siempre que los patrocinadores de estos planes decidan participar. Como ha dicho el presidente Biden, “si los precios de Medicare están disponibles para las compañías privadas de seguros, se reducirán las primas de los seguros médicos que ofrecen los lugares de trabajo” [61].
Para garantizar que los beneficiarios de Medicare tengan acceso a medicamentos asequibles, la Administración Biden-Harris apoya un tope en los gastos de bolsillo y otras reducciones en los copagos de los beneficiarios de la Parte D de Medicare. La Administración Biden-Harris apoya rediseñar los beneficios de medicamentos de venta con receta de la Parte D para establecer un tope a los gastos de bolsillo de los beneficiarios, aumentar la responsabilidad de los gestores de la Parte D y de los fabricantes de fármacos, y disminuir la responsabilidad de Medicare en la fase de gastos catastróficos. El rediseño para distribuir mejor la responsabilidad por los costos catastróficos puede fortalecer los incentivos para que los planes de salud negocien más agresivamente y para que los fabricantes ofrezcan precios más baratos. Además, los planes de la Parte D tendrían un mayor incentivo para promover los medicamentos que ofrezcan el mejor valor al menor costo.
Otros cambios podrían reducir el costo de los medicamentos de venta con receta del programa Medicaid para el gobierno federal y para los gobiernos estatales, manteniendo simultáneamente el acceso de los pacientes a los medicamentos. Algunas propuestas autorizarían al HHS a negociar reembolsos suplementarios al programa Medicaid en nombre de los estados que decidan voluntariamente participar en un programa de este tipo para tener mayor capacidad de negociación de la que tendrían individualmente, o a través de los consorcios estatales existentes. Otras propuestas prohibirían que los contratos con Medicaid se fijara precios amplios, en virtud de los cuales los PBMs reciben más por los medicamentos de lo que pagan a las farmacias que los suministran. También se podría estudiar la posibilidad de permitir que los estados apliquen los requisitos del Programa de reembolso de medicamentos de Medicaid a grupos de medicamentos que se suministran a pacientes ambulatorios en los hospitales y consultorios médicos.
El año pasado, el Congreso garantizó la disponibilidad de vacunas contra el covid-19 para todos, sin que los que las recibieron tuvieran que pagar nada. En virtud de ACA, lo mismo sucede con otras vacunas recomendadas por los Centros para el Control y la Prevención de Enfermedades (CDC) que se aplican a los inscritos en planes de seguro sin derechos adquiridos que se obtienen a través del empleo o se contratan individualmente, y las que se administran a los adultos elegibles por la expansión de Medicaid en los estados que lo han ampliado. Hace años, el Congreso garantizó que todos los niños tuvieran acceso a las vacunas, independientemente de su condición de asegurados. Del mismo modo, el Congreso podría proporcionar a todos los adultos acceso a todas las vacunas recomendadas por los CDC, sin tener que compartir los costos. Esto evitaría sufrimientos innecesarios, hospitalizaciones y muertes por afecciones como la gripe, el herpes zóster y la neumonía.
Legislación para frenar la subida de precios
Junto con la negociación, la Administración anima al Congreso a hacer frente a las situaciones en que los fabricantes aumentan los precios de los productos farmacéuticos más rápidamente que la tasa de inflación. Como se ha comentado en la Introducción, los aumentos de precios a los medicamentos existentes son a veces exorbitantes, en algunos casos duplicándose en pocos años -o más rápidamente- sin que exista ninguna razón clínica para cambiar el precio. La reestructuración de los beneficios catastróficos de la Parte D, tal y como se ha propuesto arriba, alinearía mejor los incentivos para los patrocinadores del plan y para los productores de medicamentos, y frenaría el crecimiento del gasto en medicamentos de la Parte D.
Legislación para mejorar la competencia promoviendo los biosimilares y los genéricos
Los esfuerzos legislativos que se dirigen directamente a los altos precios de los medicamentos son un primer paso fundamental y la base de cualquier reforma. Partiendo de esa base, las iniciativas del Congreso pueden también mejorar la competencia promoviendo el desarrollo y la disponibilidad de medicamentos biosimilares y genéricos de menor costo para todos los estadounidenses. Esto incluye acciones que impulsen la pronta aprobación de medicamentos genéricos y que proporcionen apoyo federal para incentivar el establecimiento de productores de genéricos sin ánimo de lucro que aumenten la disponibilidad de medicamentos genéricos. El Congreso también podría considerar hacer una reevaluación del período óptimo de exclusividad para los productos biológicos. Esto, a su vez, reducirá la probabilidad de que haya escasez de medicamentos y podría reducir sus costos. El Congreso puede presentar propuestas que promuevan la competencia acelerando la entrada en el mercado de biosimilares y genéricos más baratos. Estas iniciativas incluyen clarificar las normas y los procesos regulatorios para incentivar la rápida comercialización de productos intercambiables y garantizar que no se abuse de los periodos de exclusividad.
Debido a que Medicare es el mayor pagador en EE UU, responsable el 34% del gasto neto en medicamentos en ese país, cuando se combinan la Parte B y la Parte D [62], la política de pagos de Medicare puede desempeñar un papel importante en la promoción de los medicamentos biosimilares y genéricos. La Orden Ejecutiva de Competencia reconoce esto al requerir a los Centros de Servicios de Medicare y Medicaid (CMS) que “se preparen para que Medicare y Medicaid cubran los productos biológicos intercambiables, y para que los modelos de pago apoyen una mayor utilización de medicamentos genéricos y biosimilares” [63]. En 2016, la Parte D de Medicare podría haber ahorrado hasta US$3.000 millones si todos los medicamentos de marca se hubieran sustituido por los genéricos disponibles [64]. También se podrían tomar medidas para fomentar la utilización de biosimilares y genéricos en los planes del Marketplace.
El Congreso podría considerar otros esfuerzos para promover el uso de biosimilares y genéricos. Por ejemplo, podría animar a los proveedores a utilizar biosimilares y biosimilares intercambiables, eliminando el cálculo separado del límite de pago para los productos biológicos de referencia de la Parte B de Medicare. Hasta la fecha, los pagos adicionales que se otorgan a los proveedores por prescribir un biosimilar que coincida con el producto de referencia no ha sido un incentivo suficiente para que estos cambien sus patrones de prescripción y maximicen ahorro para la Parte B de Medicare. Un tope único de pago aplicable al producto biológico de referencia y al (los) producto(s) biosimilar(es) de ese producto biológico de referencia podría estimular la competencia de precios y hacer bajar los precios promedio de venta de todos los productos incluidos en el cálculo del tope de pago, lo que redundaría en un ahorro para Medicare y para los que ofrecen seguros complementarios. Otras propuestas incluyen modificar los pagos a los proveedores de servicios de la Parte B, para que los incentiven a recetar biosimilares y genéricos, en contraposición a las alternativas de mayor costo. Por último, los responsables políticos pueden considerar el uso de una alternativa menos costosa y fijar los precios según el valor de los medicamentos, incluyendo acuerdos basados en los resultados para la Parte B. Los beneficiarios podrían tener menor participación en los costos, lo que respondería a las preocupaciones por la equidad en el acceso a los medicamentos de alto costo de la Parte B. A medida que vayan apareciendo más biosimilares, aumentará el potencial de ahorro de esta propuesta.
Legislación para mejorar el contexto normativo y la estructura del mercado
Del mismo modo, las acciones legislativas podrían mejorar el contexto normativo y la estructura de mercado de las industrias farmacéutica y biotecnológica de varias maneras, para que proporcionen medicamentos críticos para los estadounidenses.
El Congreso podría tomar medidas legislativas adicionales para prohibir los acuerdos inversos sobre patentes, también conocidos como acuerdos de “pago por demora”, que se ha estimado que cuestan a los consumidores hasta US$36.000 millones al año [65]. En muchos casos, para una empresa que tiene un fármaco de marca patentado resulta rentable compensar económicamente al primer aspirante genérico a cambio de que el fabricante genérico acepte retrasar la comercialización de su propio producto. De este modo, se impide la entrada de todos los demás genéricos, pues se retrasa el inicio del periodo de exclusividad de 180 días que se le otorga al primer fabricante de genéricos que obtiene el permiso de comercialización. El Congreso podría abordar este comportamiento por medio de propuestas bipartidistas que calificaran de “anticompetitivo” cualquier acuerdo entre fabricantes de medicamentos de marca y de genéricos, en el que los titulares de solicitudes abreviadas de nuevos medicamentos [1] (ANDA) se comprometieran a renunciar a actividades de investigación y desarrollo, fabricación, comercialización o venta a cambio de una compensación económica. Otras propuestas introducirían cambios técnicos en la estructura del periodo de exclusividad de 180 días que se concede al primer fabricante de genéricos que solicita la comercialización de un nuevo producto, con el objetivo de reducir la capacidad y el incentivo de que las otras empresas de genéricos tengan que retrasar la comercialización de sus productos. Estas propuestas pueden incluir especificaciones como que el haber otorgado esa exclusividad no impide la aprobación de solicitudes posteriores de aprobación de genéricos mientras el primer solicitante no empiece a comercializar el medicamento, o ampliar las circunstancias por las que los primeros que solicitan la comercialización de un producto pueden perder el período de exclusividad de 180 días si no comercializan sus productos dentro de los plazos especificados. Estas propuestas también abordan los acuerdos de pago por demora entre los patrocinadores de productos de referencia y los que solicitan el permiso de comercialización de productos biosimilares e intercambiables.
Las iniciativas legislativas también pueden mejorar la flexibilidad regulatoria y la competitividad en el mercado al incrementar la velocidad y la flexibilidad del proceso de revisión de los biosimilares y los genéricos, lo que en última instancia logrará que la aprobación de productos seguros y eficaces sea más rápida y el mercado más competitivo. Estas propuestas eliminarían los requisitos reglamentarios innecesarios que demoran el proceso de aprobación. Por ejemplo, el Congreso podría eximir a los productos biológicos de tener que cumplir las normas para fármacos que aparecen en las monografías de la Farmacopea de EE UU (USP), ya que se cree que estas normas provocan retrasos en la autorización de los biosimilares; y el Congreso podría mejorar la eficiencia en el desarrollo de los biosimilares aumentando la flexibilidad y la claridad de lo relacionado con la inclusión de datos procedentes de estudios en animales. Otra propuesta destinada a facilitar el desarrollo de los genéricos enmendaría la ley para exigir que los fabricantes de medicamentos incluyan en el etiquetado / ficha técnica toda la información sobre los ingredientes inactivos de sus productos. Esta propuesta aclararía que la FDA no actúa indebidamente al entregar a un posible patrocinador de un medicamento genérico los nombres y las cantidades de los ingredientes inactivos que se utilizan en la formulación de un fármaco incluido en la lista de referencia cuando para obtener el permiso de comercialización se requiere que el medicamento genérico tenga la misma formulación. El Congreso puede también facilitar el desarrollo de productos genéricos complejos, que combinan fármacos y dispositivos, modificando la ley para ofrecer mayor claridad científica y normativa a los fabricantes de genéricos que manufacturan esos productos, así como para reducir el tiempo, la incertidumbre y el costo de su desarrollo.
Otros cambios legislativos dificultarían que los fabricantes de marcas abusaran del proceso regulatorio para impedir la comercialización de productos biosimilares y genéricos. El Congreso podría dificultar el intento de los fabricantes de frenar la capacidad de la FDA para tomar decisiones sobre los productos genéricos y biosimilares mediante la presentación de falsas peticiones ciudadanas, o impidiendo que los fabricantes se aprovechen de las estrategias de evaluación y mitigación de riesgos (REMS) para frenar el desarrollo de productos biosimilares y genéricos.
También es importante fomentar la innovación en el mercado de los antimicrobianos mediante el desarrollo de nuevos mecanismos de pago que para determinados productos desvinculen el volumen de ventas de los ingresos. Esto es especialmente cierto en el caso de las terapias dirigidas a patógenos resistentes a los medicamentos, cuya necesidad social no está satisfecha debido a las grandes externalidades derivadas de la transmisión de infecciones y de la evolución de la resistencia. La creación de este mecanismo desvinculado de pago podría restablecer simultáneamente una sólida cadena de producción y suministro de nuevas terapias antimicrobianas, y lograría sostener y mejorar la gestión de los antibióticos para limitar la tasa de desarrollo de resistencia a los antibióticos disponibles.
Medidas administrativas
Además de trabajar con el Congreso en iniciativas legislativos importantes dirigidas directamente a los altos precios de los medicamentos, hay palancas administrativas que pueden promover la competencia y reducir los precios. Las medidas adoptadas por el HHS y otros departamentos y entidades, como la Oficina de Patentes y Marcas Registradas de EE UU (USPTO), pueden reducir los precios y promover la competencia. También pueden realizarse esfuerzos importantes para enfrentar los acuerdos de pago por demora, como se menciona explícitamente en la Orden Ejecutiva sobre la Competencia [66].
Los Centros de Servicios de Medicare y Medicaid (CMS). Los Centros de Servicios de Medicare y Medicaid (CMS) desarrollan y aplican una amplia gama de políticas relacionadas con los medicamentos cubiertos por Medicare, Medicaid, CHIP y Marketplace. Los CMS seguirán utilizando su autoridad para combatir los precios excesivos de los medicamentos de venta con receta, reducir los precios que paga el Gobierno federal por dichos fármacos, abordar el problema recurrente de la subida de precios y lograr una mayor equidad en el acceso y la asequibilidad de los medicamentos para todos los estadounidenses. El Centro de Innovación de los CMS se creó para poner a prueba modelos innovadores de pago y de prestación de servicios con el fin de reducir los gastos del programa y, al mismo tiempo, preservar o mejorar la calidad de la atención prestada a las personas cubiertas por Medicare, Medicaid y CHIP. Los CMS seguirán priorizando los modelos de pago y de prestación de servicios que permitan probar formas de reducir el gasto en medicamentos de venta con receta, tanto de los programas como de los beneficiarios, impulsen el mayor uso de biosimilares y de medicamentos genéricos, y reduzcan el gasto general al tiempo que mejoran la calidad de los servicios y la salud de los beneficiarios.
Parte B de Medicare. Al llegar a su segunda década, la visión del Centro de Innovación de los CMS es ambiciosa y se centra en avanzar en la equidad en salud, mejorar la calidad y reducir los costos [67]. El objetivo es transformar el sistema de salud, para que pague por el valor y no por el volumen, y ofrezca una atención centrada en el paciente [68]. Los modelos que buscan reducir el alto precio de los medicamentos de la Parte B y corregir las distorsiones en la estructura de reembolso del programa son consistentes con estas prioridades y siguen siendo de gran importancia para los CMS. El Centro de Innovación está explorando una serie de posibles modelos:
Pagos innovadores en la Parte B de Medicare: El Centro de Innovación puede considerar modelos obligatorios, a pequeña escala, que vinculen el pago de los medicamentos de venta con receta y los productos biológicos a factores como la mejora de los resultados en los pacientes, la reducción de las desigualdades en salud, la asequibilidad de los pacientes y la reducción de los costos generales. Los modelos podrían incluir incentivos para el uso de terapias de alto valor, como los biosimilares y los genéricos, y acuerdos con los fabricantes que se basen en los resultados. Los modelos podrían ponerse a disposición de otros pagadores, incluyendo los planes de seguros que se obtienen a través del empleo y en el Marketplace, y los planes estatales de Medicaid y de las agencias que gestionan el Programa de Seguro Médico para Niños (CHIP). Este enfoque podría reducir los costos en los sectores público y privado, ampliar la utilización de biosimilares y genéricos, y estimular a los fabricantes a desarrollar medicamentos innovadores, todo ello sin reducir el acceso de nadie a los medicamentos que requieren. Como señalaron los Centros de Servicios de Medicare y Medicaid (CMS) en su propuesta de reglamento del 10 de agosto de 2021, esa agencia también está examinando los comentarios sobre el modelo de nación más favorecida para una selección de fármacos incluidos en la Parte B de Medicare [69].
Ahorros compartidos: Al Centro de Innovación de los CMS le interesan los modelos que comparten los ahorros de la Parte B de Medicare, derivados de la utilización de biosimilares, genéricos u otros productos de alto valor, entre los proveedores que los recetan y el Gobierno. Los beneficiarios que tienen cobertura complementaria se beneficiarían al tener que pagar primas más baratas por esa cobertura, y los pacientes sin cobertura complementaria tendrían menos gastos de bolsillo por los medicamentos.
Pago combinado por tratar episodios: Estos modelos podrían centrarse en los tratamientos de episodios que incluyan medicamentos y productos biológicos y representen una proporción importante del gasto en medicamentos de la Parte B de Medicare, junto con los gastos por administrar los medicamentos, dispositivos y otros servicios relacionados que se otorguen a un beneficiario durante un determinado periodo de tiempo. Estos modelos podrían incluir incentivos para el uso de biosimilares, genéricos y productos de fuente única de alto valor.
Parte D de Medicare. El Centro de Innovación de los CMS sigue probando el impacto del Modelo de Ahorro Senior de la Parte D, un plan voluntario de la Parte D de Medicare que ofrece a los beneficiarios más opciones de planes alternativos mejorados, con costos de bolsillo predecibles para una amplia gama de insulinas incluidas en el formulario [70]. Este modelo se podría actualizar para incluir otras clases de medicamentos que representen altos gastos de bolsillo para los beneficiarios, para problemas con alta prevalencia y/o utilización entre los beneficiarios de Medicare. Esta medida proporcionaría oportunidades adicionales para comprobar si las opciones que se han incluido en los planes alternativos de la Parte D mejoran la asequibilidad, el acceso y la adherencia de los beneficiarios que consumen ciertos medicamentos. El Centro de Innovación de los CMS está considerando modelos que ofrecen un apoyo adicional a los beneficiarios de bajos ingresos que reciben subsidios de la Parte D de Medicare. Estos modelos promueven el uso de biosimilares y genéricos, y podrían aumentar la utilización y la asequibilidad de los biosimilares y los genéricos.
Otra área de interés es la remuneración directa e indirecta (DIR). Los pagos DIR incluyen concesiones que se suelen basar en indicadores de farmacia como las tasas de dispensación de genéricos y de adherencia a la medicación. Los cambios en la DIR también pueden reducir los costos para los beneficiarios de la Parte D de Medicare. Entre 2013 y 2020, las concesiones de los precios negociados que obtienen los patrocinadores de la Parte D de las farmacias después de las ventas aumentaron de US$200 a US$11.200 millones anuales [71]. Aunque los ahorros por estas concesiones de precios terminan reportándose a los CMS al final del ciclo fiscal, los ahorros normalmente no se incorporan en la información sobre los “precios negociados” para la venta que se utilizan para fijar el costo para los beneficiarios. Cuando las concesiones de precios no se informan en los “precios negociados”, el paciente no se beneficia al comprarlos y paga más de su bolsillo. A finales de 2018, los CMS solicitaron comentarios sobre una política que requeriría que los patrocinadores de la Parte D aplicaran todas las concesiones de precios que obtienen de las farmacias incluidas en la red al precio negociado en el que se basan los costos para los beneficiarios y la adjudicación de beneficios. Los CMS están analizando estos comentarios para incorporarlos a futuras acciones en esta área.
Responsabilidad por el costo total de la atención médica en la Parte B y la Parte D de Medicare. El Centro de Innovación de los CMS está estudiando modelos para comprobar si una reforma integral a los pagos y una reforma sistema de prestación de servicios que se centre en ofrecer atención integral a la persona produce cambios en el uso de los medicamentos, en el gasto y en los resultados para los pacientes. Los modelos que prueban si los pagos innovadores por un conjunto de acciones, para una amplia gama de servicios, podrían incluir incentivos para rediseñar la atención de forma que se promueva el compromiso del paciente, mejore la coordinación de la atención y la calidad de los servicios. Un modelo podría evaluar lo que sucede si se responsabiliza a los prescriptores por reducir el costo total de la atención a lo largo del tiempo, incluyendo los medicamentos de las Partes B y D de Medicare, y podría incluir incentivos usar terapias de alto valor, biosimilares y genéricos. Este modelo se basaría en la experiencia del Centro de Innovación de los CMS con los modelos de costo total de la atención, incluyendo el modelo de atención oncológica y las organizaciones de atención responsable (ACO), aunque estas últimas no incluyen los gastos de la Parte D en el cálculo de objetivos de gasto. Estos modelos podrían abarcar enfermedades como la hepatitis C, el VIH/SIDA, los trastornos por consumo de opiáceos y la diabetes. Estos modelos aprovecharían los precios más bajos de los medicamentos que se obtengan a través de la negociación, a la vez que abordarían importantes objetivos de salud pública.
Transparencia en el precio de los medicamentos. Los CMS utilizarán la información de dos recopilaciones de datos para mejorar la transparencia en el sector de los medicamentos de venta con receta, incluyendo una mejor comprensión de los fármacos que impulsan el aumento del gasto en medicamentos de venta con receta en EE UU, del impacto de los reembolsos de los medicamentos de venta con receta, de las tendencias en la utilización de los medicamentos de venta con receta y del impacto de los reembolsos de los medicamentos de venta con receta en las primas y en los gastos de bolsillo.
Los CMS están aplicando las disposiciones de la Sección 204 del Título II (Transparencia) de la División BB de la Ley de Asignaciones Consolidadas, 2021 [72]. Esta legislación estipula que los planes de salud grupales y los que ofrecen seguros de salud en los mercados grupales e individuales, anualmente, deben reportar información sobre los costos de los medicamentos de venta con receta y otros costos médicos a los Departamentos de HHS, Trabajo y Hacienda (colectivamente, los Departamentos). Los Departamentos y la Oficina de Gestión de Personal (OPM) recibieron comentarios públicos tras una solicitud de información, que se publicó en junio de 2021 [73], y están trabajando activamente en la elaboración de las normas respectivas. Próximamente, los Departamentos y la OPM ofrecerán información sobre los plazos para la recopilación de datos sobre los planes y sobre las empresas que los ofrecen. Los Departamentos y la OPM publicarán un informe bianual para el Congreso sobre los reembolsos por medicamentos de venta con receta que efectúen los planes grupales de salud y sobre la cobertura de los seguros grupales e individuales, las tendencias en los precios de los medicamentos de venta con receta y la contribución del costo de los medicamentos de venta con receta en los cambios a las primas de dichos planes o en su cobertura.
Los CMS también están aplicando las disposiciones de ACA, que exigen que los que ofrecen planes en el Marketplace o sus administradores de beneficios farmacéuticos (PBM) proporcionen información sobre los medicamentos, los reembolsos y los precios amplios [74]. El 28 de enero de 2020 y el 11 de septiembre de 2020, el HHS publicó avisos en el Registro Federal solicitando comentarios públicos sobre los requisitos de recopilación de información, que describían la propuesta de recolección de datos [75]. El HHS ha creado unportal para recolectar la información y actualmente está diseñando mecanismos para proporcionar asistencia técnica a los que ofrecen seguros y a los PBM. Se espera que la recopilación de datos de los PBM comience en 2022.
La Administración de Alimentos y Medicamentos (FDA)
La FDA está esforzándose por sortear los posibles obstáculos al desarrollo y a la comercialización de medicamentos biosimilares y genéricos para estimular la competencia, de modo que los consumidores puedan acceder a los medicamentos que necesitan a precios asequibles. La FDA está también colaborando con los estados y las tribus para poner en marcha programas de importación segura de medicamentos de venta con receta que reduzcan significativamente los costos para los consumidores [76].
La competencia y los biosimilares. Los mercados competitivos de productos biológicos, incluyendo los biosimilares y los biosimilares intercambiables, son esenciales para mejorar el acceso de los pacientes a estos medicamentos y facilitar la reducción de los costos de la atención médica. En julio de 2018, la FDA publicó el Plan de Acción de Biosimilares (BAP), que aplica muchas de las lecciones que ha aprendido la FDA a partir de su experiencia con los medicamentos genéricos para estimular la competencia de los biosimilares [77]. El BAP se basa en cuatro estrategias clave: mejorar la eficiencia de los procesos de desarrollo y aprobación de los productos; maximizar la claridad científica y reglamentaria para los fabricantes de estos productos; establecer comunicaciones eficaces para mejorar su comprensión entre las partes interesadas; y apoyar la competencia en el mercado reduciendo la manipulación de los requisitos de la FDA y otros intentos de retrasar injustamente la comercialización de versiones sucesivas de productos biológicos.
Para facilitar el desarrollo y la aprobación de biosimilares y de productos biológicos intercambiables y hacer que el proceso sea más transparente, eficiente y predecible, la FDA ha elaborado documentos de orientación sobre una serie de temas fundamentales en el desarrollo de biosimilares e intercambiables; ha modernizado las Listas de Productos Biológicos Autorizados que gozan de Exclusividad de Producto de Referencia y Evaluaciones de Biosimilitud o Intercambiabilidad (Lists of Licensed Biological Products with Reference Product Exclusivity and Biosimilarity or Interchangeability Evaluations), comúnmente conocido como el Libro Morado, convirtiéndolos en una fuente de información sobre los productos biológicos aprobados fácil de usar; y está trabajando activamente en la actualización de los reglamentos sobre los productos biológicos. Estos reglamentos se redactaron básicamente en la década de 1970, antes de la aprobación de la Ley de Innovación y Competencia de Precios de Productos Biológicos de 2009 (Ley BPCI) y deben actualizarse y modernizarse para incluir a los productos biológicos biosimilares e intercambiables. Además, la FDA está llevando a cabo investigaciones para apoyar programas más eficientes de desarrollo de biosimilares. En consonancia con la Ley de Avance de la Educación sobre Biosimilares de 2021 (Ley Pública 117-8), la FDA está trabajando también en el desarrollo de nuevas iniciativas educacionales para elaborar planes de estudio para las facultades de medicina, enfermería y farmacia, que amplíen la disponibilidad de cursos de educación continua para los proveedores de atención médica, y para informar mejor a los pacientes sobre los biosimilares y los intercambiables.
Igualmente, estamos explorando formas de lograr mayor flexibilidad en lo que respecta a los datos y a la información que se requiere para respaldar la autorización de un biosimilar o un biosimilar intercambiable. Esta flexibilidad puede acelerar los procesos de desarrollo y aprobación de estos productos de menor costo, sin comprometer su seguridad o eficacia. Para informar a los fabricantes que desean que la FDA apruebe los productos de insulina biosimilares o intercambiables con un producto de insulina aprobado, la FDA publicó un borrador de guía para la industria, “Clinical Immunogenicity Considerations for Biosimilar and Interchangeable Insulin Products” (Consideraciones sobre la inmunogenicidad clínica de los productos de insulina biosimilares e intercambiables) [78]. Resulta significativo que la FDA mencione en el borrador de guía que, en determinadas circunstancias, no será necesario hacer un estudio comparando la inmunogenicidad clínica para aprobar determinados productos de insulina biosimilares e intercambiables.
Desde que se dio a conocer ese borrador de guía, la FDA anunció el 28 de julio de 2021 la aprobación del primer biosimilar intercambiable, una insulina de acción prolongada que no incluyó un estudio clínico de inmunogenicidad [79]. La FDA determinó que Semglee (insulina glargina-yfgn), un análogo de la insulina de acción prolongada es biosimilar e intercambiable con su producto de referencia (Lantus). La aprobación de otros productos seguros y de alta calidad para el tratamiento de la diabetes facilita el acceso de los pacientes a opciones más económicas. Los estados pueden permitir que un farmacéutico sustituya el producto de referencia por un producto intercambiable sin consultar a quien lo prescribe -una práctica comúnmente llamada “sustitución a nivel de farmacia”- y esto puede suponer un mayor ahorro para los pacientes, para el Gobierno federal y para otros pagadores, incluyendo los planes comerciales de seguros.
La FDA seguirá trabajando para desarrollar mercados fuertes y competitivos de productos biosimilares e intercambiables para los pacientes con diabetes y otras enfermedades. Seguiremos colaborando con las partes interesadas, haciendo investigación y elaborando directrices y otras políticas para promover el desarrollo eficiente de productos biosimilares e intercambiables, así como para apoyar su utilización.
La competencia de los genéricos. La FDA se ha comprometido a enfrentar el elevado costo de los medicamentos fomentando una competencia sólida y oportuna en el mercado de los genéricos a través de diversas iniciativas, una de las cuales es el Plan de Acción para la Competencia de Medicamentos [80]. Mediante este plan, la FDA sigue aclarando y mejorando el marco de aprobación de los medicamentos genéricos para que su aprobación sea más transparente, eficiente y predecible. Estos esfuerzos dirigidos a aclarar las expectativas normativas de la FDA apoyan el desarrollo de medicamentos genéricos y mejoran la calidad general de las solicitudes de comercialización de estos medicamentos. Al mismo tiempo, la FDA está haciendo que su propio proceso de revisión sea más eficiente, mejorando la velocidad y la previsibilidad del proceso de revisión de los genéricos a la vez que mantiene unos estándares científicos rigurosos. Aportar mayor transparencia a los procesos de revisión y aprobación de los medicamentos genéricos, así como eliminar las barreras a su desarrollo y comercialización, respalda el acceso de los pacientes a los medicamentos que necesitan a precios asequibles.
Muchos de estos esfuerzos se centran en el desarrollo y la aprobación de medicamentos genéricos complejos, una categoría que incluye a los genéricos con principios activos complejos, a las formulaciones complejas o a los que utilizan vías de administración complejas, así como a los productos complejos que combinan medicamentos y dispositivos. Estos medicamentos genéricos complejos suelen ser más difíciles de desarrollar que otros genéricos, lo que significa que muchos productos complejos de marca tienen menos competetidores que otros productos de marca y, por tanto, pueden ser más caros y menos asequibles para los pacientes que los necesitan. Las iniciativas de la FDA en este ámbito, como las próximas guías sobre productos específicos para apoyar el desarrollo y la aprobación de genéricos seguros y eficaces [81] pretenden garantizar que los requisitos reglamentarios para los medicamentos genéricos complejos sean claros y previsibles, y tengan una base científica. Al reducir de esta forma el tiempo, la incertidumbre y el costo de la elaboración de los fármacos, se mejorará el acceso de los pacientes a medicamentos asequibles.
En todos estos esfuerzos, la FDA se ha comprometido a garantizar que sus políticas refuercen una cadena de suministro de medicamentos genéricos fuerte y sostenida, como se ha comentado anteriormente en el Informe.
Recortes en el etiquetado / ficha técnica. Las vías de comercialización de los medicamentos biosimilares y genéricos que creó el Congreso ofrecen la posibilidad de que sus fabricantes soliciten el permiso de comercialización para un número menor de indicaciones de uso que el producto de marca y, en consecuencia, determinados usos se pueden “eliminar de la etiqueta /ficha técnica”, incluyendo los que están protegidos por las patentes del producto de marca. De este modo, los fabricantes de biosimilares y genéricos pueden solicitar la aprobación oportuna y comercializar sus productos para los usos no protegidos, aun cuando otros usos del producto de marca siguen estando protegidos por patentes. Esta práctica, a veces descrita como “skinny labeling” (“etiquetado flaco”), puede disminuir los costos para los pacientes y para el Gobierno federal, incluyendo la reducción del gasto en los programas de Medicare y Medicaid.
Litigios recientes han suscitado cuestionamientos sobre la práctica de sacar algunas de las indicaciones protegidas por patentes de las indicaciones de los medicamentos genéricos, lo que podría desalentar el uso de estas excepciones y retrasar así la aprobación de ciertos genéricos. Nos comprometemos a tomar las medidas necesarias para garantizar que estas importantes prácticas sigan estando disponibles para los medicamentos genéricos y los biosimilares.
Acceso a las muestras de los productos. La Ley de Creación y Restablecimiento de la Igualdad de Acceso a Muestras Equivalentes de 2019, ampliamente conocida como Ley CREATES [82], pone a disposición de los desarrolladores de posibles medicamentos y productos biológicos una nueva e importante vía para obtener las muestras de los productos de marca que necesitan para respaldar sus solicitudes. En virtud de esta nueva ley, la FDA promueve la competencia proporcionando autorizaciones de productos cubiertos (Covered Product Authorizations CPA) a los creadores de productos de seguimiento, incluyendo a los biosimilares, los genéricos y los medicamentos 505(b)(2). Las CPA con un mecanismo importante para que estos fabricantes obtengan oportunamente las muestras de los productos de marca que necesitan para respaldar sus solicitudes de comercialización. La FDA está elaborando directrices para la industria, que espera publicar este invierno, para proporcionar información adicional sobre los CPAs.
Importación. La Orden Ejecutiva sobre la competencia solicita que la FDA colabore con los estados y las tribus indígenas que quieran desarrollar programas de importación de medicamentos de venta con receta, en conformidad con el artículo 804 de la Ley federal de alimentos, medicamentos y cosméticos y la normas sobre su aplicación que ha emitido la FDA. El Congreso creó esta vía legal para que la FDA permitiera importar determinados medicamentos de venta con receta desde Canadá, con el fin de reducir el costo de estos medicamentos sin que ello suponga un riesgo adicional para la salud y la seguridad públicas. En octubre de 2020, la FDA y el Departamento de Salud y Servicios Humanos anunciaron una norma final en virtud de la sección 804 [83]. La norma permite que los programas autorizados por la FDA importen de Canadá determinados medicamentos de venta con receta bajo condiciones específicas, que tal como exige la sección 804 garanticen que la importación no supone ningún riesgo adicional para la salud y la seguridad del público, al tiempo que se consigue una reducción significativa del costo de los productos para los consumidores estadounidenses. La FDA está trabajando con los estados y las tribus indígenas que quieren desarrollar programas de importación según la sección 804, y recientemente ha invitado a los estados que están interesados en dichos programas a colaborar con la agencia en todo este proceso.
Otros programas
Programa de fijación de precios de medicamentos 340B. El HHS reitera su decidido apoyo al Programa de fijación de precios de medicamentos 340B. El Congreso creó el Programa 340B en 1992 para aumentar los recursos de los que proveen servicios a la población pobre, para que pudieran proporcionar servicios a más pacientes elegibles y prestar servicios más integrales [84]. Estos recursos adicionales se generan a partir de los descuentos que los fabricantes de medicamentos ofrecen a los proveedores de estos servicios. En el marco del Programa 340B, los fabricantes de medicamentos que participan en el programa de reembolso de Medicaid deben comprometerse a suministrar medicamentos, a precios significativamente más bajos, para los pacientes ambulatorios que acuden a la red de proveedores de servicios para la población pobre (denominados “entidades cubiertas”). Los medicamentos que adquieren las entidades cubiertas se entregan a los pacientes que reúnen ciertos requisitos, ya sea en sus propias farmacias o a través de las farmacias comerciales con las que hayan establecido acuerdos contractuales.
Actualmente, más de 600 fabricantes y aproximadamente 13.000 entidades cubiertas participan en el Programa 340B. En 2020, estos proveedores adquirieron medicamentos por un valor de US$38.000 millones, ahorrando una media de entre el 25% y el 50%. Los estatutos definen a quienes califican como entidades cubiertas e incluyen a los centros comunitarios de salud, los beneficiarios del programa Ryan White, los centros de tratamiento de la hemofilia, los hospitales autorizados y las clínicas de planificación familiar del Título X. Estos proveedores atienden a un sector diverso de la población pobre y utilizan el Programa 340B para promover la equidad en salud ampliando la prestación de servicios que cuentan con montos de reembolso bajos y que suelen escasear, como los servicios de salud conductual, el tratamiento del VIH/SIDA y los servicios contra las adicciones para poblaciones que de otro modo no recibirían atención.
El derecho a intervenir y su utilización por parte del Gobierno. La Ley Bayh-Dole fue concebida para hacer frente a la falta de incentivos para comercializar las invenciones financiadas por el Gobierno, permitiendo a las pequeñas empresas u organizaciones sin ánimo de lucro, como las universidades, reclamar la titularidad de las invenciones generadas a través de becas o contratos con el gobierno federal. Antes de que entrara en vigor la Ley Bayh-Dole en 1980, el Gobierno federal era propietario de todas las invenciones que financiaba, y ninguna de ellas se utilizaba para desarrollar terapias o vacunas; desde entonces, se han comercializado 245 terapias y vacunas con patentes de universidades y laboratorios federales [85]. En determinadas circunstancias, el Gobierno federal puede conceder una licencia para utilizar la propiedad intelectual derivada de la financiación gubernamental sin obtener el permiso del titular de los derechos, por ejemplo, cuando “se requiere para aliviar necesidades de salud y seguridad que no están adecuadamente satisfechas” o cuando los beneficios del producto patentado no están “disponibles al público en condiciones razonables” [86].
El HHS, los NIH y otros organismos han recibido solicitudes para que tomen medidas en virtud de estas disposiciones, y el HHS les seguirá prestando la debida atención3. El HHS colaborará con otros organismos gubernamentales para superar los obstáculos que impiden el acceso a las invenciones financiadas por el Gobierno, tal como se destaca en la Orden Ejecutiva sobre la Competencia, que ordena al Director del Instituto Nacional de Normalización y Tecnología a que considere la posibilidad de no finalizar ninguna disposición sobre el derecho a intervenir ni a fijar los precios en la norma propuesta, “Derechos sobre las invenciones financiadas por el Gobierno federal y concesión de licencias sobre las invenciones de propiedad gubernamental” [87].
Pago por demora. Como se ha mencionado anteriormente, los acuerdos de pago por demora se producen cuando los fabricantes de productos de seguimiento acuerdan retrasar su comercialización a cambio de un pago monetario (o en especie) por parte de las empresas que fabrican el producto de marca. La FTC está facultada para investigar algunas formas de acuerdos anticompetitivos y ha realizado importantes avances en la impugnación de estas prácticas ante los tribunales. Esto incluye la histórica decisión del Tribunal Supremo de 2013 en el caso de la Comisión Federal de Comercio contra Actavis, Inc. el al [88], que permitió que el Gobierno y a las partes privadas entablaran demandas antimonopolio contra las empresas farmacéuticas. Sin embargo, sigue habiendo desafíos, ya que los acuerdos sobre patentes favorecen cada vez más las transacciones comerciales no monetarias, que siguen actuando como acuerdos de pago por demora. El HHS apoya a la FTC en su misión de garantizar que los acuerdos no infrinjan la competencia, y se mantendrá vigilante para combatir todas las formas de comportamiento anticompetitivo, colaborando con socios federales y estatales en la aplicación de la ley.
Si bien los derechos de patente, que concede la USPTO, pretenden fomentar la innovación, los acuerdos de pago por demora permiten que las patentes débiles o ineficaces sigan estando vigentes sin que nadie se oponga. Junto con el periodo de exclusividad de 180 días que se concede al primer competidor genérico en virtud de la Ley de Alimentos, Medicamentos y Cosméticos, el pago por demora logra ampliar el monopolio del fabricante de marca bloqueando a todos los competidores. La FDA es consciente de su obligación, en virtud de las “Enmiendas Hatch-Waxman” a la Ley Federal de Alimentos, Medicamentos y Cosméticos, de garantizar un equilibrio entre la innovación y el acceso a productos de seguimiento de menor costo, y del impacto que los procesos para obtener las listas de patentes podrían tener en retrasar el acceso a los productos de seguimiento. La FDA está esforzándose por mejorar la información sobre las patentes que aparece en Productos farmacéuticos aprobados con evaluaciones de equivalencia terapéutica de la FDA (comúnmente conocido como el Libro Naranja); para ello ha publicado guías sobre los procesos que contiene el Libro Naranja, ha celebrado eventos educativos públicos sobre el tema y ha solicitado comentarios del público sobre posibles cambios que se pudieran hacer en el futuro. Estos esfuerzos se analizan en más detalle en la carta de la FDA a la USPTO, y pueden contribuir a promover la disponibilidad de medicamentos genéricos de menor costo al aportar más claridad sobre las patentes que deben figurar en el Libro Naranja, y podrían provocar una suspensión de la aprobación por la FDA de 30 meses.
Conclusión
Este informe responde a la petición formulada en la Orden Ejecutiva sobre la Competencia de elaborar “un plan para continuar con el esfuerzo de combatir los precios excesivos de los medicamentos de venta con receta y mejorar las cadenas nacionales de suministro de productos farmacéuticos para reducir los precios que paga el Gobierno federal por dichos medicamentos, y para abordar el problema recurrente de la subida de los precios” [89]. El informe presenta los principios que se deben respetar para hacer una reforma equitativa de la fijación de precios de los medicamentos por medio de la competencia, describe las prometedoras iniciativas legislativas que están en marcha tanto en la Cámara de Representantes como en el Senado, y resume las actuaciones y propuestas administrativas de todo el HHS.
Oficina del Subsecretario de Planeación y Evaluación
El Subsecretario de Planeación y Evaluación (ASPE) asesora al secretario del Departamento de Salud y Servicios Humanos de EE UU (HHS) en la elaboración de políticas en materia de salud, discapacidad, servicios humanos, datos y ciencia, y ofrece asesoría y análisis en materia de política económica. La ASPE dirige iniciativas especiales, coordina las actividades de evaluación, investigación y demostración del Departamento y gestiona las actividades de planeación interdepartamental, como la planeación estratégica y legislativa y la revisión de reglamentos. Como parte de esta función, ASPE realiza estudios de investigación y evaluación, desarrolla análisis de políticas y estima los costos y beneficios de las alternativas a las políticas que está considerando el Departamento o el Congreso.
Cita sugerida
Office of the Assistant Secretary for Planning and Evaluation, U.S. Department of Health & Human Services. Comprehensive Plan for Addressing High Drug Prices: A Report in Response to the Executive Order on Competition in the American Economy. September 2021. https://aspe.hhs.gov/reports/comprehensive-plan-addressing-high-drug-prices
Agradecimientos
ASPE agradece las contribuciones de nuestros colegas del HHS que trabajan en los Centros de Servicios de Medicare y Medicaid, la FDA, la Administración de Recursos y Servicios de Salud y los Institutos Nacionales de Salud.
Esta comunicación se produjo y se difundió con los aportes de los contribuyentes de EE.UU.
Nuestros objetivos generales son fomentar la innovación, aprovechar las fuerzas del mercado y mejorar sus condiciones, todo ello con el fin de reducir el gasto farmacéutico para los consumidores y el sistema de salud. Este objetivo puede alcanzarse aplicando soluciones reales y equitativas. Una de las políticas clave en este esfuerzo es la legislación que permitiría al secretario del HHS negociar directamente los precios de los medicamentos con las compañías farmacéuticas, un enfoque que previsiblemente generará reducciones en las contribuciones financieras de los pacientes y grandes ahorros tanto para el Gobierno como para los seguros comerciales.
Las medidas legislativas y administrativas coherentes con los principios rectores presentados en este informe reducirían los precios que paga el Gobierno federal por los medicamentos de venta con receta, frenarían el abuso de las patentes y de las exclusividades que ejercen los fabricantes de medicamentos de marca para evitar la competencia, aumentarían la transparencia para los pacientes y en toda la industria farmacéutica, mejorarían las cadenas de suministro farmacéuticas nacionales y combatirían la especulación de precios. Lo más importante es que estas medidas protegerán a los pacientes estadounidenses y facilitarán el acceso y la adherencia a los medicamentos, al reducir los precios a través de una mayor competencia en todo el sistema de salud.
Referencias