Políticas
Europa
Los países de la Unión Europea tienen grandes diferencias entre sus políticas de biosimilares
J Ruiz Tagle
El Global, 17 de noviembre de 2017
http://www.elglobal.net/suplementos-y-especiales/biosimilares/los-paises-de-la-union-europea-tienen-grandes-diferencias-entre-sus-politicas-de-biosimilares-BC1242056
Las diferencias en política sanitaria son una nota predominante dentro de la Unión Europea ya que los estados miembro tienen sus competencias intactas. Se trata de una situación similar a la que se vive en España con las comunidades autónomas, si bien el Ministerio de Sanidad tiene mayor capacidad de control que la Comisión Europea. El caso de los medicamentos biosimilares no es una excepción e incluso es un ejemplo de disparidad legislativa. La Fundación Weber ha hecho una comparación entre las diferentes leyes que existen en países de la OCDE y el resultado arroja la diversidad entre los países analizados.
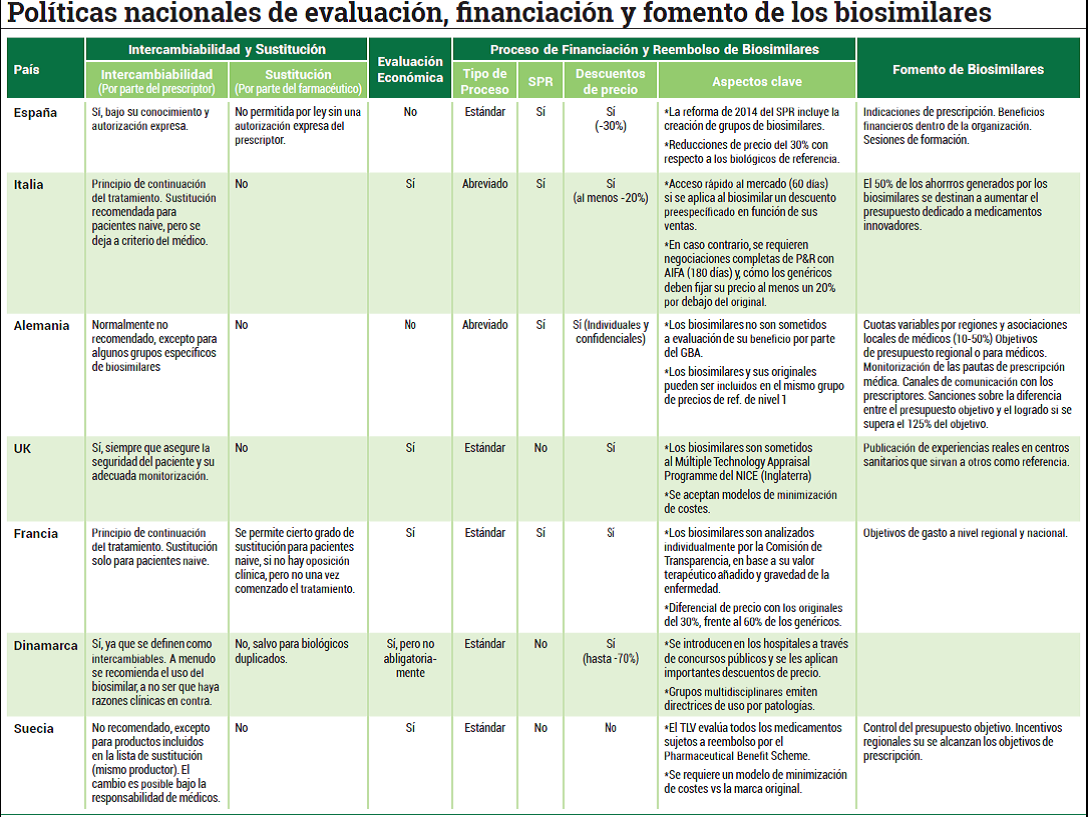
Una de las primeras diferencias se sitúa en las evaluaciones económicas de los biosimilares. España y Alemania no las contemplan mientras que Dinamarca las califica de opcionales. Sin embargo, tanto Italia como Reino Unido, Francia y Suecia sí las realizan por protocolo. Fuera de las fronteras europeas, Estados Unidos no obliga a realizar este tipo de evaluaciones mientras que Japón y Australia sí.
Dentro de los procesos de financiación y reembolso de los medicamentos biosimilares las diferencias persisten. En el estudio se especifica que el tipo de proceso para financiar estos medicamentos en Europa es estándar en países como España, Reino Unido, Francia, Dinamarca y Suecia (a los que habría que sumar por su peso en la OCDE a Australia y Japón) mientras que es abreviado en Alemania e Italia (además de Estados Unidos). Otra de las grandes diferencias se encuentra en la obligación de incluir a los medicamentos biosimilares en el Sistema de Precios de Referencia. España, Italia, Alemania y Francia sí los introducen en este mecanismo de control mientras que Reino Unido, Dinamarca y Suecia no lo hacen.
La intercambiabilidad entre fármacos biológicos también es una muestra de las diferencias que se encuentran dentro de los países de la UE. En España o Reino Unido sí se permite esta práctica bajo conocimiento del paciente y con autorización expresa del profesional sanitario. En Alemania, sin embargo, no está recomendado con algunas excepciones, al igual que en Francia, donde sólo se permite para el paciente naive. En Dinamarca sí se pueden intercambiar a no ser que haya razones clínicas en contra mientras que en Suecia no está recomendado.
Todas estas diferencias se oponen con la igualdad legal que existe en torno a las reglas de sustitución. Ningún país de los analizados por la Fundación Weber permite esta práctica con la excepción de Polonia y Estonia. En España, de hecho, hay una orden ministerial —que data de 2007— que prohíbe la sustitución y entre las grandes economías de la Unión Europea sólo Francia se permite cierto grado de sustitución siempre y cuando se traten de pacientes naives. Tanto en Alemania como en Italia, Bélgica, Suiza, Holanda y Reino Unido existen normas que prohíben esta práctica mientras que en Portugal, Austria o Eslavonia no existe una regulación específica.
Los modelos de promoción para incorporar medicamentos en los países de la Unión Europea también muestran diferencias. En Italia, el 50 por ciento de los ahorros producidos por los biosimilares se destinan a aumentar el presupuesto dedicado a medicamentos innovadores, mientras que en Alemania son más partidarios del establecimiento de cuotas, algo similar a lo que hace Portugal. En España, la Fundación Weber pone de manifiesto el esfuerzo de las autoridades en realizar sesiones de formación que ayuden tanto a pacientes como a profesionales sanitarios a romper barreras que dificulten la prescripción de biosimilares.