Investigaciones
Todo lo que quiera saber sobre los cupones de la FDA para revisión prioritaria
A. Gaffney, M. Mezher
Regulatory Affairs Professionals Society, 27 de julio de 2016
http://www.raps.org/Regulatory-Focus/News/2015/07/02/21722/Regulatory-Explainer-Everything-You-Need-to-Know-About-FDA%E2%80%99s-Priority-Review-Vouchers/?utm_source=Email&utm_medium=Informz&utm_campaign=RF-Today#sthash.TGnjMYIN.dpuf
Traducido por Salud y Fármacos
Desde 2007, la FDA ha concedido unos pocos bonos o cupones especiales de “revisión prioritaria” que sus receptores pueden utilizar para que la FDA acelere la revisión de cualquiera de sus nuevos productos farmacéuticos. ¿Qué son estos vales, por qué la FDA los emite y qué beneficio podrían tener para la sociedad? Lea nuestra última explicación del programa Priority Review Voucher (PRV) [1].
No sé mucho sobre el desarrollo de medicamentos ¿De qué estamos hablando?
Los programas PRV de la FDA tienen que ver con el desarrollo de fármacos y específicamente sobre el tiempo y el costo del desarrollo y las condiciones que el nuevo medicamento va a tratar.
Desarrollar un nuevo medicamento es costoso y requiere mucho tiempo. El costo de desarrollar un nuevo fármaco puede oscilar entre decenas de millones y miles de millones de dólares. En EE UU aproximadamente uno de cada 10 fármacos que entran en la fase 1 de ensayos clínicos se comercializa. Para algunas indicaciones difíciles de tratar, como las condiciones que afectan al sistema nervioso central, las tasas de éxito pueden ser incluso más bajas.
El tiempo que se necesita para obtener esa aprobación también puede ser un factor importante. Las empresas a menudo tardan años, a veces décadas, en desarrollar un medicamento antes de enviarlo para su aprobación a la FDA. Una vez que la FDA comienza su revisión, normalmente se tarda más de un año para que los reguladores aprueben el medicamento.
Descubrimiento y desarrollo de medicamentos: un camino largo con muchos riesgos
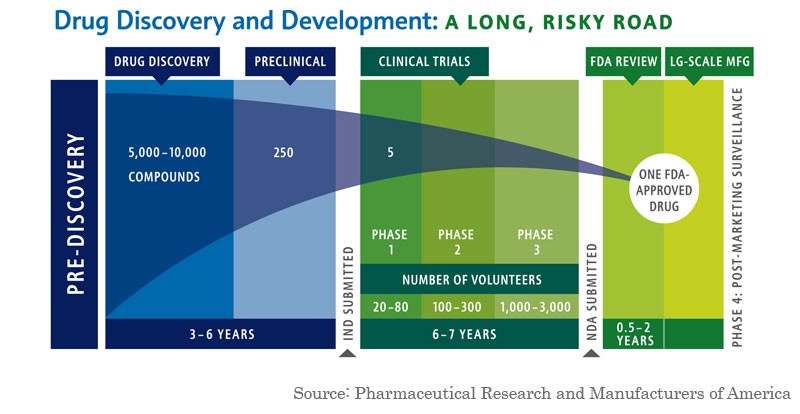
¿Por qué es importante el tiempo y el costo del desarrollo de fármacos?
Suponga, por un minuto, que usted es una compañía farmacéutica o biofarmacéutica que quiere desarrollar un fármaco. El tiempo y el costo que se necesita para desarrollar un medicamento significa que usted va a necesitar financiación, ya sea de inversionistas privados o accionistas públicos. A cambio de su inversión inicial, los inversores suelen querer un retorno de su inversión. La mayoría de las empresas generan esta rentabilidad vendiendo sus productos aprobados, ya sea directamente a los consumidores o a los que los pagan como las aseguradoras de salud o los sistemas de salud del gobierno.
Pero, ¿qué sucede si no existe un mercado para un producto que se vende?
Ese es el problema que enfrentan las empresas que desarrollan fármacos para dos tipos de población: Medicamentos destinados a tratar las llamadas enfermedades “olvidadas” y medicamentos destinados a las llamadas enfermedades “huérfanas” que afectan a un número relativamente pequeño de personas. Para los primeros, existe un mercado, pero puede ser demasiado pobre para permitir que la compañía recupere sus costos de desarrollo. Para los otros, existe un mercado, pero a veces puede ser solo de unos cientos de pacientes, también demasiado pequeño para recuperar los costos de desarrollo sin cobrar sumas exorbitantes.
En otras palabras, si una empresa está buscando maximizar las ganancias, es poco probable que pueda hacerlo mediante el desarrollo de productos para las enfermedades olvidadas o huérfanas.
Los medicamentos con mayores ventas en el mundo, ventas en miles de millones (US$)
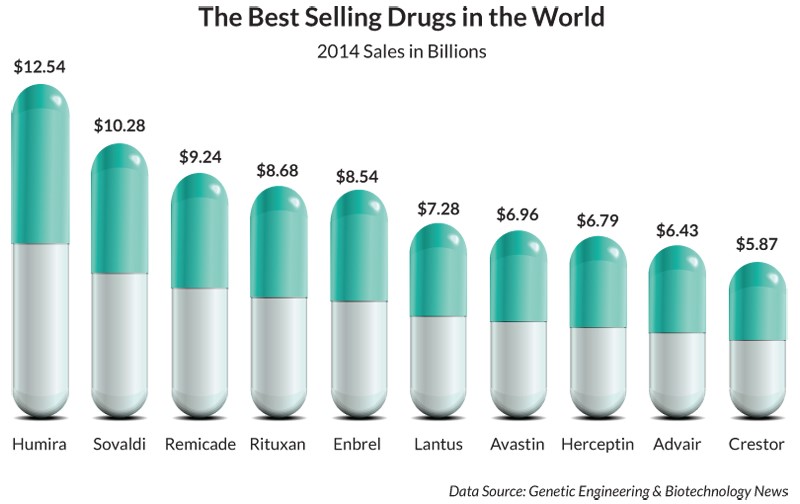
Además, el desarrollo de fármacos para enfermedades olvidadas y huérfanas puede ser a veces desproporcionadamente difícil. Las enfermedades más prominentes en los países occidentales se benefician de la investigación que hacen las entidades gubernamentales como los Institutos Nacionales de Salud de EE UU (NIH) o las fundaciones de salud pública. Su investigación ayuda a acelerar el desarrollo de fármacos ya que ayudan a las empresas a comprender mejor la patología de las enfermedades para las que esperan desarrollar tratamientos.
Las empresas que desean desarrollar tratamientos para enfermedades olvidadas o raras a menudo tienen hacer más, si no toda, la investigación inicial.
¿Hay formas de incentivar el desarrollo de medicamentos para enfermedades específicas?
En realidad, sí.
Desde la aprobación de la Ley de Medicamentos Huérfanos de 1984, EE UU ha empezado a reconocer que los incentivos pueden ayudar a estimular el desarrollo de nuevos fármacos para condiciones históricamente desatendidas. En virtud de la Ley de medicamentos huérfanos, las empresas tienen derecho a varios años adicionales de exclusividad comercial, y durante ese periodo la FDA no está autorizada a aprobar ningún genérico para tratar esa misma enfermedad “rara”. Con esto se pretende dar a las empresas un incentivo adicional para producir medicamentos destinados a las enfermedades que afectan a muy poca gente, ya que otorga a las empresas tiempo extra para recuperar los gastos de desarrollo y probablemente también obtener un beneficio.
Hasta la fecha, estos incentivos han demostrado ser muy populares. Antes de la aprobación de la Ley de Medicamentos Huérfanos, se aprobaron pocos medicamentos para tratar afecciones raras -definidas como aquellas que afectan a menos de 200.000 personas en EE Unidos. Por ejemplo, sólo en 1984 se aprobaron tres medicamentos “huérfanos”, pero en 2014, se aprobaron 49.
La FDA no revisa todos los fármacos de la misma manera. La FDA revisa la mayoría de los fármacos en el tiempo de revisión estándar, es decir tiene 10 meses para revisar cada medicamento y tomar una decisión. Sin embargo, el reloj de la revisión se detiene cada vez que la FDA solicita información adicional al patrocinador, lo cual puede agregar varios meses al proceso de revisión.
Número de medicamentos huérfanos aprobados en EE UU, 1984-2014
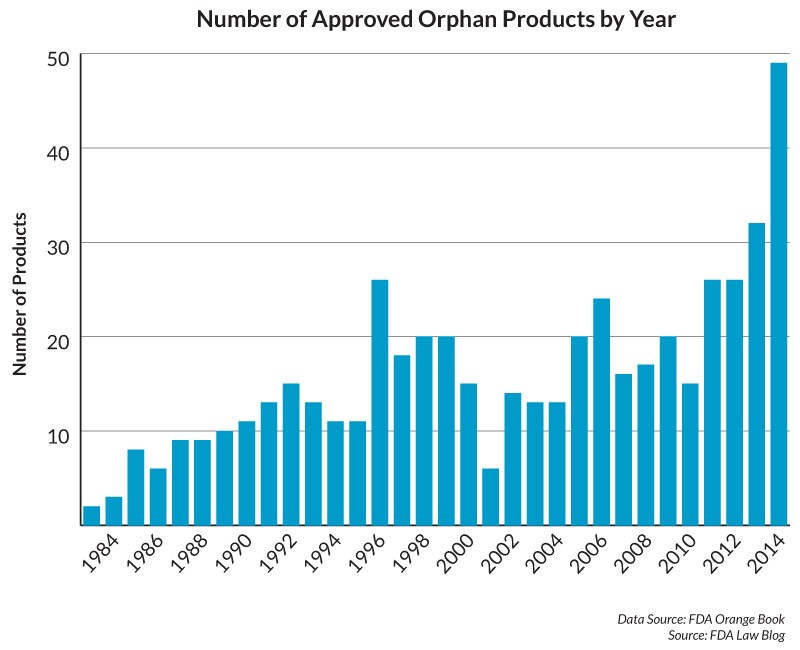
Sin embargo, para ciertos fármacos, la FDA acelera el proceso de regulación para que el medicamento pueda comercializarse antes.
Los medicamentos para “condiciones graves”, o que “demuestren que pueden ser significativamente más seguros o efectivos”, se pueden revisar bajo la vía que se conoce como ‘revisión prioritaria” que tiene la FDA. Como se explica en un documento de orientación de la FDA, esta vía permite a la FDA revisar un medicamento en sólo seis meses en lugar de los 10 que son la norma.
El proceso de revisión prioritaria de la FDA puede ser muy beneficioso tanto para las empresas como para los pacientes. Para los pacientes con condiciones graves, la revisión acelerada significa que tienen acceso a un tratamiento que les podría salvar la vida o tener acceso a un nuevo tratamiento. Para las empresas, significa que pueden comercializar sus medicamentos más rápidamente y comenzar a recuperar sus gastos, a menudo considerables, de I&D.
¿Qué tiene que ver todo esto con un cupón de revisión acelerada?
Los bonos para revisión prioritaria de la FDA (existen dos tipos) son incentivos destinados a estimular el desarrollo de nuevos tratamientos para enfermedades que de otra manera no atraerían el interés de las empresas debido al costo del desarrollo y la falta de oportunidades comerciales.
Para esto, las empresas reciben un cupón especial que les permite que cualquiera de sus medicamentos sea revisado bajo el sistema de revisión de prioridad de la FDA.
El funcionamiento del sistema de cupones prioritarios
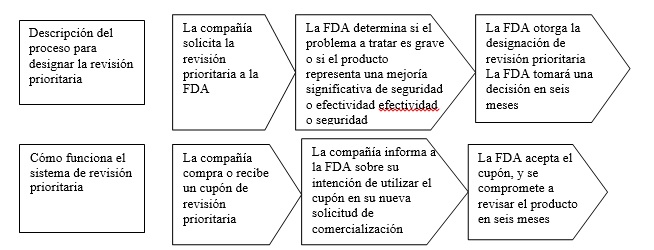
Eso suena interesante. ¿Cuál es la historia de los programas de PRV?
El programa de PRV se propuso por primera vez en un artículo escrito por David Ridley, Henry Grabowski y Jeffery Moe, de la Universidad de Duke y publicado en la revista Health Affairs en marzo de 2006.
En su artículo titulado “Desarrollo de medicamentos para los países en desarrollo”, propusieron la creación de un sistema de cupones prioritarios dirigido específicamente a las enfermedades tropicales desatendidas. Según los autores estas enfermedades no ofrecían incentivos económicos suficientes para que las empresas farmacéuticas los desarrollaran.
Este “premio”, tal como lo llamaban, se podría usar de dos maneras: Su dueño lo podía utilizar o vender a otra compañía con interés en que su propio medicamento fuera revisado en un periodo de seis meses.
La iniciativa más tarde llamó la atención del senador Sam Brownback (R-KS), quien trabajó para introducir el primer sistema de cupones en un proyecto de ley (Ley de Revitalización de la FDA), que eventualmente se aprobó en 2007 bajo otro nombre (Ley de Enmiendas de la FDA)
¿Cómo afectó la Ley de Enmiendas de la FDA al programa de sistema de cupones de prioridad?
La Sección 1102 de esa ley, “Revisión Prioritaria para Estimular los Tratamientos para las Enfermedades Tropicales”, creó el sistema de Cupones de Revisión Prioritaria para Enfermedades Tropicales Olvidadas.
Como se explica en la ley y en los documentos regulatorios subsiguientes, cualquier medicamento nuevo destinado a tratar la siguiente lista de enfermedades tropicales es elegible para recibir un cupón transferible de revisión prioritaria:
La ley de Enmiendas también dio a la FDA la autoridad reguladora para agregar “cualquier otra enfermedad infecciosa para la cual no hay mercado significativo en las naciones desarrolladas y que afecta desproporcionadamente a las poblaciones pobres y marginadas”.
En diciembre de 2014, los legisladores agregaron varios virus nuevos a la lista de enfermedades que pueden recibir un cupón, incluyendo Cuevavirus, cinco cepas de Ebolavirus y dos cepas de Marburgvirus (más sobre este virus después). En agosto de 2015, la FDA ejerció su autoridad para añadir por primera vez a la lista de enfermedades tropicales olvidadas elegibles, el Chagas y la neurocisticercosis.
| Enfermedades que son elegibles bajo el Programa de PRV de enfermedades tropicales | |
| Malaria | Tracoma ocular |
| Úlcera de Buruli | Cólera |
| Dengue/ Dengue hemorrágico | Dracunculiasis (lombriz de guinea) |
| Fascioliasis | Tripanosomiasis africana humana |
| Leishmaniasis | Lepra |
| Filariasis linfática | Oncocercosis |
| Esquistosomiasis | Helmintiasis transmitida por tierra |
| Pian | Tuberculosis |
| El Congreso añadió | |
| Cuevavirus | Ebolavirus |
| Marburgvirus | |
| Añadidas por orden de la FDA | |
| Chagas | Neurocisticercosis |
¿Existen limitaciones al uso de los PRV de enfermedades tropicales?
Sí, aunque la legislación posterior eliminó algunas de esas limitaciones.
Por ejemplo, la Ley de Enmiendas originalmente requería que el patrocinador de medicamentos avisara a la FDA por lo menos 365 días antes de solicitar un cupón. Esto limitó la utilidad del cupón para muchas empresas, ya que ralentizó el proceso de desarrollo de fármacos. Algunas compañías no saben si van a presentar la solicitud de comercialización de un fármaco hasta que reciben los resultados de los ensayos clínicos de la fase 3, es decir la última etapa.
Otra limitación contenida en la Ley de Enmiendas fue el número de veces que se puede vender un cupón: sólo una vez. Si bien una guía de la FDA de 2008 permitió a las compañías comprar y vender opciones de cupones, una vez que la compañía compraba un cupón, no podía revenderlo, un riesgo importante para el comprador. Por ejemplo, si el único producto farmacéutico de una empresa fallaba antes de usar el cupón, se convertía en un gasto inútil.
Una tercera limitación (si se puede llamar así) es el costo de canjear el cupón. En virtud de la Ley de Enmienda, la FDA está autorizada a cobrar a la empresa que canjea un cupón el costo adicional de realizar una revisión prioritaria además de la tarifa normal que se paga por la revisión de un nuevo medicamento.
Desde que se estableció por primera vez la tarifa del usuario de los cupones en el año fiscal 2011, el costo de su uso ha oscilado entre US$5,28 millones (2012) hasta US$2,32 millones (2014).
| Tarifa del usuario de los PRV de un medicamento para enfermedad tropical (en miles de US$) | |
| Año fiscal | Tarifa (en miles de US$) |
| 2011 | 4.582 |
| 2012 | 5.280 |
| 2013 | 3.559 |
| 2014 | 2.325 |
| 2015 | 2.562 |
| 2016 | 2.727 |
¿Qué otros tipos de cupones existe?
Hasta la fecha, sólo existe otro tipo de cupón: el de revisión prioritaria de enfermedades pediátricas raras.
Este cupón se creó en 2012 bajo la Ley de Seguridad e Innovación de la FDA y responde específicamente a la necesidad de nuevos tratamientos para subgrupos de otras enfermedades pediátricas raras.
La Sección 908 de la Ley define “enfermedad pediátrica rara” como una enfermedad” que afecta principalmente a personas desde el nacimiento hasta los 18 años, incluyendo grupos de edad a menudo llamados neonatos, infantes, niños y adolescentes”, y es una enfermedad rara según la ley federal (afecta a un máximo de alrededor de 200,000 personas en EE UU).
El programa de cupones para enfermedades raras pediátricas se parece mucho al de enfermedades tropicales, con varias excepciones. Quizás la diferencia más notable en el momento de su aprobación fue la facilidad de su uso. A diferencia del cupón de enfermedades tropicales, que requería que se notificara a la FDA 365 días antes de usarlo, el pediátrico solo se tenía que notificar 90 días antes.
Otra diferencia clave: el cupón pediátrico podría ser vendido un número ilimitado de veces, a diferencia del de enfermedades tropicales que sólo se podía vender una vez.
Sin embargo, a partir de diciembre de 2014, ambas diferencias se han eliminado con la Ley Adding Ebola to the FDA Priority Review Voucher Program (Ley que añade Ebola al programa de cupones para revisión prioritaria de la FDA) que eliminó la disparidad entre los dos cupones: ahora solo se necesitan 90 días, y pueden ser revendidos un número ilimitado de veces.
La FDA también ha indicado que los cupones requerirán la misma tarifa de usuario.
| Tarifa para el PRV de enfermedades pediátricas raras (en miles de US$) | |
| Año | Tarifas en miles de US$ |
| 2014 | 2.325 |
| 2015 | 2.562 |
| 2016 | 2.727 |
¿Cuántos cupones se ha otorgado hasta ahora?
La FDA ha concedido nueve PRVs, seis para enfermedades pediátricas raras y tres para tratamientos para enfermedades tropicales. Ver cuadro
| Cupones concedidos hasta ahora para revisiones prioritarias | ||
| Año | Tipo de cupón | Empresas |
| 2009 | Enfermedad Tropical | Novartis |
| 2012 | Enfermedad Tropical | Janssen |
| 2014 | Enfermedad Pediátrica Rara | BioMarin |
| 2014 | Enfermedad Tropical | Knight Therapeutics |
| 2015 | Enfermedad Pediátrica Rara | United Therapeutics |
| 2015 | Enfermedad Pediátrica Rara | Asklepion Pharmaceuticals |
| 2015 | Enfermedad Pediátrica Rara | Wellstat Therapeutics |
| 2015 | Enfermedad Pediátrica Rara | Alexion Pharmaceuticals |
| 2015 | Enfermedad Pediátrica Rara | Alexion Pharmaceuticals |
| 2016 | Enfermedad Tropical | PaxVax Bermuda |
Hasta ahora ¿Se han usado o vendido algunos cupones?
Tan interesante como saber quien ha recibido los cupones es saber que ha pasado con ellos.
| Situación de los cupones que se han emitido- PRV | ||
| Tipo de cupón | Situación de los cupones | |
| Novartis | Enfermedad tropical | Uso no exitoso de Novartis para acelerar la revision de Ilari (canakinumab) |
| Janssen | Enfermedad tropical | No se ha usado |
| BioMarin | Rare Pediatric Disease Enfermedad Pediátrica Rara |
Se vendió a Sanofi y Regeneron por US$67 millones. Uso exitoso para acelerar la aprobación de Praluent |
| Knight | Enfermedad tropical | Se vendió a Gilead por US$125 millones que la usó para el retroviral Odefsey |
| United Therapeutics | Enfermedad Pediátrica Rara | Se vendió a AbbVie por US$350 millones en agosto de 2015. AbbVie no ha dicho como piensa usar el cupón |
| Asklepion Pharma | Enfermedad Pediátrica Rara | Se transfirió a Retrophin según un acuerdo existente, el cual la vendó a Sanofi por US$245 millones. Sanofi utilizó el cupón para un nuevo medicamento para diabetes tipo 2 |
| Wellstat Therapeutics | Enfermedad Pediátrica Rara | Se transfirió según un acuerdo existente a AstraZeneca que no la ha usado |
| PaxVax Bermuda | Enfermedad tropical | No se ha usado |
| Alexion Pharmaceuticals | Enfermedad Pediátrica Rara | No se ha usado |
| Alexion Pharmaceuticals | Enfermedad Pediátrica Rara | No se ha usado |
Hasta la fecha, sólo se han utilizado dos cupones de revisión prioritaria. En 2011, Novartis utilizó el cupón que había recibido dos años antes para acelerar la revisión de Ilaris, convirtiendo a Novartis en la primera empresa en recibir y utilizar un bono de revisión prioritaria. Novartis solicitó el cupón para acelerar la revisión, que se hizo en seis meses, pero el medicamento no fue aprobado.
El segundo cupón de revisión prioritaria que se utilizó fue canjeado por Sanofi y Regeneron en 2015, tras habérselo comprado a BioMarin, siendo la primera vez que se vendió un cupón. A diferencia de Novartis, Sanofi y Regeneron tuvieron éxito con su cupon, y Praluent, el primer medicamento contra el colesterol en su clase, fue aprobado en seis meses, el 24 de julio de 2015.
Hasta ahora, tal vez el aspecto más notable de los cupones es el precio que se hn pagado por ellos. El de de BioMarin, que fue el primero que se vendió lo compraron por US$67 millones. Varios meses después, Gilead Sciences compró el cupón a Knight Therapeutics por US$125 millones. En mayo de 2015, Sanofi compró otro cupón por la cantidad récord de U$245 millones, y en agosto de 2015, AbbVie rompió ese récord pagando US$350 millones por el cupón que había sido originalmente otorgado a United Therapeutics.
En julio de 2016, Gilead reveló que había comprado un PRV que estaba en la Comisión de Valores de EE UU (SEC). Sin embargo, no se sabe quién vendió el cupón y cuanto se pagó por él.
Usar un cupón de revisión prioritaria ¿conlleva algún riesgo?
Existen varios riesgos inherentes a su uso.
La primera y más obvia es que la FDA no tiene ninguna obligación de aprobar un producto porque se utilice un cupón. Su única responsabilidad es hacer la revisión en seis meses. Y para las empresas cuyo medicamento no se aprueba, el fracaso puede ser especialmente costoso debido al costo de adquirir y utilizar el vale.
Otra limitación poco conocida es que la FDA afirma que realmente no tiene la obligación de revisar en seis meses todos los medicamentos que usan un cupón. Como se explica en la normativa de la FDA sobre los cupones de enfermedades tropicales, los patrocinadores no tienen “garantizada la revisión en seis meses”.
“Creemos que la intención de esta sección es que los medicamentos para los cuales se usan los PRV deben tratarse como si se tratara de cualquier otro tipo de revisión prioritaria. Por lo tanto estas solicitudes se incluirían en el grupo de revisión prioritaria. La Agencia se ha comprometido a completar el 90% de las revisiones prioritarias dentro de los 6 meses”.
La normativa de la Agencia para PRV para enfermedades pediátricas raras contiene un lenguaje similar.
¿Ha habido algún cambio en el programa cupones de revisión prioritaria?
En 2014, los legisladores estadounidenses hicieron un cambio importante en el programa PRV para enfermedades tropicales con la intención de proporcionar incentivos adicionales para combatir el virus Ebola y otros virus relacionados.
Los cambios fueron impulsados en parte por una editorial (op-ed) de David Ridley, uno de los padres del plan original de cupones, en la que propuso agregar “otras enfermedades infecciosas” a la lista de enfermedades que pueden recibir un cupón. Si bien la FDA ya estaba autorizada para agregar enfermedades adicionales a su lista a través del proceso regulatorio, los legisladores dijeron que temían que el proceso tomara demasiado tiempo y no se completara hasta que el brote Ebola hubiera terminado.
El 16 de diciembre de 2014, el Presidente Barack Obama firmó la ley Adding Ebola to the FDA Priority Review Voucher Program. La ley introdujo varios cambios sutiles pero importantes en el programa de cupones para enfermedades tropicales olvidadas.
Primero, la ley permitió que estos cupones fueran usados 90 días después de que una compañía notificara a la FDA su intención de presentar un nuevo medicamento. Anteriormente, las empresas tenían la obligación de notificar a la FDA con 365 días de antelación
Segundo, la ley permite que los vales tropicales sean revendidos un número ilimitado de veces. La FDA había interpretado previamente el estatuto para permitir una sóla venta del bono.
En tercer lugar, la ley añade “filovirus”, una categoría de enfermedades que incluyen cinco cepas de Ebolavirus, dos cepas de Marburgvirus y la cepa solitaria de Cuevavirus, conocida como virus Lloviu.
| Cepas | Virus |
| Cuevavirus | Lloviu virus |
| Ebolavirus | Bundibugyo virus |
| Reston virus | |
| Sudan virus | |
| Taï Forest virus | |
| Ebola virus | |
| Marburgvirus | Marburg virus |
| Ravn virus |
En cuarto lugar, la ley permite a la FDA añadir nuevos virus a la lista de enfermedades tropicales elegibles para un cupón “por orden” en lugar de “por regulación”. Este cambio permitirá a la FDA hacer cambios mucho más rápidamente y evitar las extensas disposiciones de notificación-y-comentario de la regulación federal.
¿Hay algunas críticas al programa de cupones para revisiones prioritarias?
Ha habido varias críticas importantes.
En primer lugar, ha habido algunas preguntas acerca de si el sistema de cupones está incentivando el desarrollo, o si por el contrario está actuando como un donativo a las empresas que de todos modos habrían desarrollado los nuevos productos. En un artículo publicado en enero de 2015 por la Biblioteca Pública de Ciencias (Public Library of Science), los autores Bernard Pécoul y Manica Balasegaram examinaron el cupón de enfermedad tropical que obtuvo Knight Therapeutics y encontraron que otras compañías y entidades habían hecho gran parte del trabajo de desarrollo del medicamento para que Knight Therapeutics obtuviera el permiso de comercialización del tratamiento para la enfermedad tropical (Ver http://blogs.plos.org/speakingofmedicine/2015/01/20/fda-voucher-leishmaniasis-treatment-can-patients-companies-win/).
Médicos sin Fronteras ha hecho comentarios semejantes contra el programa de cupones y ha dicho que se debería exigir a las compañías que demuestren que realizaron las investigaciones necesarias para obtener la aprobación del medicamento (http://blogs.wsj.com/pharmalot/2014/12/03/congress-should-fix-the-priority-review-voucher-program-msfs-ruis-explains/).
Otros expertos, incluyendo Rachel Cohen de Drugs for Neglected Disease Initiative’s (DNDi), han señalado que el programa de cupones realmente no requiere que una compañía venda un medicamento. En otros casos, las compañías podrían solicitar la aprobación de un medicamento para una enfermedad tropical que se comercializa fuera de EE UU con la esperanza de obtener un cupón. David Ridley, uno de los fundadores del programa de cupones, dijo que eso debería prohibirse.
El programa de cupones tampoco requiere que los medicamentos proporcionados a través del programa sean asequibles. David Ridley ha propuesto que se exija a las empresas que reciben un cupón de la FDA que informen sobre la asequibilidad de los medicamentos, y pidió a las empresas que voluntariamente garanticen que los medicamentos son asequibles para los que los necesitan.
Hay una pregunta más fundamental: ¿Se habrían desarrollado estos fármacos si no fuera por la posibilidad de obtener un cupón? Aunque los defensores del programa han dicho que los cupones son un poderoso incentivo para que las compañías consideren desarrollar nuevos fármacos, hay poca evidencia que demuestre que sin ellos no se hubieran desarrollado.
Desafortunadamente, todavía no es posible determinar el impacto de estos programas. Como dijimos, a menudo se necesita una década para desarrollar un nuevo medicamento y puede que no se sepa durante varios años si los programas de cupones son responsables del desarrollo de algún medicamento. Un estudio publicado en 2012 por la Public Library of Science estimó que la FDA entregará cinco y seis cupones entre 2016 y 2018.( http://journals.plos.org/plosntds/article?id=10.1371/journal.pntd.0001803)
Aaron Kesselheim expresó otra crítica en el New England Journal of Medicine en 2008: mientras los cupones se concedan solo para compensar los descubrimientos de nuevas moléculas, ignora la utilidad potencial de nuevas innovaciones. “Como resultado, un nuevo medicamento antipalúdico eficaz que se degrada en el calor y se tiene que tomar seis veces al día ganaría un cupón, pero las reformulaciones o mejoras a otro existente (follow-on formulation) que podría ser más útil en países con escasos recursos no ameritarían cupón”, escribió.
Kesselheim también señaló una preocupación más amplia, planteada también por otros expertos, y es que el proceso de revisión prioritaria es inapropiado para los medicamentos que no se necesitan urgentemente y añadió: “El programa de cupones permitirá que los medicamentos para los que hay poca o ninguna urgencia clínica puedan ser objeto de evaluaciones rápidas y puede llevar a que la FDA apruebe un medicamento sin que haya sido adecuadamente evaluado”.
¿Hay algún otro país que tenga un sistema de cupones?
No, aunque un artículo en The Lancet de septiembre de 2010, escrito también por David Ridley, propuso la creación de un sistema europeo de vales que aceleraría la revisión de medicamentos, así como las decisiones de precios y reembolsos. La propuesta aún no ha sido aprobada.
¿Existen otras enfermedades que la FDA pueda agregar a su Lista de Enfermedades Tropicales Olvidadas Elegibles?
La OMS instó recientemente a los gobiernos a “aumentar la inversión para hacer frente a las enfermedades tropicales desatendidas”.
En agosto de 2015, la FDA ejerció por primera vez su capacidad para añadir la enfermedad de Chagas y la neurocisticercosis a la lista de enfermedades tropicales olvidadas elegibles.
Muchas de las enfermedades tropicales en la lista de la OMS ya están en lista de enfermedades tropicales olvidadas de la FDA, pero no todas. Las que no figuran en la lista de la FDA son: rabies, echinococcosis, taeniasis y foodborne trematodiases
Y con la inclusión de la Ebolavirus, Chagas y otras enfermedades a la lista, es posible que el Congreso y la FDA puedan identificar pronto otras enfermedades que se podrían incluir, tales como el síndrome respiratorio coronavirus del Medio Oriente (MERS-CoV), la Chikungunya, el virus de la gripe aviar y otras enfermedades que se cree que representan un riesgo para la seguridad de EE UU.
¿Hay algún cambio potencial que vaya a llegar al programa PRV?
Sí. En virtud de la legislación en consideración en la Cámara de Representantes de los EE UU (la Ley 21 Century Cures) se extendería el programa PRV para las enfermedades pediátricas raras durante tres años más, hasta el 31 de diciembre de 2018 (Nota del Editor: esta ley ya ha sido aprobada).
Además, la legislación propone un endurecimiento de los requisitos para la obtención de un cupón. Sólo las enfermedades raras pediátricas que son “graves o que ponen en riesgo la vida” calificarían para el cupón, y las empresas no podrían obtener dos cupones (es decir, un cupón para una enfermedad tropical y otro para una pediátrica) para la misma enfermedad.
¿Dónde puedo obtener más información sobre el programa de PRVs?
Debe leer los dos documentos de orientación relacionados con la FDA (en inglés):
Guidance for Industry: Tropical Disease Priority Review Vouchers
Guidance for Industry: Rare Pediatric Disease Priority Review Vouchers, Guidance for Industry
Referencias
1. Puede leer (en inglés) todas nuestras explicaciones reguladoras en http://www.raps.org/regulatory-focus/news/research-resources/regulatory-explainer/