Gestión de los Ensayos Clínicos, Metodología, Costos y Conflictos de Interés
Principios de Common Sense Oncology para el diseño, análisis y la difusión de los resultados de ensayos clínicos aleatorizados de fase 3
Tags: Common Sense Oncology, ensayos oncológicos fase 3, beneficios de ensayos para personas con cáncer
Resumen
Common Sense Oncology (CSO) prioriza los tratamientos que ofrecen beneficios significativos para las personas con cáncer. En este artículo, describimos los principios de CSO, cuyo objetivo es mejorar el diseño, el análisis y la presentación de informes de ensayos clínicos aleatorizados, controlados y de fase 3 que evalúan tratamientos oncológicos. Estos principios incluyen:
- el tratamiento para el grupo control debe ser el mejor estándar de atención existente en el momento de hacer el estudio;
- el criterio de valoración principal preferido es la supervivencia global o un sustituto validado;
- se debe proporcionar una medida absoluta del beneficio, como la diferencia en la mediana de la supervivencia global entre los grupos o la proporción de pacientes que sobreviven en un momento preespecificado;
- la calidad de vida relacionada con la salud debe ser al menos un criterio de valoración secundario;
- la toxicidad se debe describir de forma objetiva, sin que el lenguaje subjetivo le reste importancia;
- los ensayos se deben diseñar para mostrar o descartar diferencias clínicamente significativas en los resultados, en lugar de una simple diferencia estadísticamente significativa;
- la censura debe ser detallada y se deben realizar análisis de sensibilidad para determinar sus posibles efectos.
- hay que ofrecer y financiar tratamientos experimentales que mejoran la supervivencia general en etapas posteriores de la enfermedad a los pacientes que se deterioran en el grupo control; y
- los informes de los ensayos clínicos deben incluir un resumen en lenguaje común.
Incluimos listas de verificación para guiar la adherencia a estos principios. Al fomentar la adherencia, CSO pretende garantizar que los ensayos clínicos produzcan resultados científicamente sólidos y significativos para los pacientes.
Lista de verificación para el diseño de ECA que evalúan nuevas terapias sistémicas contra el cáncer
- El grupo control debe recibir el mejor tratamiento estándar disponible en el momento de iniciar el ensayo.
- Los criterios de elegibilidad no deben ser excesivamente restrictivos, para facilitar la aplicación de los resultados a la práctica clínica habitual.
- El criterio de valoración principal preferido para la mayoría de los ECA es la supervivencia global; si se utiliza un criterio de valoración indirecto, se debe proporcionar evidencia de que puede sustituir a la supervivencia global o a la calidad de vida relacionada con la salud (HRQOL o CVRS).
- El tamaño de la muestra y el diseño estadístico de los ECA se deben basar en su capacidad para mostrar o descartar diferencias que cumplan con umbrales de beneficio significativo, como los de la Escala de Magnitud del Beneficio Clínico de la Sociedad Europea de Oncología Médica (European Society of Medical Oncology’s Magnitude of Clinical Benefit Scale). Los ensayos que no cumplan estos criterios se deben reportar como ensayos sin beneficio significativo.
- Los ECA que evalúan tratamientos oncológicos deben incluir una medida validada de la CVRS, al menos como criterio de valoración secundario.
- Se debe dar seguimiento a los participantes durante el tiempo suficiente para evaluar la supervivencia global, independientemente del criterio de valoración principal. Durante el ensayo, hay que solicitar permiso a los pacientes para seguir recopilando información sobre el tratamiento y la supervivencia tras el cierre del ensayo.
- La toxicidad se debe evaluar de forma objetiva, incluyendo la interrupción o suspensión del tratamiento, la toxicidad crónica de bajo grado y la toxicidad temporal; se recomienda que los pacientes notifiquen la toxicidad.
- Se deben tomar medidas para minimizar el abandono y la pérdida de pacientes durante el periodo de seguimiento. Al reclutar a los participantes hay que solicitar permiso para obtener información sobre su estado de salud cuando no se adhieran al protocolo del ensayo.
- Hay que describir los análisis de sensibilidad en el protocolo, para determinar el posible efecto de la censura en los resultados del ensayo.
- Cualquier análisis de subgrupos basado en biomarcadores se debe definir en el protocolo.
- Los ECA que evalúen un tratamiento temprano que haya demostrado mejorar la supervivencia global en pacientes con enfermedad en etapa avanzada, deben proporcionar dicho tratamiento a los pacientes en el grupo control en el momento que progrese su enfermedad (si están en condiciones adecuadas para recibirlo), y debe ser financiado por el patrocinador.
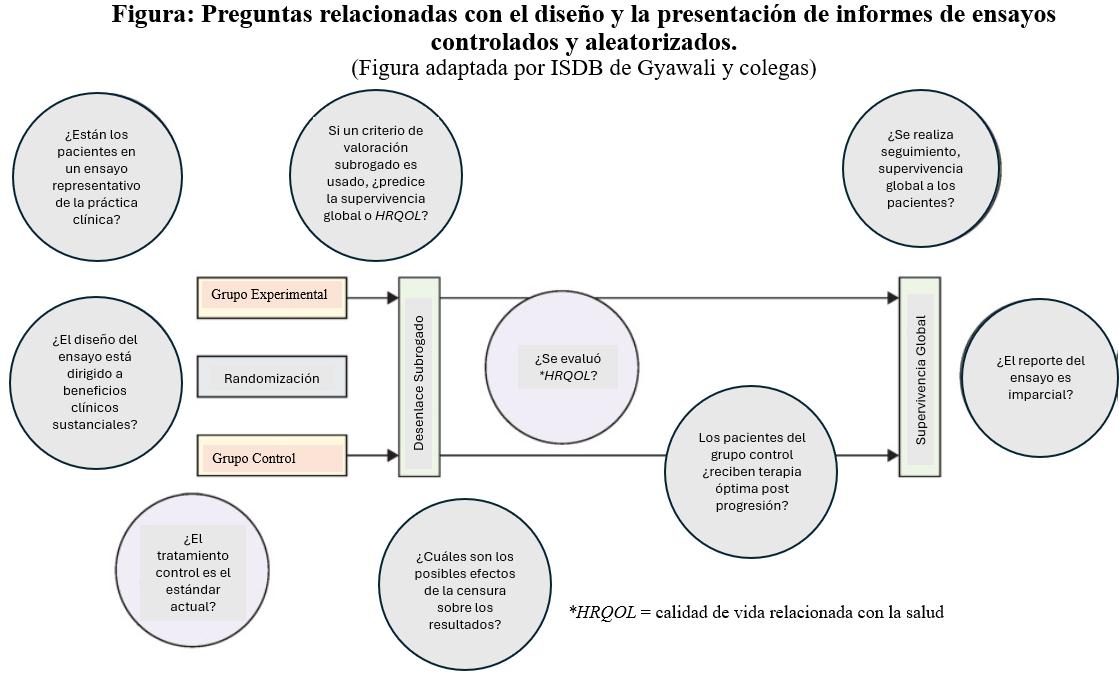 Fuente:
Fuente: Traducido por el equipo editorial de Salud y Fármacos a partir de la Figura:
Questions relating to the design and reporting of randomized controlled trials, adaptada por ISDB de Gyawali y colegas.
Lista de verificación para la presentación de informes de ensayos controlados aleatorizados (ECA) que evalúan terapias sistémicas
- El resumen debe contener:
- Una definición explícita del criterio de valoración principal
- El cociente de riesgos (hazard ratio) para el tiempo que transcurre hasta el evento – para el criterio de valoración principal y para la supervivencia global, con intervalos de confianza (IC) y una medida del beneficio absoluto, incluso si los datos de supervivencia global son inmaduros
- Un resumen objetivo de la toxicidad de grado 3-5, el tiempo vivido con toxicidad crónica, y la interrupción del tratamiento, sin términos subjetivos que reduzcan la toxicidad
- Una declaración sobre el efecto en la CVRS
- Debe incluirse un resumen de los resultados principales en un lenguaje comprensible para los pacientes
- La sección de métodos debe contener:
- Una declaración sobre cómo los pacientes o el público participaron en el diseño y la aprobación del estudio
- Justificación del tratamiento para el grupo control, que debe ser el estándar de atención vigente
- Justificación del criterio de valoración principal y, si no es la supervivencia global, evidencia de que se puede usar como sustituto de la supervivencia global o de la CVRS
- La base estadística para calcular el tamaño de muestra y para determinar el nivel del beneficio que el ensayo está diseñado para detectar o descartar con la potencia prevista
- Estrategias para reducir el abandono y la censura
- Planes para el cruce e información sobre la obligatoriedad de cruzar a los pacientes del grupo control para que reciban tratamiento experimental y su fuente de financiamiento
- Criterios para el análisis preliminar y para la interrupción temprana, incluyendo una indicación de que los ensayos paliativos solo se deben interrumpir prematuramente si se observa una mejora definitiva en la supervivencia global.
- La sección de resultados debe contener:
- Curvas del tiempo transcurrido hasta el evento, tanto para el criterio de valoración principal como para la supervivencia global (si no es el criterio de valoración principal), con las cifras en riesgo y las cifras de censurados debajo de las curvas.
- Una medida absoluta del beneficio.
- Motivos de abandono y censura, con un análisis de sensibilidad para determinar los posibles efectos en el resultado principal (puede incluirse en un apéndice en línea).
- Número de pacientes en el grupo control que cruzaron al tratamiento experimental tras la progresión de la enfermedad; tratamientos post progresión para todos los pacientes.
- Evaluación objetiva de la toxicidad, y se recomienda incluir una evaluación por parte del paciente.
- Declaración sobre si el ensayo cumple con el criterio de beneficio preplanificado de la Escala de Magnitud del Beneficio Clínico de la Sociedad Europea de Oncología Médica (European Scoiety for Medical Oncology Magnitude of Clinican Benefit Scale), con una declaración de que, en caso contrario, los resultados son negativos, independientemente del valor p
- Inclusión de la toxicidad temporal si la mediana de supervivencia global esperada es inferior a 12 meses
- La sección de discusión debe contener:
- Un resumen de los resultados principales
- Para hacer una evaluación integral de riesgos y beneficios, se deben discutir todos los tipos de toxicidad (p. ej., física, financiera y de tiempo)
- Se desaconseja la redacción del manuscrito por un redactor médico empleado o contratado por el patrocinador
