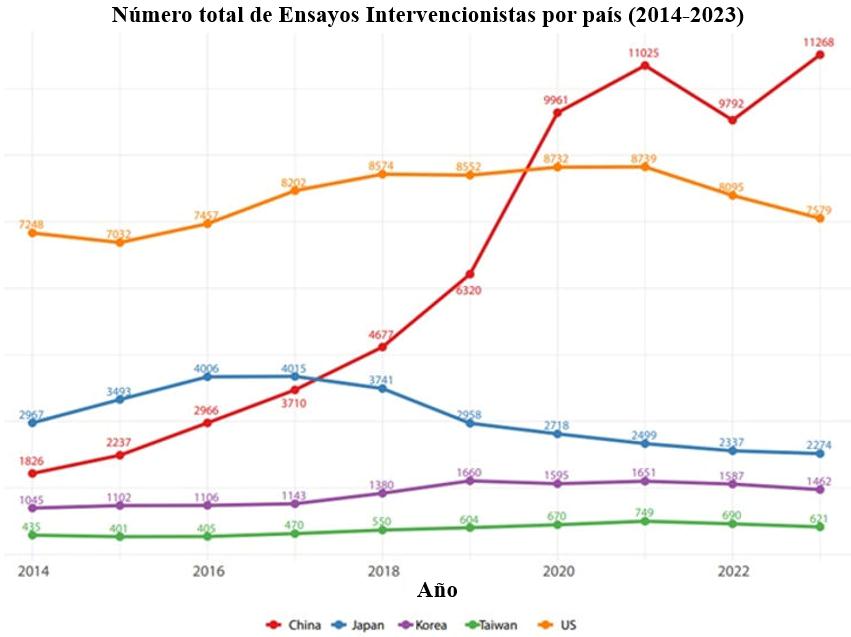
China es ahora el principal centro mundial de ensayos clínicos. Un nuevo estudio [1] basado en datos de múltiples registros de ensayos clínicos muestra que, en 2023 se registraron en China más de 11.000 ensayos clínicos intervencionistas, aproximadamente un 50% más que en EE UU.
Por supuesto, un mayor número de ensayos no equivale a un mayor avance en conocimiento científico útil. Por ejemplo, el Reino Unido destacó por haber generado evidencia sólida y útil sobre posibles tratamientos para la covid-19, precisamente porque centró sus esfuerzos en un pequeño número de ensayos amplios y bien diseñados.
No obstante, el nuevo estudio deja claro que China es ahora una potencia mundial en investigación clínica.
Preocupación por la transparencia
Esto es preocupante, ya que existen indicios de que la transparencia en los ensayos clínicos realizados en China podría ser considerablemente menor que en Europa o EE UU.
Estudios recientes, dirigidos por un becario de TranspariMED, revelaron que la legislación china no exige que las empresas y las universidades publiquen los resultados de los ensayos clínicos [2], y hallaron indicios de deficiencias en la divulgación de información por parte de las empresas biofarmacéuticas chinas que operan en el extranjero [3].
De igual manera, el nuevo estudio reveló que muchos ensayos clínicos realizados en China y otros países del este de Asia no se están registrando prospectivamente [1].
Brechas de datos en ensayos clínicos en Asia Oriental
Los autores del nuevo estudio también intentaron documentar cuántos resultados de ensayos clínicos nunca se han publicado en China, Japón, Corea del Sur y Taiwán, pero descubrieron que:
“Uno de los problemas importantes fue la dificultad para determinar si se había concluido el estudio. Los datos se extrajeron de varios registros de la plataforma International Clinical Trials Registry Platform (ICTRP), pero las diferencias en los formatos de los diferentes registros impidieron recuperar la información sobre si se había concluido el estudio, y solo había información sobre el estado de reclutamiento”.
“Cuando se accede a las páginas web (URL) del registro original se puede hacer una revisión directa de cada registro y fue fácil encontrar la información sobre la finalización del estudio en ClinicalTrials.gov. Sin embargo, en el caso de otros registros, fue difícil identificar con claridad el estado o las fechas de finalización del estudio. Por lo tanto, no pudimos evaluar comparativamente las tasas de notificación de resultados de los ensayos registrados en diferentes países”.
Una revisión reciente de Cochrane [4], basada en datos de más de 200 estudios, encontró que -a nivel global- el 47% de los resultados de ensayos clínicos no se publican, pero los estudios revisados provenían mayoritariamente del Atlántico Norte, lo que no responde a la pregunta sobre lo que sucede con los ensayos chinos (o indios, o japoneses).
Esta persistente brecha de conocimiento se debe en parte a la deficiente infraestructura de registro, pero también a que la mayoría de los científicos, reguladores y metainvestigadores siguen centrados en Europa y EE UU, de forma un tanto miope.
El desastre del registro global
Estas deficiencias persistentes en la infraestructura del registro global socavaron los esfuerzos de respuesta a la covid-19 en todo el mundo [5], y siguen impidiendo la obtención de una visión general de la investigación médica en curso y de los nuevos descubrimientos médicos.
(Por ejemplo, ¿por qué se requirió un estudio complejo para descubrir cuántos ensayos clínicos se están realizando en Asia Oriental y en qué áreas de enfermedad se centran?)
El equipo del estudio concluyó que:
“Muchos estudios, incluyendo los ensayos clínicos aleatorizados, no se registraron prospectivamente… Un problema crítico que surgió durante nuestro análisis fue la necesidad de mejorar el control de calidad de los registros de ensayos…”
“La inconsistencia en el formato entre los registros, incluyendo variaciones en la forma en que se registró la información, generó desafíos significativos para la estandarización de datos y así comparar lo que sucede en diferentes países. Por ejemplo, las categorias relacionadas con el diseño del estudio, como la asignación y la aleatorización, fueron considerablemente diferentes en los diferentes registros”.
“En ChiCTR [el registro chino], los tamaños de muestra objetivo para el grupo de control y los brazos de intervención múltiple se presentan en formato de texto, no como un número total. Esto requirió un esfuerzo adicional durante la extracción de datos. Si no se hace una estandarización adecuada de los datos de los ensayos y no se fortalece el control de calidad, aumenta el riesgo de acabar con registros de ensayos inexactos o incompletos, lo que podría resultar en interpretaciones erróneas”.
Por lo tanto, es crucial contar con mejores protocolos de registro y con controles de calidad adecuados, no solo para garantizar la precisión e integridad de los datos, sino también para fomentar la colaboración global y la transparencia en los ensayos clínicos.
¿La OMS al rescate?
La Organización Mundial de la Salud publicó recientemente una nueva guía sobre la notificación de resultados en los registros de ensayos clínicos [6], que incluye el requisito de que los registros incluyan un campo para las fechas de finalización.
Sin embargo, no está claro cuándo los numerosos registros que alimentan la base de datos global de la OMS adoptarán la nueva guía de la OMS.
Referencias