Ética, Derecho y Ensayos Clínicos
Regulación, Registro y Diseminación de Resultados
Sesgos en la ciencia médica por no publicar los resultados de los ensayos clínicos (Failure to publish the results of all clinical trials is skewing medical science)
The Economist, 27 de julio de 2015
http://www.economist.com/news/science-and-technology/21659703-failure-publish-results-all-clinical-trials-skewing-medical?fsrc=nlw|newe|27-07-2015|
Traducido por Salud y Fármacos
“Yo soy el que mira al paciente a los ojos y le dice que el ensayo clínico es beneficioso”, dice Tim Crater, un médico que hace investigación en la Clínica Hutchinson en Kansas. El Dr. Crater hace ensayos clínicos con medicamentos para las grandes empresas farmacéuticas. Afirma que los voluntarios están interesados en algo más que la promesa de pago. “Mucha gente quiere ayudar, son altruistas, hasta cierto punto, y quieren contribuir a avanzar la ciencia”. La experiencia del Dr. Crater es típica. Los que participan en los ensayos a menudo creen que están, de alguna manera, por pequeña que sea, contribuyendo al avance de la medicina y que su sufrimiento ayudará a otros.
Por desgracia, este no es siempre el caso. Aunque las compañías que realizan ensayos pertinentes tienen que informar a los que autorizan la comercialización de los medicamentos y dispositivos médicos, no tienen obligación de informar al público. Esto significa que estos ensayos no pueden ser examinados por terceros. Las agencias reguladoras los analizan para asegurarse de que lo productos aprobados, en teoría, son seguros y aportan algún beneficio. Pero los profesionales que los van a utilizar desconocen todos los detalles.
Algunas estimaciones sugieren que los resultados de la mitad de los ensayos clínicos nunca llegan a publicarse. La falta de acceso a esta información, a lo largo de varias décadas, ha deformado de forma sistemática la percepción sobre la eficacia de los medicamentos, dispositivos médicos e incluso de los procedimientos quirúrgicos. Y a veces estos errores de percepción han perjudicado a los pacientes.
En el 2007, EE UU, donde se suelen aprobar por primera vez la mayoría de los medicamentos disponibles en el mundo, modificó la ley para tratar de hacer frente a este problema. A excepción de algunas evaluaciones iniciales de seguridad, los ensayos clínicos tienen que registrarse en el sitio web, clinicaltrials.gov. Una vez concluido el ensayo, las compañías tienen un año para publicar los resultados. Eso, al menos, es la teoría. La práctica parece diferente.
Un lío impune
A principios de este año, un estudio publicado en el New England Journal of Medicine analizó los datos de clinicaltrials.gov para determinar el tiempo transcurrido entre la conclusión del ensayo clínico y la publicación de sus resultados. Se encontró que una vez transcurrido el periodo legal de un año, apenas se habían publicado los resultados del 17% de los ensayos patrocinados por la industria. Las empresas farmacéuticas no eran, sin embargo, las peores delincuentes. Sólo 8.1% de los ensayos financiados por los Institutos Nacionales de Salud, la principal agencia financiadora de investigación médica del gobierno estadounidense, habían publicado sus resultados durante el periodo establecido. Y sólo el 5,7% de los patrocinados por otras agencias gubernamentales e instituciones académicas lo fueron (ver gráfico). Por otra parte, a pesar de que la FDA, tiene el poder de multar a las empresas que no cumplen, nunca lo ha hecho.
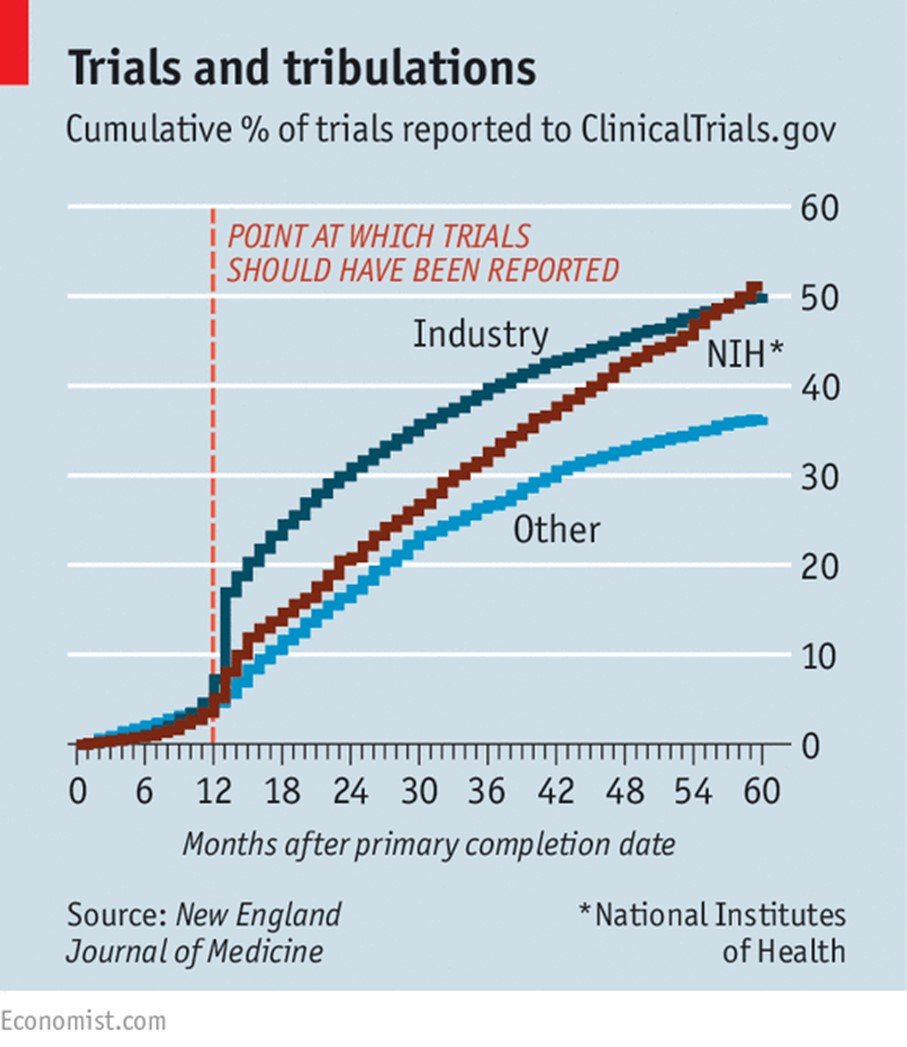
Se sospecha que los ensayos clínicos que no se publican tienden a ser menos favorables al producto en investigación. Las compañías farmacéuticas tienen un incentivo claro para quitar importancia a esos ensayos. Los investigadores académicos, sedientos de prestigio y financiamiento para sus próximos estudios, podrían preferir no perder el tiempo en la redacción de documentos si los resultados indican que el impacto es poco importante. Y las revistas también son culpables, porque tienen una tendencia clara a favorecer la publicación de artículos que muestran que algo funciona sobre los que muestran que no es así. El resultado es que muchos medicamentos aparentan ser mejores de lo que son.
Ben Goldacre, médico y escritor británico, es uno de los instigadores de una campaña internacional llamada AllTrials, que está diseñada para obligar a los investigadores a publicar la totalidad de sus ensayos clínicos. Uno de los medicamentos que menciona es el antidepresivo, reboxetina (cuyo nombre de marca es Edronax, de Pfizer), que había prescrito a sus pacientes. Dice que se publicaron un par de ensayos mostrando que era tan efectivo para la depresión como cualquier otro medicamento. Sin embargo, los datos no publicados, provenientes de ensayos clínicos que incluían al triple de personas que las que habían participado en los ensayos publicados, demostraron que no lo era.
Algo similar ocurrió con otra clase de antidepresivos- los inhibidores selectivos de la recaptación de serotonina (ISRS), como Prozac. Estos salieron al mercado a finales de 1980, pero no fue hasta 2006 que un análisis de los datos de todos los ensayos clínicos con ISRS que se habían entregado a la FDA en los últimos años demostró que su consumo entre adolescentes se asociaba a un aumento en el riesgo de suicidio. Esto se podría haber descubierto antes si todos esos datos hubieran estado disponibles al público. Una revisión independiente en 2008 mostró que el 94% de los ensayos con ISRS que se habían publicado sugerían que tenían efectos beneficiosos, mientras que solo el 51% de los ensayos clínicos entregados a la FDA (más numerosos, pero a menudo no publicados) llegaba a esa conclusión.
A veces puede que el daño no sea médico sino financiero. Desde 2006, el gobierno británico ha gastado £424 millones (US$660 millones) almacenando Tamiflu, un antiviral, con el fin de anticiparse a una pandemia de gripe. En el momento en que se tomó la decisión, el 60% de los datos de los ensayos con este fármaco permanecían inéditos. Ahora se ha concluido el análisis, y los resultados suscitan dudas sobre la eficacia de Tamiflu en reducir los ingresos hospitalarios, y han cuestionado si la creación de la reserva se puede calificar como dinero bien gastado.
No son únicamente los ensayos con medicamentos los que dejan de publicarse. En 1994, un estudio sobre una cirugía para el cáncer de colon encontró que una segunda cirugía, entre aquellos que experimentaron recidivas, para extirpar el carcinoma no afectaba la esperanza de vida. Si esta información se hubiera publicado en ese momento, en lugar de en 2014, un sinnúmero de pacientes muy enfermos podrían haberse ahorrado la cirugía. También, y no menos importante, se hubiera cuestionado antes la utilidad de repetir este tipo de cirugía en otras partes del cuerpo.
Apertura
Hay indicios, sin embargo, de que va a haber un cambio real. AllTrials y los grupos que lo apoyan, como Sense About Science, una organización benéfica británica, han ayudado a reglamentar la legislación europea de los ensayos clínicos que entrará en vigor en 2016. Esta ley, al igual que la americana, requerirá que se registren los ensayos clínicos y se publiquen sus resultados. En EE UU, por su parte, los reguladores están proponiendo una normativa que aclarará y ampliará el ámbito de aplicación de la legislación vigente, con el fin de eliminar los problemas que han dificultado que se pudiera exigir su cumplimiento.
Otra razón para pensar que ahora las empresas cumplirán la legislación es que sus accionistas están cada vez más preocupados por la falta de datos. Helena Viñes Fiestas, que estudia la sostenibilidad financiera de las empresas en BNP Paribas Investment Partners, un gran banco, dice que muchos inversionistas en compañías farmacéuticas están a favor de que se publique la información, y están pidiendo a las empresas en las que invierten que publiquen sus planes para asegurar que los ensayos ya concluidos, los que están en curso y los que se hagan en el futuro sean registrados y se publiquen sus resultados.
Este deseo de transparencia por parte de los accionistas puede sorprender a los cínicos, porque podría disminuir sus ventas. Pero los inversores de largo plazo prefieren la verdad de inmediato, para reducir el nivel de riesgo en sus carteras. Según la Sra. Viñes Fiestas, alrededor del 30% del valor de una compañía farmacéutica está ligado a los resultados de los ensayos.
También hay un riesgo más directo para las empresas que no publican todos los resultados de los ensayos. Entre 2007 y 2014, las 21 grandes compañías farmacéuticas que la Sra Viñes Fiestas monitorea acumularon, en conjunto, multas por US$40.000 millones. Sus estudios mostraron que alrededor de la mitad de esta suma fue por no haber informado claramente sobre los efectos secundarios, que a menudo se debe a que los ensayos clínicos que proveen esta información permanecen inéditos.
Sense About Science está trabajando en un índice, que se publicará a finales de este año, para evaluar a las empresas farmacéuticas según el alcance de su compromiso en publicar todos los ensayos. Esto, sin duda, va a ser de interés para los accionistas.
El futuro, entonces, puede ser más transparente. Pero el pasado permanece opaco. Es probable que se haya ocultado información de la mayoría de medicamentos que se usan hoy, en forma de ensayos no publicados, pero nadie (excepto los que los hacen) sabe cuantos. Algunas empresas han comenzado a abrir sus archivos. GlaxoSmithKline ha publicado los resultados de todos los ensayos que se han concluido desde que se inició la compañía (a través de una fusión) en 2000. Pfizer, fundada en 1849, se remonta a 2007. Otros, sin embargo, no hacen nada.
A principios de este año, el Instituto de Medicina, la academia nacional de médicos de Estados Unidos, dijo en un informe que compartir la información de ensayos antiguos ofrece riesgos y beneficios, y debe considerarse caso por caso. Una de las cosas que preocupaba al instituto era si los participantes en los ensayos antiguos, que a menudo se hicieron antes de que los cambios tecnológicos hicieron que la pregunta fuese relevante, otorgaron el consentimiento para compartir la información que los nuevos estándares de transparencia requieren.
Como muestra esta observación, desenterrar el pasado tiene sus peligros. Pero las ventajas de conocer la verdad acerca de los ensayos anteriores indican que vale la pena tratar de superarlos. En cualquier caso, no hay excusa para no hacerlo con los futuros ensayos. Sólo cuando esto se logre, aquellos que, como el Dr. Crater, realizan los ensayos, podrán seguir mirando a sus pacientes a los ojos y decirles que su contribución realmente está teniendo un impacto.