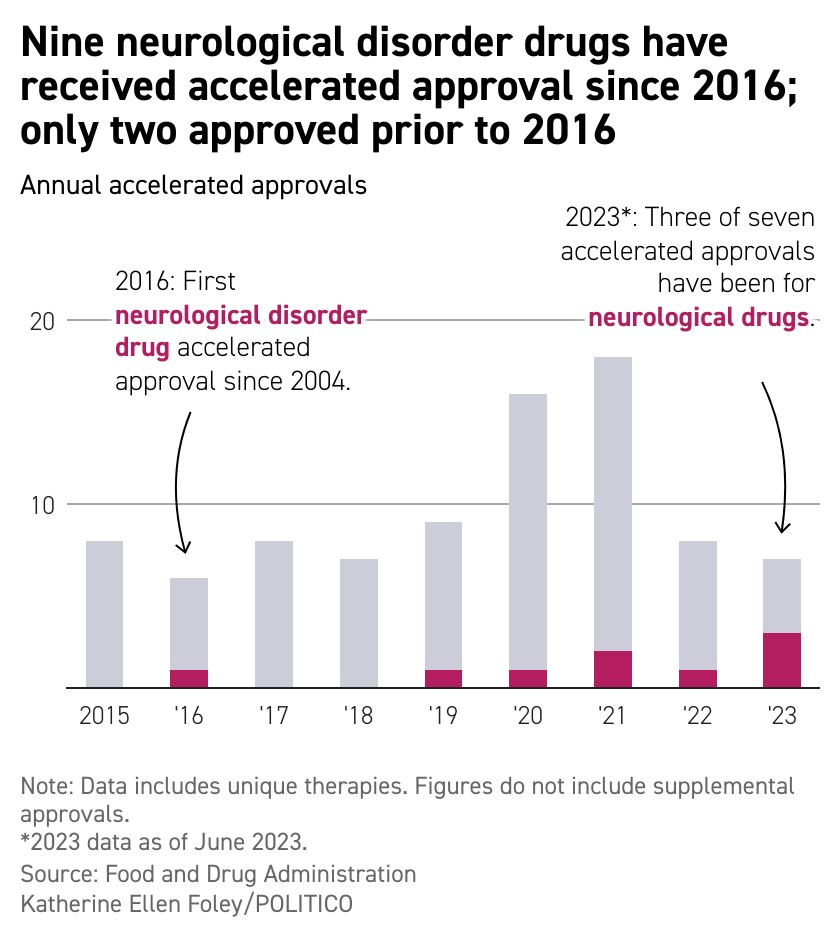
Durante los últimos siete años, la FDA ha ido aumentado la cantidad de medicamentos para tratar problemas neurológicos que revisa a través de su vía de aprobación acelerada. Algunos de los medicamentos aprobados fueron los primeros tratamientos de ese tipo. Pero algunos expertos temen que esta vía, que se utiliza para que los pacientes sin opciones tengan acceso más temprano a nuevos medicamentos, no esté ayudando a los pacientes.
La aprobación acelerada se basa en el impacto del medicamento en indicadores indirectos o subrogados, en ensayos clínicos de fase temprana. Si los fabricantes de medicamentos logran demostrar que un nuevo tratamiento mejora un indicador indirecto que sugiere posibles beneficios para los pacientes, la FDA puede aprobarlo condicionalmente para que llegue antes a los pacientes. Para enfermedades como el VIH o el cáncer, algunas medidas indirectas han predicho el valor de un fármaco.
Pero en el caso de las enfermedades neurológicas, los indicadores indirectos son más confusos. No hay relaciones causales claramente establecidas entre algunos indicadores y futuras mejoras en la salud del paciente.
“No es necesario tener un doctorado en bioestadística para entender que el hecho de que ‘A’ y ‘B’ coexistan no significa que A cause B”, dijo el Dr. Caleb Alexander, profesor de epidemiología en la Escuela de Salud Pública Bloomberg de Johns Hopkins.
Después de su comercialización, los fabricantes de medicamentos tienen que hacer ensayos confirmatorios para demostrar que las terapias que se aprueban por la vía acelerada son efectivas, o corren el riesgo de que la FDA revoque su aprobación. Pero los ensayos pueden tardar años en completarse y, a menudo, se retrasan.
El año pasado, el Congreso otorgó a la FDA poderes adicionales para retirar del mercado los medicamentos de eficacia no probada cuando los fabricantes no proporcionen evidencia adicional con la suficiente rapidez. Pero la Agencia no los ha utilizado.
Cherie Duvall-Jones, portavoz de la FDA dijo “Estamos evaluando nuestros nuevos poderes legales y viendo la forma de implementarlos”.
Los pacientes sin otras opciones tienen todas sus esperanzas en los medicamentos aprobados por la vía aceleradas. Muchas de las enfermedades que tratan son tan raras y tan rápidamente fatales que sería imposible realizar un ensayo clínico tradicional, dijo Paul Melmeyer, vicepresidente de políticas públicas y defensor de los pacientes en la Asociación de Distrofia Muscular. “No tenemos opciones”, dijo.