ACUERDOS DE LIBRE COMERCIO Y COSTO DE LOS MEDICAMENTOS EN CANADÁ*
Joel Lexchin, Departamento de Medicina Familiar y Comunitaria, Universidad de Toronto, y Escuela de Políticas y Administración de Salud, Universidad de York
Introducción y antecedentes
Durante las dos últimas décadas una de las palabras de moda en todo el mundo ha sido globalización. La globalización “no es únicamente una moda económica y una tendencia pasajera. Ahora, es un sistema internacional de muy amplio alcance, con sus propias reglas y lógica, moldeando la política interna y las relaciones internacionales de casi cada país”.1 La globalización ha ido de la mano con el liberalismo comercial y en medio de todo ello se encuentra la industria farmacéutica.
En la escena internacional los medios de comunicación han estado llenos de noticias relacionando a la industria farmacéutica con los acuerdos comerciales: la demanda legal contra el gobierno sudafricano hecha por 39 compañías farmacéuticas multinacionales alegando que sus leyes violaban los acuerdos comerciales sobre patentes; las restricciones sobre las importaciones y el uso de medicamentos genéricos en países en vías de desarrollo que mantienen los precios de los medicamentos contra el VIH/SIDA a niveles semejantes a los de EE.UU. Aquí en Canadá, ha habido un intenso debate desde mediados de los ochentas sobre la aplicación de las leyes canadienses de patentes a los productos farmacéuticos y su impacto en el precio de los fármacos.
De hecho, la industria farmacéutica ha estado liderando la implantación de leyes de patentes más estrictas y promoviendo el programa de comercio de EE.UU. El Cuadro 1 indica, y este punto se discutirá más abajo, que en Canadá la industria farmacéutica, los derechos de propiedad intelectual y los acuerdos comerciales han estado íntimamente relacionados.
Durante los años sesenta, tres informes señalaron que los precios de los fármacos en Canadá eran de los más caros del mundo y los tres identificaron a las leyes de protección de patentes como una de las causas más importantes de los altos precios.2,3,4 La decisión del partido liberal, entonces en el gobierno, fue de extender las licencias obligatorias y permitir a las compañías recibir una licencia para importar medicinas en Canadá. La licencia obligatoria es esencialmente un permiso que niega los efectos de la patente. Teóricamente, la compañía propietaria de la patente de un fármaco tiene el monopolio de su venta hasta que expira la patente. Aunque, si otras compañías solicitan y reciben la licencia obligatoria de un fármaco, entonces ellas pueden vender su propia versión de ese fármaco antes de que la patente haya expirado. El aspecto obligatorio significa que la compañía propietaria de la patente no puede impedir que se otorgue la licencia.
Cuadro 1: Acuerdos comerciales y cambios en las leyes de patentes canadienses
|
Acuerdo comercial |
Fecha en que tomó poder |
Partes |
Cambio acompañando a la ley canadiense de patente |
Fecha en que la ley tomó efecto |
Características principales |
|
Acuerdo de libre comercio (ALC) |
1987 |
Canadá, Estados Unidos |
Proyecto de ley C-22 |
1987 |
Nuevos fármacos exentos de licencia obligatoria por 7 años; exención prolongada a 10 años si el ingrediente activo se fabricó en Canadá |
|
Tratado de Libre Comercio de América del Norte (TLC) |
1994 |
Canadá, Estados Unidos, México |
Proyecto de ley C-91 |
1993 |
Se abolió la licencia obligatoria (retroactiva a dic. 1991). La vida de la patente cambió de 17 años desde que se obtuvo la patente a 20 años desde la fecha en que se solicitó (retroactiva a oct. 1, 1989) |
|
Tratado relacionado con los aspectos de los derechos de la propiedad intelectual (TRIPS)* |
1995 |
Mundial |
Proyecto de ley C-91 |
1993 |
Igual que el anterior |
*TRIPS fue parte del paquete que creó la organización mundial del comercio (OMC). Existen otros 4 acuerdos dentro de la OMC que tienen un impacto en la salud: Acuerdos Generales Tarifarios y Comerciales (GATT), Acuerdo General de Comercio y Servicios(GATS), Acuerdos en Barreras Técnicas para el Comercio (TBT) y Acuerdos en la aplicación de medidas sanitarias y fitosanitarias (SPS).
Por razones obvias la industria farmacéutica multinacional se opuso vigorosamente a las licencias obligatorias, pero sin ningún aliado importante, ni dentro del país ni fuera del país, esa oposición nunca produjo resultados. Desde los inicios de los años ochenta esa situación cambió significantemente. Durante esa época EE.UU. tenía un balance comercial internacional negativo muy grande. Uno de los factores que se identificó como contribuyente importante a este problema era la pérdida de ventas debidas a la piratería de la industria de la diversión (música y películas) y farmacéutica. Piratería significa aquí, que los países con derechos de propiedad intelectual “débiles” estaban copiando los bienes americanos y vendiéndolos a precios muy por debajo de los de las compañías americanas.
En 1981 el presidente de los EE.UU. Reagan nombró al Sr. E. Pratt para dirigir la comisión asesora de comercio del sector privado de más alto nivel en el gobierno. El Sr. Pratt era también presidente de Pfizer Inc., una compañía farmacéutica multinacional, y con su ayuda el tema de los derechos de propiedad intelectual y las patentes para la protección de los productos farmacéuticos se convirtió en una prioridad dentro de la política comercial de los EE.UU.
Como resultado, las políticas canadienses sobre la protección de patentes y las licencias obligatorias se convirtieron en un tema principal en las relaciones de los EE.UU. y Canadá. Cuando Reagan se reunió con el primer ministro B. Mulroney en la “reunión de Shamrock” en la ciudad de Québec en marzo de 1985, uno de los temas mas importantes fue la discusión sobre las patentes de los fármacos. En octubre de ese año el reporte anual del representante de comercio de los EE.UU. sobre contiendas con los socios comerciales de los EE.UU., señaló a la legislación canadiense de los fármacos como uno de los contendientes. El jefe representante del comercio de los EE.UU. C. Yeutter reprochó al partido conservador, que ahora estaba en el poder, por no lograr los tan esperados cambios en las leyes canadienses de patentes de los fármacos. G. Bush, vicepresidente de los EE.UU. durante ese tiempo, se quejó públicamente acerca del retraso en los cambios cuando visitó Ottawa en junio de 1986.6
Al mismo tiempo que la protección de patentes pasó a ser el centro de los intereses de los EE.UU. los conservadores mantuvieron una política de libre comercio con los EE.UU. Los conservadores continua y vigorosamente negaban que existiera relación alguna entre los acuerdos de libre comercio y los cambios en las licencias obligatorias,7,8 pero los hechos hacían que las negativas fueran difíciles de creer. B. Merkin, el negociador (deputy chief) de los EE.UU. en las reuniones de libre comercio, dijo: “Ottawa no quiso que los derechos de propiedad intelectual se incluyeran en las negociaciones de libre comercio. No quieren aparentar como que están negociándolos como parte del tratado de libre comercio. Todos los cambios que ellos hicieron, querían que se vieran como que se hacían, “en el interés de Canadá”. . . para nosotros era un tema de mucha prioridad.” 5
Los americanos presentaron evidencias claras de los lazos entre los dos temas el día después de la exitosa conclusión del Convenio de Libre Comercio (Free Trade Agreement FTA). Un resumen de los EE.UU. del convenio menciona que contiene una cláusula para “avanzar hacia el establecimiento de una protección adecuada y efectiva de los productos farmacéuticos en Canadá por medio de la liberalización de las provisiones de licencias obligatorias.”9 Fue sólo después de que los conservadores canadienses pidieran que se quitara de esa sección que se eliminó definitivamente del texto final del convenio.
Como respuesta para el libre comercio con EE.UU. el gobierno conservador presentó un proyecto de ley C-22 que se aprobó en diciembre 1987. Lo esencial del proyecto de ley fue la concesión a las compañías productoras de nuevos fármacos de un mínimo de siete años de protección contra la licencia obligatoria. Un oficial de alto rango de la administración de los EE.UU. dijo: “Queremos algo mejor que eso (refiriéndose al proyecto de ley) en un acuerdo de libre comercio,” y para otro oficial también en una posición alta fue “apenas pasable.” La Asociación de Fabricantes de Medicamentos de los EE.UU. (PMA) estaba dispuesta a apoyar la ley, pero dijo que la industria de los EE.UU. “desearía ver un nivel de protección similar al que existe en Europa occidental y en los EE.UU. . . . Canadá está fuera de cintura.”10
Las leyes canadienses de patentes cambiaron otra vez a principios de los años noventa. Esta vez la pelea fue sobre el proyecto de ley C-91 que abolió las licencias obligatorias y dio a las compañías multinacionales 20 años de protección de patentes para sus productos. En este caso en lugar del FTA fue el enorme deseo canadiense para firmar el Tratado de Libre Comercio de América del Norte (NAFTA) y el acuerdo del GATT que coincidían con los intereses de la industria farmacéutica. Aunque existe una opinión de que las licencias obligatorias pudieran haber sido teóricamente posibles bajo estos acuerdos11 el gobierno canadiense los uso como base para eliminar completamente las licencias obligatorias.
E. Pratt, sistemáticamente hizo que se incluyeran los derechos de propiedad intelectual en la agenda del GATT. Primero formó alianzas con las industrias cinematográficas y de ordenadores de los EE.UU. y ayudó a formar el Comité Intelectual de Derechos de Propiedad (Intellectual Property Rights Committee IPRC) con las trece corporaciones más grandes de los EE.UU. Después, con el apoyo de C. Yeutter, Pratt buscó aliados en Europa y en Japón y eventualmente se ganó a las dos organizaciones industriales más grandes, la Unión de Industrias de la Comunidad Europea (Union of Industries of the European Community UNICE) en Europa y la Keidanren en Japón.12 Desde el punto de vista de IPCR, lo que hizo al GATT y a NAFTA candidatos ideales para asegurar que se cumpliera con los derechos de propiedad fue su jurisdicción sobre el comercio. Al elegir al GATT como mecanismo para exigir el cumplimiento de la ley de patentes estaba implícita la amenaza de represalias, es decir, quitarles el acceso al mercado internacional a los productos exportados por los países que no refuerzan un estándar de derechos de propiedad intelectual como los del IPRC.11
Después de haber relatado los antecedentes históricos y la experiencia canadiense con los acuerdos comerciales, los derechos de propiedad intelectual y los medicamentos la siguiente parte de este documento va a examinar los efectos que estos cambios han tenido en los precios de los medicamentos que necesitan receta. Finalmente, concluiré analizando lo que ha pasado recientemente con las quejas contra Canadá en la OMC y las consecuencias de las negociaciones sobre el Área de Libre Comercio de las Américas (Free Trade Area for the Americas FTAA)
Precios de los medicamentos
La Junta de Revisión de los Precios de las Medicinas de Patente (Patented Medicine Prices Review Board (PMPRB) se estableció casi al mismo tiempo que el proyecto de ley C-22 para proteger los intereses de los consumidores. La Junta tiene poderes para limitar los precios de los nuevos medicamentos patentados y evitar el alza de los medicamentos de patente ya existentes en un porcentaje superior al de la tasa de inflación. En relación a estos objetivos la Junta ha tenido éxito. El informe del 2000 demuestra que entre 1988 y 2000 la tasa de inflación de los precios de los medicamentos de patente ha aumentado justamente 0.8% por año. Cuando los precios canadienses se comparan con los promedios de otros siete países (Francia; Alemania, Italia, Suecia, Suiza, Inglaterra, EE.UU.) la razón de los precios se ha reducido de 1,23 en 1987 a 0,92 en 2000.13 Sin embargo, estas cifras esconden una falla básica en la habilidad de la Junta para proteger a los consumidores de precios altos cuando vemos el precio que pagan por la receta.
El precio promedio por receta (excluyendo el gasto por dispensación) en Ontario, ha subido de $24,58 en 1993 a $27,74 en 1997, un aumento anual de 3,1% comparado con un aumento del índice de precios al consumidor de 1,4%. Más de la mitad del aumento en el precio de la receta es debido a la introducción de nuevos medicamentos, específicamente (desde 1987) nuevos medicamentos de patente. Los precios de las recetas de nuevos medicamentos de patente se incrementaron un 20,9% por año entre 1993-97 comparado a 6,6% para los precios de los medicamentos de patente que fueron patentados antes de 1987 y 4,1% para los medicamentos sin patente.14 (Ver Cuadro 2).
Cuadro 2: Aumento en el precio de los medicamentos recetados, 1993-1997*
|
Año |
Costo por receta |
||
|
|
Nuevos medicamentos de patente |
Medicamentos de patente ya existentes |
Medicamentos sin patente |
|
1993 |
36.03 |
49.43 |
17.12 |
|
1994 |
39.98 |
52.45 |
17.94 |
|
1995 |
46.76 |
56.83 |
18.28 |
|
1996 |
61.18 |
59.15 |
18.83 |
|
1997 |
76.88 |
63.70 |
20.10 |
|
Promedio de aumento anual 1993-1997 (%) |
20.9 |
6.6 |
4.1 |
*Incluye el costo de fabricación y de distribución; excluye los gastos de dispensación.
Fuente: Green Shield, Canadá
Los médicos han estado substituyendo los viejos medicamentos por los nuevos más costosos, haciendo aumentar el precio de la receta promedio, aunque no exista una evidencia clara de que la gran mayoría de estos medicamentos nuevos tengan ventajas terapéuticas significativas sobre los medicamentos ya existentes.15 Para demostrar este aumento en el uso de los nuevos y caros medicamentos, se puede tener en cuenta que entre 1995 y 2000, el porcentaje de ventas de medicamentos de patente del total de ventas medicinas aumentó de 43,9% a 63%.13
El recetar los medicamentos nuevos, que son más caros que los antiguos aunque no necesariamente menos efectivos, no fue algo que comenzó en 1987. El vicio ya estaba incrustado desde que Canadá adoptó las licencias obligatorias. Lo que es diferente es que, después del proyecto de ley C-91, aumentó el tiempo que debía de transcurrir antes de que se pudieran comercializar los genéricos equivalentes a los nuevos medicamentos de patente. Antes de 1987 los genéricos salían al mercado entre cinco y siete años después de la salida de medicamento original. El primer genérico tenía aproximadamente un precio 25% por debajo del medicamento de marca y cuando había tres o cuatro genéricos entonces la diferencia de precio era de 50% 16 (Figura 1). En ausencia de licencia obligatoria el medicamento original típicamente se encuentra en una situación de monopolio de unos 12-13 años. (Los primeros 7 a 8 años de la vida de la patente se usan en ensayos clínicos y el proceso de aprobación del medicamento). La ley C-91 ha retrasado la entrada de los genéricos en cerca de 7 años, pero también hay que tener en cuenta que generalmente, para cuando los genéricos aparecen, las ventas del producto de marca ya han comenzado a bajar, y entonces el ahorro que resulta de la substitución del de marca por el genérico es menor.
Una conclusión que parece ser inevitable es que el interés de los consumidores canadienses en obtener las recetas a un precio razonable ha sido sacrificado en aras de los acuerdos comerciales.
Figura 1: Relación entre el número de compañías que venden un medicamento y la diferencia de precio entre la versión menos y más cara (número de medicamentos en paréntesis).
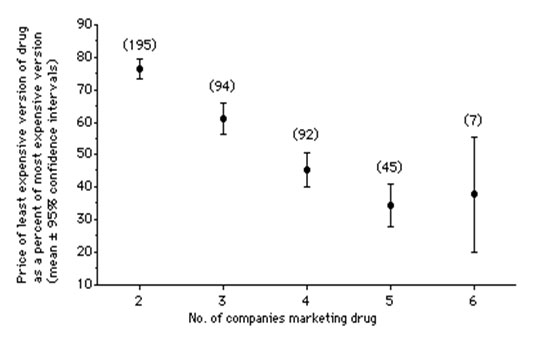
Fuente: Lexchin16
El presente
Todavía se siente el impacto del TRIPS en Canadá. En tiempos recientes ha habido dos ataques contra Canadá en la OMC. La Unión Europea se quejó de una apartado de la ley canadiense de patentes que permitía a los fabricantes de genéricos comenzar a probar, fabricar y almacenar fármacos para la venta antes de la expiración de la patente. Cuando Canadá después del 1 de octubre de 1989 extendió la duración de las patentes de 17 a 20 años, el cambio no se hizo retroactivo. Los EE.UU. reclamaron que un grupo de 30 medicamentos, que se patentaron antes de octubre 1989, debía también recibir 3 años más de vida de su patente. (La queja de los EE.UU. no se refiere únicamente a los medicamentos, sino también a todos los productos a los que se les otorgó patentes antes de octubre de 1989 y estaban todavía vigentes).
Canadá perdió el caso contra los EE.UU. 17 y la OMC también ordenó a las compañías de genéricos que no almacenaran medicamentos para la venta antes de que expirara la patente.18 Como resultado de estas decisiones, a mediados del 2001 las leyes canadienses de patentes fueron enmendadas otra vez más con la aprobación del proyecto de ley S-17. De acuerdo a la Asociación Canadiense de Fabricantes de Medicamentos, el brazo fuerte del lobby de la industria de genéricos, la extensión de la patente a los 30 medicamentos añadirá alrededor de $40 millones al costo de los medicamentos canadienses de receta.19 La prohibición a las compañías de genéricos de almacenar medicamentos hasta que la patente expire retrasará la venta de los medicamentos genéricos por meses.
A pesar de los cambios que Canadá ha hecho a sus leyes de patente al iniciar FTA, NAFTA, TRIPS y las recientes reglas de la OMC, la industria farmacéutica multinacional no está satisfecha con los resultados. En febrero del 2000, la Asociación Americana de Fabricantes de Fármacos, (Pharmaceutical Manufacturers Association of America Asociación PhRMA), recomendó que el gobierno de los EE.UU. pusiera a Canadá en la lista de los países bajo vigilancia prioritaria especial “Especial 301”, lista que se usa para presionar a los países para que modifiquen sus reglas de comercio.20 La lista de problemas presentada por PhRMA incluyó la falla de Canadá en ampliar la protección de las patentes a los fármacos anteriores a octubre 1989 y el permitir a las compañías de genéricos almacenar medicamentos antes de la expiración de la patente. PhRMA también acuso a Canadá de violar la sección del acuerdo TRIPS concerniente al registro de los datos (datos enviados para demostrar que el medicamento es seguro y efectivo). Para obtener el permiso de vender medicamentos, las compañías de genéricos normalmente demuestran que sus productos son bioequivalentes al producto de patente (esto es, que el genérico es químicamente similar y que trabaja de la misma manera en el cuerpo humano) y entonces basa la seguridad del producto en los datos del medicamento patentado para obtener el permiso. En muchas ocasiones, sí una compañía de genéricos no puede utilizar los datos de inscripción ya existentes, no puede poner en venta la versión genérica de producto patentado; y si tiene que generar de nuevo los datos de seguridad, los consumidores sufren las consecuencias del retraso en la introducción de la versión genérica.
Canadá comúnmente permite a las compañías de genéricos usar los datos de registro producidos por las compañías multinacionales cuando presentan a los productos genéricos para su registro. Según la interpretación de PhRMA del artículo 39.3 de TRIPS, Canadá no ofrece suficiente protección a los datos de inscripción. PhRMA también ve las acciones canadienses “como un precedente negativo para los países menos desarrollados.”20 Como ha sucedido en el pasado, cuando se trata de Canadá y del tema de patentes, PhRMA siempre encuentra quien le haga caso en el gobierno de los EE.UU. y en abril del 2001 los EE.UU. pusieron de nuevo a Canadá en su lista especial 301 citando como razón la falta de protección de los datos de los medicamentos. (21)
El futuro
La industria multinacional todavía sigue pidiéndole más concesiones a Canadá. Una de las metas clave de la industria es “la restauración del periodo de la patente”. Las multinacionales quieren que Canadá haga lo mismo que los EE.UU., la UE y Japón y que extienda el período de protección de patentes para recuperar el tiempo que lleva el proceso regulatorio de aprobación de los medicamentos.22 Puede ser que la industria logre sus objetivos en las negociaciones del Tratado de Libre Comercio de las Américas (FTAA). El borrador de la sección de la FTAA sobre los derechos de propiedad intelectual se encuentra entre corchetes, lo que significa que todavía no se ha llegado a un acuerdo. Eso hace imposible decir precisamente qué es lo que “hay” en FTAA, debido a que una sola modificación puede ser seguida por otra que directamente la neutraliza. Aunque, entre las proposiciones que aparecen en el resumen de los EE.UU. para la FTAA se encuentran unas que restaurarían el periodo de las patentes y que aplicarían muchas más reglas específicas sobre del uso de los datos de inscripción.23
Conclusiones
La globalización en general y los tratados comerciales en particular han tenido un efecto definitivo en los temas farmacéuticos en Canadá. De hecho, la participación intensa de la industria farmacéutica en moldear los tratados en los que Canadá ha tomado parte, aseguraba que habría cambios significativos. El precio de una receta se ha incrementado considerablemente como resultado del aumento de tiempo requerido para que los medicamentos genéricos equivalentes salgan al mercado. Se sigue erosionando la habilidad de Canadá para controlar su propia política farmacéutica. Así lo demuestra la reciente aprobación del proyecto de ley S-17 como respuesta a las decisiones de la OMC. Las negociaciones que se están llevando a cabo en la estructuración de FTAA pueden llevar a un deterioro aún mayor de los precios de los medicamentos en Canadá.
Referencias
Friedman TL. The lexus and the olive tree. Nueva York: First Anchor Books; 2000.
Restrictive Trade Practices Commission. Report concerning the manufacture, distribution and sale of drugs. Ottawa: Queen’s Printer; 1963.
Royal Commission on Health Services. Report . Ottawa: Queen’s Printer; 1964.
Canada, House of Commons. Second (Final) Report of the Special Committee of the House of Commons on Drug Costs and Prices. Ottawa: Queen’s Printer; 1967.
McQuaig L. The Quick and the dead. Toronto: Viking; 1991.
Sawatsky J, Cashore H. Inside dope. This Magazine 1986; 20( 3): 4-12.
Crane D. Drug bill concessions seem tied to trade talks. Toronto Star; 7 de diciembre de 1986: B1.
Howard R. MPs say Tories made deal on drug bill. Globe and Mail 16 de octubre de1987: A13.
Auerbach, S. U.S. bowed to Canadian demands to change pact. Washington Post; 17 de octubre de 1987: G2.
Lewington J. Drug-patent bill not enough to satisfy U.S. on free trade. Globe and Mail; 13 de agosto de 1987: A1.
Dillon J. On feeding sharks: Patent protection, compulsory licensing, and international trade law . A study prepared for the Canadian Health Coalition; 4 de marzo de 1997.
Ostry S. Governments and corporations in a shrinking world. New York: Council on Foreign Relations; 1990.
Patented Medicine Prices Review Board. Annual report 2000. Ottawa: PMPRB, 2001.
Green Shield Canada. Analysis of drug claim costs 1993-1997. Toronto, October 1998.
A look back at 2000: overabundance and deregulation. Prescrire International 2001;10:52-4.
Lexchin J. The effect of generic competition on the price of prescription drugs in the Province of Ontario. CMAJ 1993;148:35-8.
MacKinnon M. WTO rejects patent law appeal. Globe and Mail; 19 de septiembre de 2000: B10.
Scoffield H. WTO upholds drug patent rule. Globe and Mail; 18 de marzo de 2000:B3.
Battle to repeal automatic injunctions against generic drug approvals moves to the fall. CDMA Viewpoint; Verano 2001:1,6.
Priority watch country: Canada. Submission of PhRMA for the "Special 301" Report on Intellectual Property Barriers; 18 de febrero de 2000. http://www.phrma.org/policy/aroundworld/special301/canada.phtml. Accedido: 17 de octubre de 2001.
McKenna B. U.S. puts Canada on special watch list. Globe and Mail; 1 de mayo de 2001: B6.
Canada’s Research-Based Pharmaceutical Companies. 2000-2001 Annual Review. Ottawa: Rx&D, nd.
Essential Action preliminary assessment of the FTAA intellectual property proposals’ effect on access to medicines. 3 de Julio de 2001. www.cptech.org/ip/health/trade/weis07032001.html. Accedido: 17 de octubre de 2001.