Solicitudes y Retiros del Mercado
Olaratumab. Tras fracaso clínico, Lilly retirará el medicamento oncológico aprobado por la FDA (Lilly to withdraw FDA-approved cancer drug after clinical failure)
Andrew Dunn
biopharmaDIVE, 25 de abril 2019
https://www.biopharmadive.com/news/lilly-to-withdraw-fda-approved-cancer-drug-after-clinical-failure/553443/
Traducido por Salud y Fármacos
Resumen de Dive:
Eli Lilly dijo el jueves que está retirando su medicamento contra el cáncer olaratumab Lartruvo del mercado global, aproximadamente tres meses después de revelar el fracaso del medicamento en un estudio de Fase 3.
La FDA aprobó condicionalmente Lartruvo en octubre de 2016 como tratamiento de primera línea para ciertos sarcomas de tejidos blandos. Sin embargo, el ensayo confirmatorio de Lilly fracasó, ocasionando que la farmacéutica de Indianápolis suspendiera su promoción en enero.
Lilly ha establecido un programa para permitir que los pacientes que ya están tomando el medicamento sigan recibiéndolo, incluso después de su retirada el mercado, siempre y cuando se informe a los pacientes sobre los resultados del estudio y los riesgos de continuar con la terapia. “El establecimiento de este programa brindará a los pacientes que actualmente están tomando Lartruvo la oportunidad de continuar su programa de tratamiento sin interrupciones”, dijo Anne White, presidenta de Lilly Oncology, el 25 de abril en una declaración.
Evaluación de Dive:
Lartruvo (olaratumab) fue el primer fármaco aprobado para el sarcoma de tejidos blandos en más de cuatro décadas, y en ese momento ofrecía a los pacientes con un tumor difícil de tratar otra opción, además de la doxorrubicina, una quimioterapia.
La aprobación de la FDA se basó en datos de un estudio previo más pequeño que aportó signos de beneficio. Sin embargo, en enero se divulgaron los resultados de un ensayo más grande, ANNOUNCE, y revelaron que la combinación, asociacion de Lartruvo con doxorrubicina no ayudó a los pacientes a vivir por más tiempo que aquellos que tomaron solo doxorrubicina.
El fracaso de Lartruvo y su posterior retirada por Lilly son un contratiempo para el negocio de oncología de la compañía. A pesar de la decepción, especialmente para los pacientes, el revés no ha afectado mucho a las acciones de Lilly.
De hecho, desde la divulgación de los resultados del estudio de Fase 3, las acciones de la compañía se han mantenido más o menos a un precio por acción que es más de un 40% más alto que hace un año.
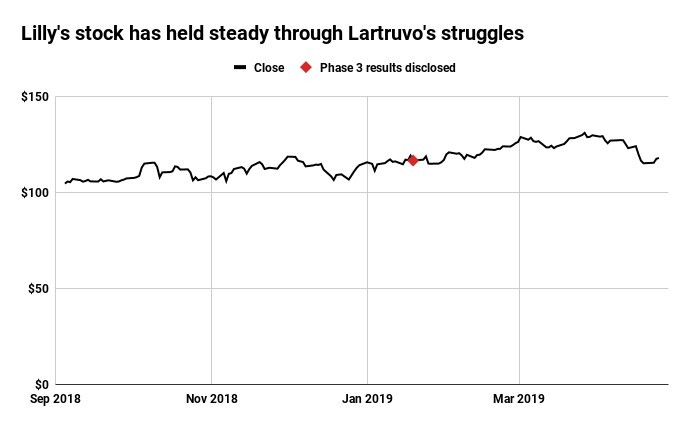
Las acciones de Lilly se han mantenido estables durante los problemas con Lartruvo
Los ejecutivos también han descontado que estos resultados clínicos y la retirada anticipada del mercado pudieran tener un impacto financiero a largo plazo/
“Incluso tras la salida de Lartruvo, confiamos en lograr nuestra meta en ventas para 2020, lo que representaría que el negocio farmacéutico ha tenido una tasa de crecimiento anual compuesta del 7% entre 2015 y 2020”, dijo Joshua Smiley, director financiero de Lilly, en la conferencia para hablar de los resultados de cuarto trimestre de la empresa.
Sin embargo, el fracaso de la prueba fue citado como una de las varias razones por las cuales en febrero Lilly redujo su pronóstico de ingresos para 2019 en US$200 millones.
Lartruvo obtuvo un poco más de US$300 millones en ventas en el 2018. Previamente, la compañía había considerado aceptar una desvalorización de alrededor de US$80 millones en el primer trimestre, por los problemas con el medicamento oncológico.
El jueves, Lilly describió un nuevo programa para permitir que los pacientes tratados con Lartruvo continúen con el tratamiento después de su retirada. Según la compañía, los pacientes deberían ser informados de los riesgos del medicamento y del fracaso del ensayo de fase 3 antes de decidir si desean continuar con el régimen.
Tanto los reguladores de EE UU como los europeos, a los pocos días de que se hubieran divulgado los resultados del estudio, recomendaron a los médicos que no iniciaran tratamientos con Lartruvo. La EMA agregó que los médicos pueden mantener a sus pacientes en el medicamento si parece estarles beneficiando, al tiempo que estiman que hay 1.000 pacientes europeos consumiendo el medicamento.