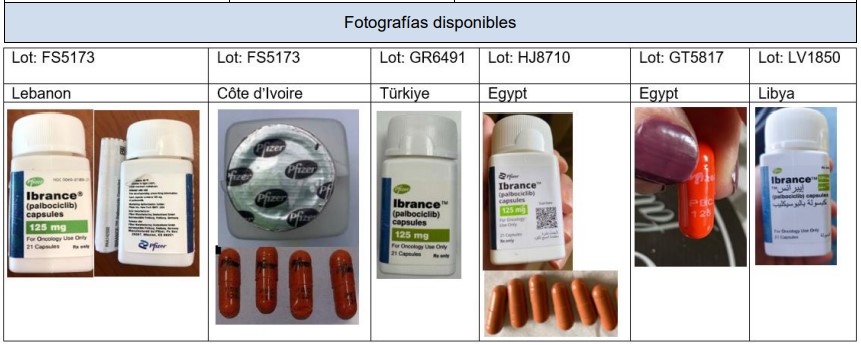
El organismo regulador indio rechaza la exención de los ensayos clínicos de fase III locales con lenacapavir
(Indian regulator declines local Phase-III clinical trial waiver for Lenacapavir).
Chetali Rao, K.M. Gopakumar
Third World Network, 13 de noviembre de 2025
www.twn.my
Traducido por Salud y Fármacos, publicado en Boletín Fármacos: Propiedad Intelectual 2026; 29 (1)
Tags: atrasos en el acceso a lenacapavir, acceso mundial a versiones genéricas de lenacapavir, ensayos clínicos con lenacapavir
El comité de expertos de la agencia reguladora de medicamentos de India ha rechazado la solicitud de Hetero Lab Ltd. Hetero aspiraba a que la eximiera de realizar dos estudios y le permitiera fabricar y comercializar lenacapavir genérico para la prevención y el tratamiento del VIH [1].
El Comité de Expertos en la Materia (SEC) de la Organización Central de Control de Estándares de Medicamentos (en inglés Central Drugs Standard Control Organization CDSCO) rechazó la solicitud de Hetero y no le otorgó el permiso para fabricar ni comercializar el comprimido de lenacapavir de acción prolongada de 300 mg. Las actas de la reunión [1] señalan que la propuesta de Hetero justificaba la exención de hacer un ensayo clínico de fase III (local) y de un estudio de bioequivalencia (BE).
Hetero se encuentra entre los seis fabricantes de genéricos que han recibido una licencia voluntaria, libre de regalías, de Gilead Sciences para fabricar y vender lenacapavir genérico [2].
La Regla 75 de las Normas sobre Nuevos Medicamentos y Ensayos Clínicos (2019) [3] incorpora una disposición importante para la exención de ensayos clínicos locales en India. La Regla 75 establece que:
“No será necesario presentar el ensayo clínico local junto con la solicitud a la que se refiere el apartado (1) si:
- el nuevo medicamento está aprobado y comercializado en los países especificados por la Autoridad Central de Licencias en virtud de la Regla 101 y si no se han notificado eventos adversos graves inesperados importantes; En virtud de esta norma, cuando un medicamento ya está aprobado y comercializado en ciertos “países especificados”, a saber, EE UU, Reino Unido, Unión Europea, Japón, Canadá o Australia, el Controlador General de Medicamentos de India puede eximir la realización de ensayos clínicos. Esta exención se concede siempre que el fabricante de genéricos se comprometa a realizar un estudio de fase IV posterior a la comercialización en India, para monitorizar la seguridad y la eficacia del producto en cuestión.
Si bien Hetero solicitó una exención en base al gran número de ensayos clínicos con lenacapavir realizados a nivel mundial, el comité observó que Hetero no presentó datos de estudios clínicos sobre la subpoblación india que demostraran que no hay una variabilidad étnica sustancial. El comité consideró que la evidencia era insuficiente para confirmar la adecuación de la dosis y su seguridad/eficacia ni aprobar la dosis propuesta para la población india. Esto significa que Hetero tendrá que realizar un estudio clínico local de fase III en la población india antes de obtener la aprobación para lenacapavir. Sin embargo, la empresa ya había obtenido permiso para la realización de un estudio de bioequivalencia (BE) con fines de exportación de la división de bioequivalencia/biodisponibilidad de la CDSCO. Dicho estudio de bioequivalencia está en curso.
El rechazo parece discrepar de las Normas de Ensayos Clínicos con Medicamentos Nuevos de 2019
Como se informó anteriormente [4], lenacapavir no se ha registrado en India y no aparece en la lista de nuevos medicamentos aprobados en India en 2024 [5] y 2025 [6]. Una orden de la Autoridad Central de Licencias (CLA) con fecha 7 de agosto de 2024 [7], emitida en virtud de la Regla 101 de las Normas de Medicamentos Nuevos y Ensayos Clínicos, especifica que si un nuevo medicamento está aprobado y comercializado en EE UU, Reino Unido, UE, Japón, Australia o Canadá, se puede considerar la exención de ensayos clínicos locales para las siguientes cinco categorías: medicamentos huérfanos, terapias génicas/celulares, medicamentos utilizados en situaciones de pandemia, medicamentos para fines especiales de defensa y medicamentos que ofrecen un avance terapéutico significativo con respecto al estándar de atención actual.
Lenacapavir cumple los requisitos para ser considerado en virtud de la Regla 101 por las siguientes razones:
- Lenacapavir ha sido aprobado en los países especificados y también ha recibido la autorización de comercialización de agencias reguladoras reconocidas en EE UU, la UE y otros países miembros del ICH. Recientemente también ha sido recomendado por la Organización Mundial de la Salud.
- Lenacapavir representa un avance terapéutico significativo con respecto al tratamiento estándar actual. Aborda una necesidad de salud importante y urgente entre las personas que viven con el VIH (PVVIH), donde se requiere un acceso rápido a nuevos tratamientos.
Existen precedentes [8] en los que la SEC, con la posterior aprobación del Comité Técnico/Comité Superior, ha recomendado exenciones en circunstancias excepcionales cuando existían datos suficientes de ensayos de Fase III a nivel mundial y se impusieron condiciones de farmacovigilancia posterior a la comercialización. Esto incluye medicamentos para el VIH y la tuberculosis. En 2015 también se concedió una exención de ensayos clínicos locales para un fármaco antiviral contra el VIH.
En los ensayos clínicos pivotales, incluyendo los estudios PURPOSE 1 y PURPOSE 2 [9], el lenacapavir demostró ofrecer una protección casi completa contra la adquisición del VIH, con tasas de eficacia del 96-100 % y un sólido perfil de seguridad. Existen sólidos datos globales de Fase III para lenacapavir (tanto para el tratamiento como para la prevención) en múltiples países y poblaciones [10].
Si bien el estudio PURPOSE 1 se realizó en Sudáfrica y Uganda, PURPOSE 2 se llevó a cabo en EE UU, Sudáfrica, Perú, Brasil, Argentina, México y Tailandia. Si la población extranjera es similar a la población india en parámetros clave (como el subtipo de VIH y las comorbilidades), la necesidad de ensayos clínicos se reduciría. En cuanto al subtipo de VIH, un estudio ha revelado que, en el sur de África, Etiopía y el sur de Asia (India entre otros países) predominaba el subtipo C, que constituía al menos el 97 % de las infecciones en cada región entre 2016 y 2021 [11]. Además, dados los perfiles de comorbilidad, como la alta tasa de coinfección por tuberculosis en ambas poblaciones, los datos internacionales respaldaron la exención en India. Además, la etiqueta de la FDA no reporta diferencias clínicamente significativas en la farmacocinética de lenacapavir según la edad, el sexo, la etnia, la raza o el peso corporal, lo que reduce la necesidad de hacer un estudio en la población india [12]. La población del ensayo global ya era diversa, incluyendo cohortes latinoamericanas y africanas, lo que habría cubierto las posibles variaciones.
Dada la carga de VIH en la India (más de 60.000 infecciones anuales) y el objetivo de contar con herramientas de prevención de acceso rápido, los argumentos de salud pública favorecen una aprobación acelerada de lenacapavir. Lenacapavir representa un avance transformador en la prevención y el tratamiento del VIH, ofreciendo la primera y única profilaxis preexposición (PrEP) inyectable semestral, un medicamento para prevenir el VIH. Para las personas que viven con el VIH, el lenacapavir representa una opción crucial, especialmente para aquellas con virus multirresistente. Su formulación de acción prolongada supera una de las barreras más importantes en la atención del VIH: la adherencia subóptima a los medicamentos diarios, particularmente entre las poblaciones afectadas por el estigma, la inestabilidad social o el acceso limitado a la atención médica.
Sin la exención, el plazo para la introducción de lenacapavir genérico en la India se ampliará. Los retrasos en el acceso no solo afectarán a la India, sino también a una gran cohorte de países de ingresos bajos y medianos (PIBM) cubiertos por la licencia de Gilead, muchos de los cuales dependen de los genéricos indios para su suministro. Otorgar esta exención no solo habría acelerado el acceso a lenacapavir para los 2,3 millones de personas que viven con VIH en India, sino que también habría posicionado a India como proveedor global, evitando retrasos en la implementación en los PIBM. Este obstáculo regulatorio pospone los posibles beneficios para la salud pública que podría ofrecer un lenacapavir genérico oportuno y asequible.
Referencias
- CDSCO. Recommendations of the SEC (Antimicrobial & Antiviral) made in its 11th/25 meeting held on 15 de octubre de 2025 at CDSCO HQ New Delhi: https://cdsco.gov.in/opencms/resources/UploadCDSCOWeb/2018/UploadCommitteeFiles/Recommendation%20Antimicrobial%20Antiviral%2015.10.2025.pdf
- Gilead. Gilead Signs Royalty-Free Voluntary Licensing Agreements with Six Generic Manufacturers to Increase Access to Lenacapavir for HIV Prevention in High-Incidence, Resource-Limited Countries. Gilead, 2 de octubre de 2024. https://www.gilead.com/news/news-details/2024/gilead-signs-royalty-free-voluntary-licensing-agreements-with-six-generic-manufacturers-to-increase-access-to-lenacapavir-for-hiv-prevention-in-high-incidence-resource-limited-countries CDSCO. The new drugs and clinical trials rules2019 [GSR 227(E). dt. 19-3-2019]. (As amended vide GSR 21(E),dt. 18-1-2022, w.e.f. 18-1-2022)GSR 21(E), dt. 18-1-2022, w.e.f. 18-1-2022) https://cdsco.gov.in/opencms/resources/UploadCDSCOWeb/2022/new_DC_rules/NEW%20DRUGS%20ANDctrS%20RULE,%202019.pdf
- Third World Network. Health: Perilous Delay in Lenacapavir Registration Compromises Access in Developing Countries. TWN Info Service on Health Issues: (Oct25/01), 1 October 2025 https://twn.my/title2/health.info/2025/hi251001.htm
- CDSCO List of New Drugs approved in the year 2024 till date https://twn.my/title2/health.info/2025/hi251001.htm
- CDSCO. List of New Drugs approved in the year 2025 till date https://cdsco.gov.in/opencms/resources/UploadCDSCOWeb/2018/UploadApprovalNewDrugs/List%20of%20New%20Drugs%20approve25aug25.pdf
- CDSCO. (Escrito en Indú) https://cdsco.gov.in/opencms/opencms/system/modules/CDSCO.WEB/elements/download_file_division.jsp
- CDSCO. Minutes of 20th meeting of the technical committee held on 19.12.2014 under the chairmanship of DGHS for supervising clinical trials on new chemical entities in the light of directions of the honorable Supreme Court of India on 03.01.2013. https://www.cdsco.gov.in/opencms/resources/UploadCDSCOWeb/2018/UploadCommitteeFiles/20thTC%20Minute.pdf
- Purpose Studies. https://www.purposestudies.com/
- Gilead. Full Efficacy and Safety Results for Gilead Investigational Twice-Yearly Lenacapavir for HIV Prevention Presented at AIDS 2024. https://www.gilead.com/news/news-details/2024/full-efficacy-and-safety-results-for-gilead-investigational-twice-yearly-lenacapavir-for-hiv-prevention-presented-at-aids-2024
- Nair, Malavika et al. Global and regional genetic diversity of HIV-1 in 2010–21: systematic review and analysis of prevalence. The Lancet Microbe, Volume 5, Issue 11, 100912
- FDA. Highlights of prescribing information. These highlights do not include all the information needed to use YEZTUGO safely and effectively. See full prescribing information for YEZTUGO https://www.accessdata.fda.gov/drugsatfda_docs/label/2025/220020s000lbl.pdf?utm_medium=email&utm_source=sendpress&utm_campaign