ESPAÑA: SOLUCIÓN AL CONFLICTO ENTRE PFIZER Y LA DISTRIBUCIÓN. EL MINISTERIO PREPARA UN DECRETO DE TRAZABILIDAD
Jimena Orchuela
EL USO DE BENZODIACEPINAS EN LA COLUMBIA BRITÁNICA ¿ES COHERENTE CON LAS RECOMENDACIONES?
(Therapeutics Initiative. Use of benzodiazepines in BC. Is it consistent with recomendations?)
Therapeutics Letter Nov-Dic 2004;54:1-2
Traducido y editado por Emilio C. Cermignani
_______________________________________________________________
ESPAÑA: SOLUCIÓN AL CONFLICTO ENTRE PFIZER Y LA DISTRIBUCIÓN. EL MINISTERIO PREPARA UN DECRETO DE TRAZABILIDAD
Jimena Orchuela
Pfizer había anunciado en diciembre pasado que a partir de junio de este año comenzaría a suministrar a las farmacias sus productos directamente y sin intermediarios. Esta medida incluía: selección de operadores, garantía de que el servicio se mantendría con la misma eficacia que ahora, invariabilidad de los precios y asunción de costes. Pfizer aseguraba que su intención era evitar las llamadas “exportaciones paralelas”, es decir, el desvío de productos farmacéuticos para su venta en terceros países.
Hasta la entrada en la Unión Europea de los nuevos Estados miembros, España era uno de los países comunitarios con los fármacos más baratos, lo que la convirtió en fuente de comercio paralelo de medicamentos. Acabar con este desvío de capital ha sido una de las reivindicaciones fundamentales de las empresas farmacéuticas durante años; Pfizer y GlaxoSmithKline incluso acabaron en los tribunales por establecer un sistema de dobles precios prohibido por la Comisión Europea [1].
La decisión de Pfizer levantó polémica en el sector, pues farmacéuticos y distribuidores lo interpretaron como un ataque al modelo español de farmacia. Luego de meses de negociaciones, lo concreto es que a partir del 1 de junio de 2005, Pfizer ha adoptado un modelo mixto de suministro de medicamentos, lo que significa que las farmacias españolas podrán optar entre la distribución tradicional a través del mayorista farmacéutico o directamente desde la propia Pfizer [2].
Para la primera alternativa, se aplicará el artículo 100 de la Ley del Medicamento, de manera que Pfizer venderá sus medicamentos a los almacenes mayoristas a un precio libre cuando no se pueda justificar que el medicamento se distribuye en España.
Desde un inicio los distintos sectores solicitaron al Ministerio de Sanidad que se pronunciara y planteara propuestas constructivas para impedir las exportaciones paralelas y respetar el modelo de distribución. En este contexto, a mediados de mayo, se dio a conocer un borrador de real decreto (RD) presentado por el Ministerio que plantea la vigilancia de la trazabilidad de los productos farmacéuticos, es decir, controlar la situación de un fármaco desde su salida del laboratorio hasta su dispensación. La norma, actualmente en discusión, pretende evitar el desabastecimiento de las oficinas de farmacia, y también reducir las exportaciones paralelas. De aprobarse el RD, España se convertirá en el primer país europeo en poner freno a las exportaciones paralelas de fármacos en el marco de la Unión Europea [1]. [N.E.: ver “El Tribunal Europeo toma posición respecto del comercio paralelo y la normativa comunitaria sobre competencia” en la Sección Ética y Derecho de esta edición del Boletín Fármacos]
Las repercusiones en los distintos sectores de la notificación de Pfizer en noviembre de 2004, se puede consultar en “Pfizer suministrará directamente a las farmacias a partir de junio de 2005” publicada en la Sección Noticias de la industria del Boletín Fármacos 8(1). En esta segunda parte veremos cómo se siguieron desarrollando los hechos.
Se pronuncia la Dirección General de Defensa de la Competencia
En plena fase de negociaciones con la Federación Española de Distribuidores Farmacéuticos (Fedifar) para tratar de reconducir la iniciativa de Pfizer de suministro directo, la Dirección General de Defensa de la Competencia, órgano adscripto al Ministerio de Economía y Hacienda, se pronunció con motivo de la denuncia de una distribuidora a la que Pfizer dejó de suministrar sus productos a partir de enero de 2004, lo que suponía un abuso de posición dominante, actuación prohibida por la Ley de Defensa de la Competencia.
Economía dictó una resolución que aclara las dos principales dudas legales que rondan acerca del tema: en primer lugar, afirma que “aunque los distribuidores realicen descuentos a las farmacias, éstos no se transmiten al paciente ni a la Seguridad Social, por lo que si el comportamiento de Pfizer diera lugar a la desaparición del mercado de algún distribuidor, no se vería afectada la competencia”; y, en segundo lugar, da el aval al suministro directo porque “la legislación obliga a los laboratorios a tener abastecido el mercado y establece la posibilidad de utilizar a los mayoristas, pero [la ley] no obliga a utilizarlos”.
Pfizer contestó a la denuncia del mayorista explicando que la decisión de cortar el suministro a esta empresa respondía a una reestructuración de sus empresas participadas, “con el objetivo sanitario fundamental de mantener debidamente abastecido el mercado, así como para lograr los objetivos de racionalidad, eficacia y rentabilidad requeridos” [3].
De los hechos acreditados ante los órganos de la Competencia, se desprende que Pfizer después de fusionarse con Pharmacia, pasó de trabajar con 71 distribuidores a 58 en 2003. Es decir que Pfizer ya había decidió rescindir unilateralmente sus relaciones comerciales con otros 26 distribuidores farmacéuticos de toda España [3].
En lo que se refiere al sector de la distribución, la Dirección General de Defensa de la Competencia apunta que “parece existir un consenso generalizado en el sector en cuanto a la necesidad de concentración, a fin de reducir costes en compras, transportes, logística, etc.” De hecho, matiza, “una parte importante de los mayoristas se ha coaligado en cuatro grupos societarios que representan el 78% de la distribución, quedando el 22% restante en manos de cooperativas o sociedades que no se han integrado en ningún grupo.” [3]
Aunque esta resolución es de un órgano administrativo y, por tanto, recurrible, expresa una primera interpretación oficial.
Pfizer ofrece diálogo y Fedifar hace una propuesta
A principios de febrero las distancias que Fedifar y Pfizer se habían marcado parecían empezar a acortarse. Mientras la farmacéutica seguía afirmando que estaba firme en su estrategia de suministro directo, envió a Fedifar un mensaje de flexibilidad y de disponibilidad al diálogo, que abría una puerta a otros sistemas posibles, incluso no muy diferentes al vigente hasta que comenzaran todas estas discusiones. “La postura de Pfizer es firme, pero seríamos flexibles y no lo aplicaríamos si la alternativa [de Fedifar] es clara y transparente y garantiza un cien por cien de abastecimiento a las farmacias”, señaló Vicente Morales, Director del área legal de Pfizer [4].
La propuesta que finalmente presentó Fedifar era la de una entidad consultora independiente que sería la encargada de recabar y manejar toda la información del número de unidades dispensadas en las farmacias españolas de las especialidades sensibles de exportación de la compañía (aproximadamente unas diez). Estos datos serían proporcionados por los almacenes mayoristas y, una vez recabados, remitidos a Pfizer. Según algunas fuentes, esa entidad independiente podría ser la consultora IMS [5].
Cofares se opone a ambos
Olegario Díez, Presidente de Cofares, la mayor empresa distribuidora de medicamentos de España, manifestó su falta confianza en la alternativa propuesta por Fedifar. La explicación dada por Díez era que “La patronal por sí sola no tiene capacidad para ofrecer una alternativa porque en su seno hay empresas que se dedican fundamentalmente al comercio paralelo y porque el laboratorio aprovecharía esta circunstancia para ganar tiempo polarizando las negociaciones con Fedifar… Pfizer trata de ganar tiempo hasta junio para conseguir capacidad logística; no confío en esta negociación… el laboratorio no podrá conseguir capacidad logística suficiente para todo el mercado porque las cuatro distribuidoras principales del país -Cofares, Federaciò, Cecofar y Hefame- se han negado a recibir las bases del concurso del laboratorio, excepto Safa… incluso con las 25 empresas que han recibido las bases del concurso tampoco se abarcaría todo el territorio nacional… la solución para frenar a Pfizer pasa por una negociación conjunta entre el Ministerio, Pfizer y la distribución representada por Fedifar con Cofares, Hefame, Cecofar y Federaciò.” [6]
Pfizer ofrece otra alternativa
La alternativa del precio libre es la solución que desbloqueó la crisis abierta en el sector a partir de noviembre. Dar la opción a los farmacéuticos para que sigan trabajando con sus mayoristas habituales y cuenten con el suministro directo como una alternativa más. Así, parece que Pfizer ha descartado la alternativa que le ofreció la patronal de la distribución. El motivo reside en que la petición de datos de venta en las farmacias podría vulnerar la legalidad del marco de la competencia [7].
El laboratorio se decidió por una solución sustentada en el artículo 100 de la Ley del Medicamento, que consiste en que el laboratorio cobre al mayorista a precio intervenido sólo si éste justifica que distribuye el medicamento en España. En caso contrario, le facturará un precio europeo o libre. Es decir, será un sistema que se ajustará entre el laboratorio y el mayorista, sin afectar a la farmacia [7].
El doble precio se aplicará de la siguiente manera: se emite una factura a precio libre y se ajusta una vez que el mayorista justifique la venta en España. No obstante, falta por definir cómo se ajustarán técnicamente los pagos [8].
Pfizer está ofreciendo de forma individual a unos pocos mayoristas o agrupaciones relevantes -por su cuota de mercado o por la importancia que tengan en determinados territorios- contratos que incluyen el doble precio y el compromiso de no exportar a países del espacio económico europeo. Lo que sí es claro es que el laboratorio realizará una selección de empresas y, por tanto, aquéllas con las que ya no trabaje sólo podrán recibir los productos a través de los distribuidores seleccionados. Esta selección entra dentro de la estrategia de Pfizer, iniciada hace unos años, de no operar con todos los almacenes. De hecho, en los contratos que ofrece Pfizer existe una cláusula que permite vender a terceros [8].
Según el Presidente de la compañía, Emilio Moraleda, “el objetivo de este modelo es garantizar el acceso, la trazabilidad y el continuo abastecimiento de las medicinas de la compañía en todo el territorio nacional, lo que favorecerá la seguridad y el acceso del paciente a su tratamiento.” [2]
Hasta el momento no parece haber mucho entusiasmo por parte de los otros fabricantes de medicamentos en apuntarse en el nuevo plan, probablemente a la espera de ver cómo le va a Pfizer. Lo cierto es que el resto de los laboratorios guardan silencio. La patronal, Farmaindustria, está en una incomoda situación, porque su Presidente es en estos momentos, precisamente, el propio Moraleda [9].
El Ministerio de Sanidad presenta un borrador de RD sobre trazabilidad
Desatado el conflicto, los distintos sectores involucrados pidieron al Ministerio que se pronuncie y plantee propuestas para impedir las exportaciones paralelas y respetar el modelo de distribución.
En un principio la Ministra Elena Salgado afirmó que la propuesta inicial de Pfizer no parecía ser “la mejor forma de distribuir medicamentos. Espero que se pueda llegar a una solución satisfactoria, aunque ahora no puedo anticipar cuál podría ser. El Ministerio no se quedará con los brazos cruzados si el tema no se resuelve. Me preocupa especialmente la farmacia rural.” [6]
En una reunión que representantes de la compañía mantuvieron con José Martínez Olmos, Director General de Farmacia, éste les transmitió la preocupación del sector así como la posición contraria que se percibía en el conjunto del SNS hacia su iniciativa [5].
Finalmente, la tensión generada por la decisión de Pfizer de suministrar de manera directa sus productos también comenzó a relajarse por la mediación del Ministerio, que el pasado 12 de mayo presentó en rueda de prensa conjunta con los Presidentes de Pfizer, Fedifar y del Consejo General de Colegio Farmacéuticos, un borrador de real decreto (RD) donde plantea la vigilancia de la trazabilidad de los productos farmacéuticos. Esto permitirá, según el Ministerio, evitar el desabastecimiento de las oficinas de farmacia, y también reducir las exportaciones paralelas. Crea un nuevo sistema de información para conocer dónde se distribuye y dispensa el medicamento, para poder aplicar así el precio libre europeo si se distribuyen fuera de España o el precio intervenido y más bajo fijado por el Ministerio si se venden dentro del país. Mayoristas, laboratorios y farmacias tendrán que informar a Sanidad de los datos de unidades suministradas a las farmacias u otros mayoristas, los datos de venta a almacenes y las unidades de dispensación tanto de recetas oficiales como privadas [1,10,11].
Algunas repercusiones por el borrador de RD
La industria farmacéutica parece recibir de buen grado el RD, así lo ha manifestado el Director General de Farmaindustria, Humberto Arnés, para quien “el borrador recoge una reivindicación de los laboratorios para que el precio intervenido sólo actúe cuando el comprador es el Estado”. La patronal también considera positivas las medidas que posibilitan a los laboratorios conocer el destino final de las unidades puestas en el mercado mediante el sistema de trazabilidad que está previsto se realice “farmacia por farmacia” [12].
Según los principales responsables de la industria farmacéutica europea, reunidos en el encuentro anual de Efpia (patronal europea del medicamento), el RD convertirá a España en el primer país europeo en poner coto real a las exportaciones paralelas de fármacos en el marco de la Unión Europea. El Director General de la patronal, Brain Ager, afirmó que “España va en la dirección correcta con esta nueva legislación” al acercarse al cumplimiento que hace ya más de un año hizo el grupo G10 europeo para potenciar la competitividad del mercado farmacéutico comunitario, que insta a conseguir un precio único para los medicamentos de toda Europa o minimizar el efecto de las exportaciones paralelas [10].
Por su parte, Fedifar plantea dificultades técnicas para garantizar la trazabilidad de los medicamentos tal y como exige el borrador del RD [2].
Y así lo ha expresado en las alegaciones presentadas al Ministerio. Fedifar y Fefe (Federación Empresarial de Farmacéuticos Españoles) han coincidido en algunas de estas alegaciones, sobre todo, en dos que consideran clave para la oficina de farmacia: la petición de que, en un primer momento, no se aplique la trazabilidad a los medicamentos provenientes del ámbito de la sanidad privada y a las especialidades farmacéuticas publicitarias (esto último lo recoge el documento de Fefe); y la advertencia al Ministerio de Sanidad de que esta norma, tal y como está redactada, va a aumentar la ya “excesiva bucrocatización” de la farmacia [13].
Para Fefe, “lo más grave” es la decisión de introducir a las farmacias en el sistema de información, teniendo en cuenta que “esta información se entrega a los laboratorios sin más requisito que la simple petición.” Por eso, la patronal “duda” de que el abastecimiento o seguridad de suministro sean la “verdadera finalidad de la norma”. Sobre todo, porque, según dice el documento de alegaciones, la información que la norma exige no se refiere a la toxicidad o efectos inesperados de los fármacos -a pesar de que otro objetivo es la farmacovigilancia-, sino al número de especialidades dispensadas en territorio español. Además, a juicio de Fefe, la garantía de abastecimiento se puede lograr pidiendo los datos a los almacenes o laboratorios [13].
Además, la patronal afirma que el borrador, al recoger la cesión por parte de la Administración de información de unos a otros agentes del mercado, vulnera el carácter de secreto comercial de los mismos, atenta contra la normativa de defensa de la competencia y desatiende a la necesidad de protección de los datos suministrados. Por último, Fefe entiende que vulnera el principio de proporcionalidad, al imponer a las farmacias una obligación “más onerosa” de la necesaria para lograr el fin pretendido, que, por otra parte, “resulta inalcanzable”, dada la ausencia de homogeneidad en la identificación de los lotes [13].
El Consejo General de Colegios Oficiales de Farmacéuticos (CGCOF) apuesta por ir aplicando la trazabilidad en el sector privado “paso a paso” o, lo que es lo mismo, solicitar al Ministerio un periodo transitorio, para “trabajar tranquilamente todas las partes” y “solucionar las dificultades técnicas, tratar la informatización de las farmacias y ver qué grupo de medicamentos exige una trazabilidad más urgente que otros, que pueden esperar”, explica su Presidente, Pedro Capilla [13].
La situación es difícil porque las soluciones técnicas para ponerlo en marcha están en el mismo punto que cuando apareció el RD 725/2003, norma que ahora se pretende modificar: están diseñadas pero no implantadas con eficacia en el mercado. Sanidad no sólo tendrá que consensuar cómo identificar los lotes por parte de la Industria, la distribución y las farmacias sino también las soluciones tecnológicas que permitirán la captación y transmisión de toda la información que pide. Pero también facilitar las inversiones [14].
Martínez Olmos, ha afirmado la voluntad de Sanidad en discutir las discrepancias con todo el sector. [10] De hecho, fue el conflicto creado por Pfizer el que llevó a Sanidad a analizar la trazabilidad de los medicamentos, “y descubrimos que había numerosas lagunas legislativas, necesitábamos garantizar el circuito real que sigue cada medicamento”, según ha explicado Martínez Olmos [1].
No obstante, Martínez Olmos ha querido aclarar que el problema de Pfizer con las exportaciones paralelas “sólo tiene solución entre las partes, no deja de ser un conflicto entre empresas privadas. Lo único que hemos hecho nosotros es dotar al circuito del medicamento de más transparencia para evitar el desabastecimiento de las farmacias.” [1]
Referencias:
Sierra R. Pfizer logra implicar a Sanidad contra la exportación paralela, Diario Médico (España), 16 de mayo de 2005.
La distribución insiste en la imposibilidad de cumplir la trazabilidad, Cinco Días (España), 3 de Junio de 2005.
López Agúndez JM. España: Competencia admite que Pfizer pueda escoger distribuidor para sus productos, Correo Farmacéutico (España), 7 de febrero de 2005.
López Agúndez JM. El director legal de Pfizer afirma que la decisión sigue adelante pero ofrece diálogo, Correo Farmacéutico (España), 7 de febrero de 2005.
López Agúndez JM. Una auditora es la posible alternativa de garantía de abastecimiento de Pfizer, Correo Farmacéutico (España), 21de febrero de 2005.
López Agúndez JM. Fedifar ultima su alternativa para el abastecimiento total y Pfizer la espera, Correo Farmacéutico (España), 14 de febrero de 2005.
López Agúndez JM. España: Pfizer propondrá que el mayorista justifique la venta en España, Correo Farmacéutico (España), 7 de marzo de 2005.
López Agúndez JM. Pfizer ofrece el suministro, con doble precio, sólo a algunos mayoristas o agrupaciones, Correo Farmacéutico (España), 25 de abril de 2005.
Pfizer venderá directamente sus medicamentos a las farmacias que se lo pidan, El Confidencial (España), 30 de mayo de 2005.
España limitará las exportaciones paralelas en fármacos, Expansión (España); 2 de junio de 2005 (reproducido por Canal de Farmacia).
Europa pondera los intereses en juego en el comercio paralelo, El Semanal Digital, 30 de mayo de 2005.
Los laboratorios consideran positivo el Real Decreto que regula un nuevo sistema de trazabilidad, Canal de Farmacia (España), mayo de 2005.
Gema M. La Farmacia pide que el RD sólo se aplique a los fármacos financiados, El Global (España), 6 de junio de 2005.
López Agúndez JM. La industria y la distribución ponen “peros” técnicos y de coste para identificar los lotes, Correo Farmacéutico (España), 30 de mayo de 2005.
EL USO DE BENZODIACEPINAS EN LA COLUMBIA BRITÁNICA ¿ES COHERENTE CON LAS RECOMENDACIONES?
(Therapeutics Initiative. Use of benzodiazepines in BC. Is it consistent with recomendations?)
Therapeutics Letter Nov-Dic 2004;54:1-2
Traducido y editado por Emilio C. Cermignani
En la conclusión referida al tratamiento del insomnio de la Therapeutics Letter N° 11 [1] puede leerse: “Si están indicadas, prescriba benzodiacepinas de vida media corta, en dosis bajas, durante períodos breves y no para uso nocturno habitual.” Posteriormente, en la Therapeutics Letter N° 18 [2], al referirse al tratamiento de los trastornos de ansiedad, se concluye que: “las evidencias actuales sugieren que el tratamiento no benzodiacepínico, particularmente mediante la psicoterapia, resulta seguro y efectivo para la mayoría de los pacientes con trastornos de ansiedad.”
En el número actual de la Therapeutics Letter se describe la utilización de las benzodiacepinas en la Columbia Británica (CB) [N.T.: Provincia occidental de Canadá que cuenta con una población estimada de 4.196.383 habitantes] desde 1996 a 2002.
Las benzodiacepinas pueden alterar el estado funcional como consecuencia de la confusión, pérdida de memoria, vértigo, somnolencia diurna, caídas/fracturas y depresión [3,4] que pueden provocar. A pesar de esta capacidad para ocasionar trastornos importantes y las escasas evidencias de beneficios clínicos significativos [4], el uso de benzodiacepinas en la CB creció entre 1996 y 2002. Este grupo de fármacos se encuentra actualmente cerca de la cima en cuanto a comprimidos dispensados: 84 millones en 2002. Esta cifra es menor que los 124 millones de comprimidos de antidepresivos, pero supera a los 74 millones de comprimidos de los supresores de la secreción gástrica (inhibidores de bomba de protones y bloqueantes de los receptores H2), a los 72 millones de comprimidos de hipolipemiantes (estatinas y fibratos), a los 63 millones de comprimidos de antiinflamatorios no esteroideos (AINEs no selectivos e inhibidores selectivos de la COX-2) y a los 55 millones de comprimidos de diuréticos.
Este análisis se basa en la cantidad de comprimidos dispensados. Hemos agrupado a los fármacos Z, zopliclona y zaleplón, junto con las benzodiacepinas ya que ambos tipos de fármacos poseen un mecanismo de acción similar. En esta Letter denominamos “benzos” al conjunto formado por benzodiacepinas y fármacos Z. Una reciente revisión sistemática [5] efectuada por el National Institute for Clinical Excellence (NICE) del Reino Unido fue resumida en un editorial [6] del British Medical Journal: “Aunque inicialmente se promovieron como superiores a las benzodiacepinas en cuanto a la sedación diurna, la dependencia y el síndrome de abstinencia, los fármacos Z no han satisfecho las expectativas en varios aspectos. Con respecto a la calidad de las pruebas, la totalidad de los 17 ensayos clínicos aleatorios que incluyeron globalmente 1.284 pacientes, fueron financiados por la industria; la información consignada sobre de los resultados principales era pobre y a menudo sesgada en favor de los resultados positivos, los tratamientos de referencia eran subóptimos, la duración de los estudios fue muy corta (máximo 6 semanas) y los marcadores subrogados (generalmente variables referidas al sueño) fueron sobrevalorados. En el análisis de la relación riesgo-beneficio no se encontró ninguna diferencia consistente entre los fármacos Z y las benzodiacepinas, tanto con respecto a la efectividad como a la seguridad”[6].
Las benzodiacepinas y los fármacos Z usadas en la CB en 2002 se muestran en la Tabla. Todos los fármacos están disponibles como genéricos, excepto el zaleplón. El costo promedio por tableta y los porcentajes de personas que utilizan los fármacos se calcularon a partir de los datos de Pharmanet correspondientes a 2002.
¿Se ha modificado la prescripción de estos fármacos entre 1996 y 2002?
En el período 1996-2002, la cantidad de comprimidos por cada 1.000 habitantes fue aumentando y alcanzó su máximo en 2001. El uso de “benzos” aumentó un 11% entre 1996 y 2002; el de los antidepresivos aumentó el 73% en el mismo período.
¿Cuáles fueron las “benzos” más frecuentemente prescritas en 1996 y en 2002?
La Figura 2 muestra los porcentajes correspondientes al uso de diferentes fármacos del grupo en 1996 y 2002. Los siete más utilizados fueron: lorazepam, clonazepam, zopiclona, oxazepam, alprazolam, diazepam y temazepam, que totalizaron el 92% en 1996 y el 95% en 2002. Cinco de estos siete tienen vidas medias mayores de 10 horas (véase la Tabla). Cuando se toman a la noche fármacos de vida media prolongada es de esperar -y resulta habitual- la sedación diurna.
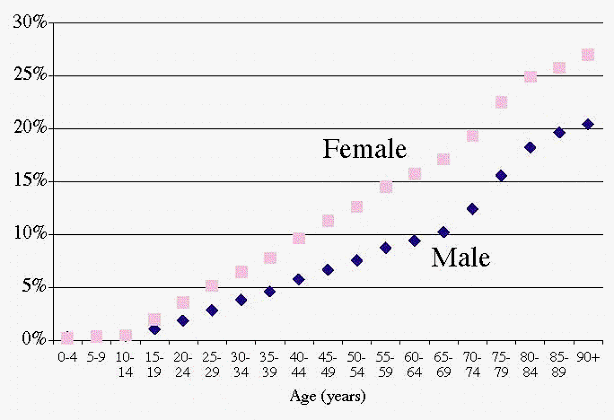
¿Qué porcentaje de la población de la CB recibió una benzo y cómo fue la distribución por género y edad?
El 9,7% de la población de la CB (400.000 personas) recibió por lo menos la prescripción de una benzo en 2002. El porcentaje fue inferior en los varones (7,1%) que en las mujeres (12,2%). La Figura 3 muestra que esta relación entre los géneros se mantiene para todas las edades y que, además, el porcentaje aumenta constantemente con la edad en ambos géneros.
¿Qué proporción de pacientes utiliza benzos acorde a las recomendaciones?
Hemos definido conservadoramente que los pacientes que recibían menos de 100 comprimidos por año los estaban utilizando acorde a las recomendaciones de grupos educativos [1,2,5], reguladores y elaboradores (por períodos cortos o en forma intermitente). Este grupo de pacientes comprendió el 5,5% de la población (230.000 personas). El resto de la población que recibía benzos (4,2% de la población total, 170.000 personas) lo hacía en cantidades superiores a los 100 comprimidos por año. Este 43% de usuarios recibió el 88% de los 84 millones de tabletas dispensadas. En la CB, una cantidad mayor a las 10.000 personas recibieron más de 1.000 comprimidos por año.
Conclusiones
El modelo de utilización de benzos en la CB no resulta concordante con las recomendaciones de grupos educativos, reguladores y fabricantes:
Comentario de un revisor
“Otros fármacos usados como sedantes/hipnóticos, como los antihistamínicos, antidepresivos y antipsicóticos pueden ser más peligrosos que las benzodiacepinas y los fármacos Z.” Hemos planificado explorar este problema en una próxima Letter. Agradecemos desde ya todo comentario que nos hagan llegar nuestros lectores.
Bibliografía:
1. Therapeutics Initiative. To Sleep or not to Sleep: Here are your Questions. Therapeutics Letter. Nov-Dec 1995;11:1-2.
2. Therapeutics Initiative. Management of Anxiety Disorders in Primary Care. Therapeutics Letter. Feb-April 1997;18:1-4.
3. Wagner AK, Zhang F, Soumerai SB, et al. Benzodiazepine use and hip fractures in the elderly. Who is at greatest risk? Arch Intern Med. 2004; 164:1567-1572.
4. Holbrook AM, Crowther R, Lotter A, et al. Meta-analysis of benzodiazepine use in the treatment of insomnia. CMAJ. 2000;162:225-233.
5. National Institute for Clinical Excellence. Guidance on the use of zaleplón, zolpidem and zopiclone for the short-term management of insomnia. NICE (Technology Appraisal 77) 2004; www.nice.org.uk/TA077 (consultado el 31 Dec 04).
6. Holbrook AM. Treating Insomnia: Use of drugs is rising despite evidence of harm and little meaningful benefit. Brit Med J. 2004;329:1198-1199.
7. Compendium of Pharmaceuticals and Specialties, 2004; Benzodiazepine monograph, Imovane, Starnoc: 253-256, 953-954, 1898-1901.
Tabla: Benzodiacepinas y fármacos Z (benzos) en la CB
|
Nombre genérico |
Marca registrada |
Costo promedio por tableta* |
Vida media (hs) [7] |
|
Alprazolam |
Xanax |
0,11 |
12 a 15 |
|
Bromazepam |
Lectopam |
0,11 |
8 a 30 |
|
Clordiazepóxido |
Librium/Corax/Solium |
0,12 |
100 |
|
Clobazam |
Frisium |
0,26 |
10 a 46 |
|
Clonazepam |
Rivotril |
0,15 |
20 a 80 |
|
Clorazepato |
Tranxene |
0,16 |
100 |
|
Diazepam |
Valium |
0,08 |
100 |
|
Flurazepam |
Dalmane/Somnol |
0,09 |
100 |
|
Lorazepam |
Ativan |
0,08 |
10 a 20 |
|
Nitrazepam |
Mogadon |
0,15 |
16 a 55 |
|
Oxazepam |
Serax |
0,07 |
5 a 15 |
|
Temazepam |
Restoril |
0,14 |
10 a 20 |
|
Triazolam |
Halcion |
0,09 |
1,5 a 5 |
|
Zaleplón |
Starnoc |
1,33 |
1 |
|
Zopiclona |
Imovane/Rhovane |
0,50 |
4 a 7 |
* dólares canadienses
Fig. 2: Uso de benzos en la CB en los años 1996 (izq.) y 2002 (der.)
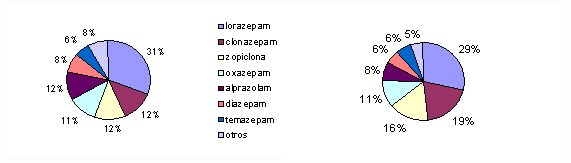
Fig. 3: Tasas de prescripción de benzodiacepinas por género