Resumen
Es bien conocido que los antipsicóticos alteran los niveles de prolactina circulante bloqueando los receptores D2 en la pituitaria. La prolactina puede activar genes implicados en el desarrollo de cáncer de mama. Estudios previos han detectado una asociación entre uso de antipsicóticos y riesgo de cáncer de mama.
Se usaron las bases de datos de las facturas presentadas a seguros privados y públicos de los EE UU para establecer una amplia cohorte observacional de mujeres que tomaban antipsicóticos y compararla con las que usaron anticonvulsivantes o litio. Para ser considerada como nueva usuaria tenía haber estado inscrita en el seguro 12 meses antes de la primera prescripción de antipsicótico, o anticonvulsivante / litio. Se identificó a las que presentaron cáncer de mama invasivo por los códigos diagnósticos. Se utilizaron modelos multivariantes de riesgos proporcionales de Cox para evaluar el riesgo de cáncer de mama por la exposición a medicamentos antipsicóticos, controlando por edad y otros factores de riesgo.
Se identificaron 914 (0,16%) casos de cáncer de mama invasivo entre 540.737 mujeres. La exposición a cualquier antipsicótico estuvo independientemente asociada a un incremento del 35% del riesgo de cáncer de mama (aHR – cociente ajustado de riesgo – : 1,35, 95%CI: 1,14-1,61). Los medicamentos de categoría 1 (elevadores de prolactina) se asociaron con un 62% de incremento de riesgo (aHR: 1,62, 95%CI: 1,30-2,03), los medicamentos de la categoría 2 incrementaron el riesgo en un 54% (aHR: 1,54; 95%CI: 1,19-1,99) y los de la categoría 3 no se asociaron con un aumento del riesgo de cáncer de mama.
En el mayor estudio con mujeres de EE UU realizado hasta ahora, se observa un gradiente de aumento del riesgo de cáncer de mama asociado a un aumento de la capacidad hiperprolactemiante de los fármacos antipsicóticos empleados. Y esta observación es coherente con lo hallado en otros estudios.
Introducción
La incidencia de cáncer de mama en EE UU es de 268.600 casos por año. Aproximadamente el 13% de las mujeres serán diagnosticadas con cáncer de mama en algún momento durante su vida [1]. Los datos endocrinos sugieren que la prolactina, además de otros factores, juega un importante papel en el desarrollo de la tumorogénesis. El receptor de prolactina está sobre expresado en el 95% de los cánceres de mama, y activa muchos genes responsables de la proliferación y diseminación metastásica del cáncer de mama a través de la señalización PRL -receptor de prolactina – JAK2-STAT5 [2,3]. Es bien conocido que muchos medicamentos antipsicóticos producen elevación de la prolactina sérica y pueden inducir neoplasias de mama en estudios en roedores, como se menciona es sus prospectos [2-4]. La hiperprolactinemia por uso de antipsicóticos se debe al bloqueo de los receptores de dopamina (D2) en el tracto tuberoinfundibular al eliminar la influencia inhibidora sobre las células lactotrofas en la pituitaria anterior. Entre los efectos adversos frecuentes en humanos se incluyen amenorrea, oligomenorrea, osteoporosis, ginecomastia, telarquia precoz, disfunción sexual e infertilidad [2]. Modelos en ratones que mimetizan muy de cerca el inicio de cáncer de mama humano han mostrado que la hiperprolactinemia inducida por antipsicóticos acelera la progresión de la lesión temprana a células cancerosas [3].
Prolactina circulante y riesgo de cáncer de mama
Datos epidemiológicos sugieren que las concentraciones de prolactina circulante se asocian con riesgo aumentado de cáncer de mama. Los niveles de prolactina se miden en la sangre (los niveles normales se encuentran entre 10-28 µg /L en mujeres) [2]. Varios estudios prospectivos de gran tamaño, en los que se recolectó sangre antes del diagnóstico de cáncer de mama, habían observado asociaciones positivas entre prolactina y riesgo de cáncer [5-9]. En un análisis conjunto de aproximadamente el 80% de los datos prospectivos del mundo, el riesgo relativo al comparar mujeres en el cuartil superior con las del cuartil inferior de niveles de prolactina fue 1,3 (intervalo de confianza al 95%, 1,1-1,6; ptend=0,002). Los resultados fueron similares para las mujeres premenopáusicas y para las postmenopáusicas [5].
Bases de datos de estudios sobre riesgo de cáncer de mama
Estudios recientes con bases de datos de antipsicóticos han ido mostrando evidencia creciente de que los antipsicóticos elevadores de prolactina se asocian a un incremento de riesgo de cáncer de mama, frecuentemente con un patrón dosis-respuesta. Los estudios antiguos detectaron mezcla de asociaciones, pero tenían tamaños de muestra insuficientes y los diseños de los estudios eran débiles, como discutiremos.
Un estudio observacional realizado por Wang y cols [4], citado frecuentemente, analizó a más de 100.000 mujeres y comparó a 52.819 mujeres tratadas con antagonistas de dopamina con 55.289 mujeres que no recibieron ese tratamiento. Las usuarias de antipsicóticos antagonistas de dopamina tuvieron un riesgo 16% mayor (razón ajustada de riesgo [HR]: 1,16; 95%CIIC, 1,07-1,26) de desarrollar cáncer de mama que las mujeres que tomaron otros medicamentos aleatorios. El estudio encontró una relación dosis-respuesta, cuando mayores las dosis acumuladas, mayor riesgo de cáncer [4]. Otro estudio de cohortes de base poblacional, en Taiwan, estratificó los medicamentos por su potencial para elevar la prolactina y encontró altas tasas de cáncer de mama en mujeres con esquizofrenia en comparación con mujeres sin enfermedad mental que no tomaban antipsicóticos. El mayor riesgo de cáncer de mama lo tuvieron las mujeres tratadas con risperidona, paliperidona o amisulpride (HR ajustado 1,96 (95%CI: 1,36-2,82) [10].
Un estudio danés reciente encontró que en el momento inicial de diagnóstico de cáncer el uso a largo plazo de antipsicóticos (equivalentes a ≥ 10.000mg de olanzapina) se asoció con un incremento del riesgo de cáncer de mama, con un cociente de posibilidades (odd ratio, OR) ajustado de 1,18 (95% CI: 1,06-1,32). Se observó un débil patrón dosis-respuesta, aumentando el OR hasta 1,27 (95%CI: 1,01-1,59) cuando las dosis acumuladas eran equivalentes a ≥50.000 mg de olanzapina [11]. Una cohorte de una base de datos de una aseguradora en Corea del Sur comparó a las mujeres que habían recibido una prescripción de antipsicóticos de segunda generación con controles emparejados por edad. Se observó un mayor riesgo de cáncer de mama entre aquellas a las que se les había prescrito dosis equivalentes a ≥10.000-mg de olanzapina (HR – cociente de riesgos -: 1,29; 95%IC: 1,14-1,46) que entre aquellas con dosis prescritas equivalentes a <10.000-mg de olanzapina (HR: 1,05; 95%CI: 1,00–1,11). El incremento del riesgo entre las mujeres expuestas se tornó significativo tras 6 años de periodo observacional (≥6 años; HR: 1,24; 95%CI: 1,14–1,35), (3 a 6 años; HR: 1,06; 95%CI: 0,97–1,15), (<3 años; HR: 1,02; 95%CI: 0,95–1,09).
Los estudios de laboratorio han mostrado que la prolactina inducida por los antipsicóticos ejerce un efecto dicotómico sobre las células mamarias en modelos de ratón que mimetizan el tejido mamario humano. Las señales Prolactina-JAK2-STAT5 debilitan el efecto protector anticancerígeno de la apoptosis en el tejido precanceroso, y por tanto puede incrementar el riesgo de cáncer. Sin embargo, la misma vía de señalización puede también causar que las células mamarias se diferencien, lo que potencialmente reduciría las tasas de proliferación y esto reduciría la posibilidad de sufrir mutaciones y consecuentemente el riesgo de cáncer [3]. Actualmente se aconseja ejercer precaución al recetar antipsicóticos, evitando la elevación de la prolactina en las mujeres en las que previamente se ha detectado un cáncer de mama [2,3].
Antipsicóticos, prolactina y clasificación de los medicamentos
Para analizar el posible el efecto biológico de la prolactina circulante inducida por antipsicóticos, tratamos de observar el riesgo de cáncer, y empezamos clasificando los medicamentos antipsicóticos según sus propiedades hiperprolactemiantes [2,12]. Los términos “primera y segunda generación” se asignaron arbitrariamente a muchos antipsicóticos, dependiendo de su primera entrada al mercado y de su capacidad para causar efectos adversos extrapiramidales, y pueden causar confusión, porque no se basan exclusivamente en la propensión a elevar la prolactina [13,14]. Por ejemplo, los antipsicóticos “típicos” o de “primera generación”, así como los medicamentos de “segunda generación” risperidona y paliperidona tienen la mayor propensión para elevar la prolactina (de 45ng/ml a >100ng/ml), mientras que otros antipsicóticos “atípicos” se asocian con elevaciones más modestas e incluso el aripiprazol / brexpriprazol no se han asociado a ese riesgo [2, 12-22]. Utilizando una taxonomía fundamentada en la prolactina [2], hemos realizado el mayor estudio epidemiológico hasta la fecha que investiga los antipsicóticos y el riesgo de cáncer de mama utilizando los registros de una base de datos administrativos que incluye a más de 150 millones de mujeres de EE UU. Hipotetizamos que las mujeres a las que se les prescribe antipsicóticos elevadores de prolactina pueden tener un riesgo más alto de cáncer de mama que las mujeres que toman anticonvulsivantes o litio como grupo control activo. Además, hipotetizamos que en relación con los medicamentos control, el riesgo de cáncer de mama podría correlacionarse con las categorías hiperprolactemiantes de los antipsicóticos: alto, medio y bajo.
Métodos
Fuente de datos. Hemos realizado un amplio estudio de cohortes observacional, retrospectivo, del riesgo de cáncer de mama entre las mujeres entre 18 y 64 años expuestas a antipsicóticos, anticonvulsivantes y/o litio, utilizando los datos de facturas para el reembolso de las bases de datos IBM® MarketScan® Commercial y Multi-State Medicaid. Las mujeres de 65 años y mayores no se incluyeron en esta base de datos, ya que frecuentemente eran cubiertas por Medicare y era probable que los datos fueran incompletos.
La base de datos “MarketScan” incluye las facturas para que se reembolsen las prescripciones médicas y ambulatorias de 150 millones de personas aseguradas privadamente (Comercial) y 20 millones de personas aseguradas por Medicaid. Las variables se definieron utilizando los códigos de diagnóstico y procedimiento de la clasificación internacional de enfermedades, novena revisión, modificación clínica (ICD-9-CM) y los códigos de Current Procedural Terminology (CPT) (terminología de procedimientos actuales) para las facturas médicas, y las facturas de prescripciones a pacientes no hospitalizados, remitidas para reembolso. Las bases de datos están anonimizadas, y el estudio fue considerado exento por la Human Research Protection Office (oficina de protección en la investigación humana), de la Facultad de Medicina de la Washington University en St Louis (estado de Misuri).
Población de estudio. Identificamos a mujeres de entre 18 y 64 años para quienes se hubiera presentado una factura por prescripción ambulatoria con un suministro >0 días de algún antipsicótico, anticonvulsivante o litio entre el 1 de enero del 2007, y el 30 de junio del 2016 (1 de enero del 2012 al 30 de junio del 2016, de la base de datos Medicaid Multi-State). El Cuadro suplementario 1 (http://links.lww.com/JCP/A796) contiene los nombres genéricos para cada categoría de medicamentos en el estudio. Identificamos como nuevas usuarias a aquellas mujeres que habían estado aseguradas durante al menos 12 meses continuos antes de que se presentara la primera factura por la prescripción de uno de los medicamentos incluidos en el estudio, cuya fecha de dispensación se utilizó como fecha índice.
Cuantificación de la exposición a los medicamentos antipsicóticos y controles. Hemos separado los medicamentos antipsicóticos en 3 categorías (categoría 1, los que tienen mayor propensión, y la categoría 3 los que tienen menos) según su propensión para elevar la prolactina. Los medicamentos de la categoría 1 comprenden a los neurolépticos “típicos” como el haloperidol y también a risperidona y paliperidona. Los medicamentos de la Categoría 2 son iloperidona, lurasidona y olanzapina. Los medicamentos de la categoría 3 son aripiprazol, asenapina, brexpiprazol, cariprazina, clozapina, quetiapina y ziprasidona (Cuadro suplementario 1, http://links.lww.com/JCP/A796). Estas categorías fueron derivadas a priori, a partir de guías clínicas sobre antipsicóticos que habían sido previamente publicadas [2,12]. Elegimos anticonvulsivantes y litio como fármacos de comparación porque no son conocidos como elevadores de prolactina y también se prescriben a pacientes con enfermedades mentales, y por lo tanto pueden mitigar algunos posibles factores de confusión relacionados con tener un diagnóstico de salud mental, tales como paridad y edad del primer parto [23-26].
Se midió la exposición a una categoría de medicamentos utilizando la dosis diaria definida (DDD) específica de cada medicamento, una cantidad desarrollada por el Centro Colaborador de la Organización Mundial de la Salud (OMS) para las Estadísticas de Medicamentos (World Health Organization’s Collaborating Centre for Drug Statistics Methodology) [27]. La potencia, cantidad y días de suministro indicados en cada factura se utilizaron para computar las DDD por día, con límites superiores aplicados según los patrones típicos de prescripción determinados por un autor (RT) (Cuadro suplementario 1, http://links.lww.com/JCP/A796). Para determinar la exposición acumulada de cada categoría de medicamentos para cada mujer, sumamos las DDD en todas las facturas comenzando con la fecha índice y terminando con el primer evento resultado o el desenlace (p.e., finalización del reclutamiento, 6 años después de la fecha índice, o evidencia de enfermedad [ver más adelante]).
Posteriormente obtuvimos el promedio de exposición durante el periodo de tratamiento observado dividiendo la exposición acumulada por el periodo de observación. El promedio de DDD por día de tratamiento observado resulta de la DDD acumulada / días totales del periodo de tratamiento observado. Por ejemplo, una mujer con prescripciones de 300mg / día de clorpromazina (medicamento de la categoría 1) durante todos los días observados debería tener un promedio de 1,00 DDD de clorpromazina (la OMS define como dosis promedio de mantenimiento 300mg /día de clorpromazina). Si esta misma mujer tiene facturas de prescripciones para la misma dosis de clorpromazina durante el 10% de su tiempo de observación en el estudio, el promedio de DDD para clorpromazina sería 0,10 por día. Las mujeres tratadas solo con proclorperazina no se incluyeron, porque esta sustancia también se utiliza como antiemético, pero se incluyó en el cálculo de las DDD totales de la exposición de antipsicóticos de la categoría 1 junto con las otras exposiciones a los medicamentos de estudio.
Identificación de cáncer de mama invasivo. Identificamos los canceres de mama invasivos empleando una definición jerárquica basada en la calidad de la evidencia disponible a partir de los códigos de diagnósticos / procedimientos (Cuadro suplementario 2, http://links.lww.com/JCP/A796 ). Primero excluimos los probables casos prevalentes por haber surtido una prescripción de tamoxifeno o por un diagnóstico de cáncer de mama o historia de cáncer de mama o cualquier reclamación previa a la fecha índice. El cáncer de mama invasivo se identificó principalmente mediante los códigos del ICD9/10-CM para el cáncer invasivo de mama en una factura con código CPT-4 por examen microscópico de patología quirúrgica (Cuadro suplementario 2, http://links.lww.com/JCP/A796), indicando verificación patológica [28]. Si esto no estaba presente, se requería un diagnóstico de cáncer de mama invasivo en una factura por hospitalización o se requería en al menos 2 facturas “por proveedores / atención no hospitalaria” separadas entre 30 a 180 días, siendo la posterior de estas 2 fechas de diagnóstico ambulatorio la utilizada como fecha del cáncer invasivo.
Para establecer el diagnóstico de cáncer de mama invasivo en el caso de posible cáncer de mama invasivo sin confirmación patológica, se requirió evidencia de tratamiento quirúrgico (mastectomía o cirugía conservadora desde un mes antes hasta seis meses después del diagnóstico) o quimioterapia (dentro de los seis meses posteriores al diagnóstico, código de administración de quimioterapia para cáncer de mama invasivo). Se asumió que los diagnósticos que no se asociaron a tratamiento quirúrgico o quimioterapéutico eran o bien casos prevalentes o casos no verificados, y se consideraron como casos censurados.
Identificación de covariables. Se identificaron las covariables de interés utilizando los códigos diagnósticos y procedimientos ICD-9/10 y los códigos de procedimientos CPT-4, de las facturas de pacientes hospitalizados o no, así como las facturas de medicamentos para algunas covariables. Las covariables evaluadas utilizando todas las facturas disponibles [29] antes de la fecha índice incluyeron posibles factores de riesgo para el cáncer invasivo de mama, incluyendo enfermedad benigna de mama, tabaquismo y enfermedades relacionadas con el tabaquismo, diabetes, abuso de alcohol, obesidad, y marcadores de obesidad que incluyeron apnea del sueño, enfermedad de reflujo gastroesofágico, lipodistrofia, y otras lipemias (Cuadro suplementario 2, http://links.lww.com/JCP/A796).
Para identificar los casos de obesidad se utilizaron otras medidas porque los códigos de obesidad que se incluyen en las facturas de pacientes con cáncer de mama [30] tienen una sensibilidad muy baja. Para mejorar la sensibilidad de su identificación utilizamos las facturas de medicamentos de venta con receta de hipolipemiantes, estatinas, tratamientos para abandonar el hábito tabáquico, y antidiabéticos. La terapia hormonal sustitutiva se identificó utilizando las facturas de las prescripciones del año previo a la fecha índice correspondientes a la clase terapéutica “estrógenos y combinaciones”, categorizada como estrógenos solos versus estrógenos más progestágenos. La terapia hormonal sustitutiva se restringió a mujeres de 50 años y mayores o a mujeres más jóvenes con diagnóstico de “ausencia adquirida de órganos genitales”. Las enfermedades benignas de mama preexistentes se identificaron a través de los códigos de diagnóstico o de procedimiento (Cuadro suplementario 2, http://links.lww.com/JCP/A796) pero no se tuvieron en cuenta si se codificaron dentro de los 180 días de la fecha de diagnóstico de cáncer invasivo de mama, por ser probablemente concurrente con el cáncer invasivo de mama. En el caso de las variables definidas por los códigos de diagnósticos o procedimientos, la falta de códigos para esa condición en los datos de las facturas se interpretó como ausencia de la condición de interés (y la variable fue codificada como 0), como se hace típicamente en el análisis de datos de facturas. Las covariables demográficas que se incluyeron en los modelos: edad, sexo y seguro comercial (privado) versus Medicaid (seguro público) se determinaron en la fecha índice. La región de los EE UU y la “raza” no se incluyeron en los análisis estadísticos, dado que el dato geográfico solo estuvo disponible para los pacientes asegurados comercialmente y la “raza” solo estuvo disponible para los beneficiarios de Medicaid.
Análisis estadísticos. Los análisis bivariantes de la asociación entre la exposición promedio a los antipsicóticos y el riesgo de cáncer invasivo de mama se realizaron utilizando modelos de riesgo proporcional de Cox. Se hizo un análisis del conjunto de todos los medicamentos antipsicóticos y análisis por exposición a las diferentes categorías 1 a 3 de antipsicóticos. La exposición primaria del uso de antipsicóticos se modeló tal como se describió anteriormente para las DDD promedio, con el HR cuantificando el riesgo asociado con un incremento de 1 unidad en las DDD. La historia personal de cáncer de mama durante los primeros 30 días de seguimiento después de un diagnóstico de cáncer de mama invasivo fue un suceso de censura, debido a que la codificación de historia personal en un corto intervalo de tiempo después del diagnóstico probablemente indica malignidad previa. Otras censuras, como la descrita anteriormente, se realizaron en la fecha más temprana de las siguientes: fecha de muerte, finalización de la inscripción o 6 años después de la fecha índice. El seguimiento total se truncó a los 6 años debido a que el número de mujeres remanentes en la población era muy pequeño.
Tres modelos multivariantes de riesgo proporcional de Cox se utilizaron para ajustar por los factores conocidos de riesgo de cáncer de mama, que se establecieron a priori y se incluyeron en los modelos independientemente de su importancia. Un modelo ajustado por factores conocidos de riesgo de cáncer de mama (p.e., obesidad, terapia hormonal sustitutiva) otro ajustado solo por edad (modelo de interpolación cúbica), y un tercer modelo ajustado para la edad más factores conocidos de riesgo de cáncer. Además, los modelos primarios se sometieron a un análisis de sensibilidad que incluyó ajustes adicionales según la presencia de enfermedades mentales y de factores conocidos de riesgo para el cáncer de mama, para tener en cuenta posibles factores de confusión relacionados con la gravedad de la mental. Se desarrollaron modelos idénticos estratificados por edad menor o igual a 50 años como análisis de sensibilidad adicional. Evaluamos el sesgo de verificación contando el número de encuentros de evaluación y manejo (E&M) en el consultorio/ambulatorio con proveedores que no fueran psiquiatras/psicólogos durante el período de referencia para mujeres con y sin cáncer de mama.
Resultados
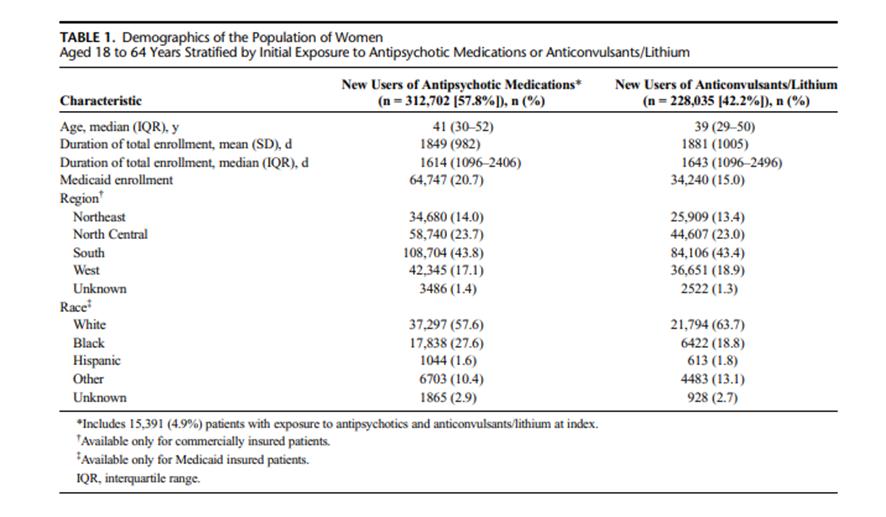
Las características demográficas de las 540.737 mujeres aseguradas comercialmente o por Medicaid que iniciaron tratamiento con antipsicóticos, anticonvulsivantes y/o litio y cumplían los criterios de inclusión para el estudio figuran en el Cuadro 1. Las que se excluyeron del estudio se resumen en la Figura 1. Se incluyó a 441.750 mujeres aseguradas comercialmente entre el 2007 y 2016 con una mediana de edad de 42 años y duración medina de seguimiento de 1 734 días y 98.987 mujeres aseguradas por Medicaid entre 2012 y 2016, con una mediana de edad de 36 años y duración mediana de seguimiento de 1 461 días.
En la bases de datos MarketScan, durante el periodo de observación posterior a la fecha índice, 914 mujeres (0.2%) fueron diagnosticadas “de novo” con cáncer invasivo de mama. Algo más del 40% de las mujeres residían en la región censal sur de los EEUU. En la base de datos Medicaid, aproximadamente el 60% de las mujeres que surtieron una prescripción de los medicamentos en estudio fueron “blancas” (Cuadro 1). Aproximadamente el 52% de las mujeres de la población en estudio surtieron al menos una prescripción de antipsicóticos de la categoría 3, mientras que el 15% surtieron al menos una prescripción de los de la categoría 1. Cuarenta y cinco por ciento de las mujeres surtieron al menos una prescripción de anticonvulsivante durante el periodo de observación. La mediana de exposición a la DDD promedio de las tres categorías de antipsicóticos fue de 0,10 o inferior, reflejando una utilización intermitente de los mismos.
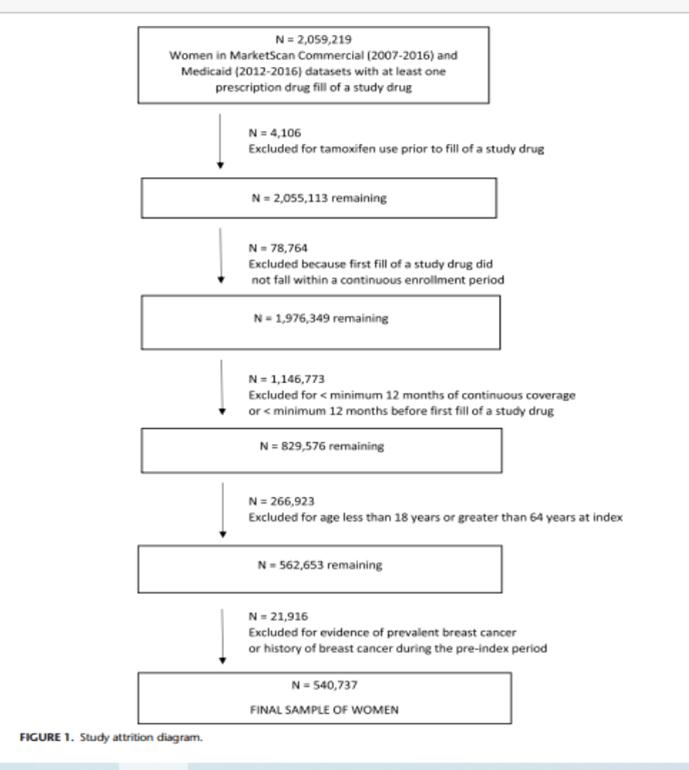
En el Cuadro 2 se comparan los valores basales de los factores que se asocian con cáncer invasivo de mama entre las mujeres de la cohorte, según la presencia o no de cáncer de mama. La obesidad, diabetes, terapia hormonal sustitutiva (en mujeres mayores de 50 años, o mujeres jóvenes con código de menopausia quirúrgica), y enfermedad benigna de mama preexistente fueron significativamente más frecuentes entre mujeres diagnosticada “de novo” con cáncer de mama invasivo que entre las mujeres no diagnosticadas con cáncer de mama durante el periodo de observación. La mediana de edad de las mujeres con cáncer de mama fue 12 años superior que la de las mujeres no diagnosticadas con cáncer de mama (52 vs 41 años, respectivamente, p<0,0001). La mediana del número de encuentros E&M ambulatorios durante el año previo a la fecha índice fue ligeramente mayor en las mujeres que fueron posteriormente diagnosticadas con cáncer de mama que en aquellas sin cáncer de mama invasivo en el periodo de seguimiento observacional (mediana 4 vs 3 visitas, p<0,0001). Más del 84% de las mujeres tuvieron al menos un encuentro E&M durante el año previo a la fecha índice.
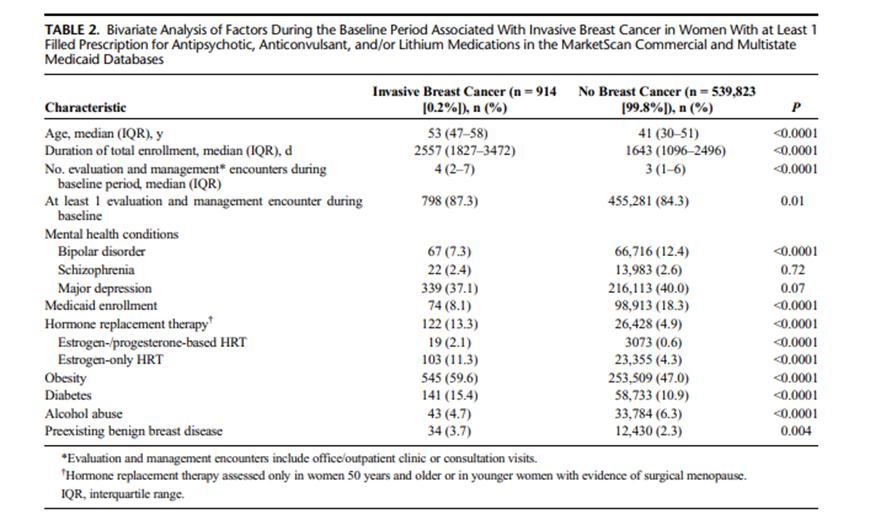
Modelos multivariantes y bivariantes de riesgo de cáncer de mama invasivo
La figura 2 incluye los resultados de los análisis bivariantes y multivariantes para las mujeres con cáncer invasivo de mama que recibieron tratamiento con antipsicóticos (categorías 1 a 3) en comparación con mujeres tratadas solo con anticonvulsivantes / litio (para ver los resultados completos del modelo ver Tabla suplementaria 3, http://links.lww.com/JCP/A796 ). Las mujeres tratadas con antipsicóticos tienen mayor riesgo de cáncer de mama que las usuarias de anticonvulsivantes / litio (HR: 1,40; 95%CI: 1,19-1,64), con el HR correspondiente a un aumento promedio de 1 unidad en la DDD diaria de antipsicóticos. Hubo poco cambio en el riesgo de cáncer de mama asociado a la exposición combinada de antipsicóticos después de ajustar por factores de riesgo conocidos para el cáncer de mama enumerados el Cuadro suplementario 3 (http://links.lww.com/JCP/A796), con solo factores de riesgo sin incluir la edad, aHR: 1,45; 95%CI: 1,23–1,70). El riesgo de cáncer de mama asociado con exposición a antipsicóticos fue ligeramente menor después de ajustar solo por la edad (aHR: 1,30; 95%CI: 1,08–1,55) y después de ajustar por la edad más factores de riesgo conocidos (aHR: 1,35; 95%CI: 1,14–1,61). Los HR para cáncer de mama asociados a la exposición a antipsicóticos fue similar en el análisis de sensibilidad estratificado por edad (Cuadros suplementarios 4 y 5, http://links.lww.com/JCP/A796 ).
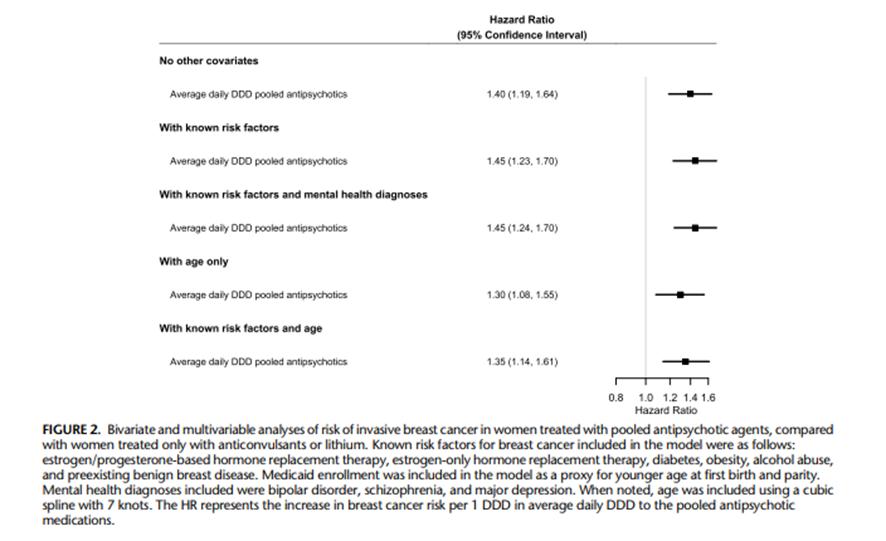
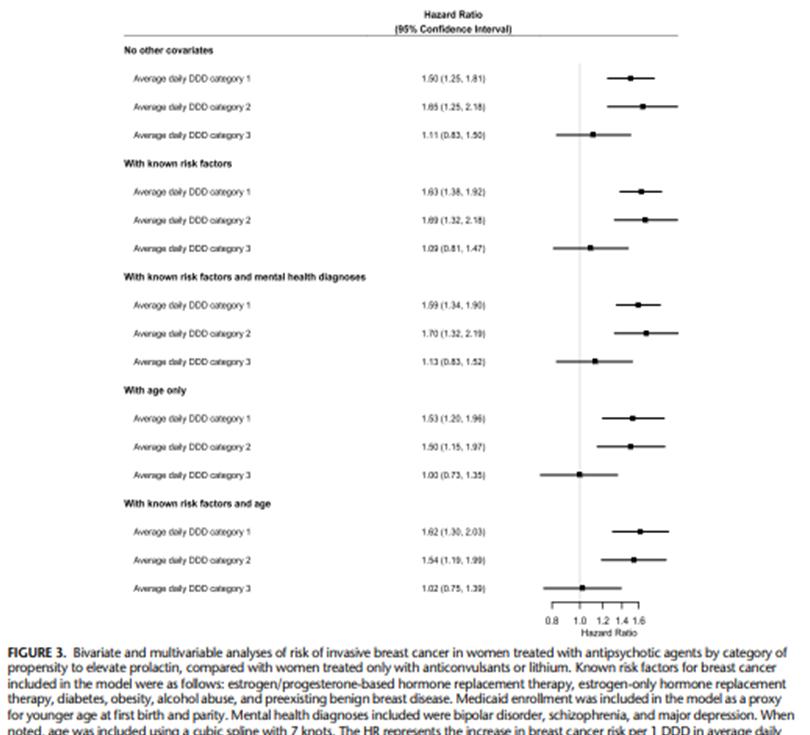
La figura 3 muestra los resultados de los análisis por exposición a las distintas categorías de antipsicóticos 1 a 3 individualmente (para ver los resultados completos del modelo ver Cuadro suplementario 6, http://links.lww.com/JCP/A796 ). En los análisis bivariantes, la categoría 1 (los medicamentos que más elevan la prolactina) y la categoría 2 de medicamentos (elevan la prolactina de forma intermedia) se asociaron con un incremento significativo del riesgo de cáncer de mama: medicamentos de la categoría 1 (HR: 1,50; 95%CI: 1,25–1,81) y medicamentos de la categoría 2 (prolactina intermedia; HR: 1,65; 95% CI: 1,25–2,18). Sin embargo, los medicamentos de la categoría 3 (los que menos elevan la prolactina) no se asociaron con un incremento significativo de cáncer de mama (HR: 1,11; 95%CI: 0,83–1,50). Los resultados fueron similares cuando se ajustó por los factores de riesgo conocidos: medicamentos de la categoría 1 (aHR: 1,63; 95%CI: 1,38–1,92), categoría 2 (aHR: 1,69; 95%CI: 1,32–2,18), y categoría 3 (aHR: 1,09; 95%CI: 0,81– 1,47).
La asociación significativa con los medicamentos de las categorías 1 y 2 se mantuvo después de ajustar por factores de riesgo conocido y por condición de salud mental: categoría 1 (aHR: 1,59; 95%CI: 1,34–1,90), categoría 2 (aHR: 1,70; 95%CI: 1,32–2,19) y también se mantuvo después del ajuste por edad más factores de riesgo conocidos: medicamentos de categoría 1 (aHR: 1,62; 95%CI: 1,30–2,03) y los de la categoría 2 (aHR: 1,54; 95%CI: 1,19–1,99). El hallazgo nulo observado con la categoría 3 permaneció después del ajuste. También realizaron un análisis de sensibilidad estratificando por edad (18-50 años y 51-64 años). Este reveló hallazgos similares para los medicamentos de la categoría 1 y para la categoría 2 en el análisis principal, pero un mayor riesgo de cáncer de mama para mujeres más jóvenes con edad 18 a 50 años que toman medicamentos de la categoría 2 ajustada para los factores de riesgo conocidos más edad (aHR: 1,91; 95%CI: 1,21–3,01) en comparación con mujeres de edades de 51 a 64 años (aHR: 1,43; 95%CI: 1,01–2,03; Cuadros suplementarios 7 y 8, http://links.lww.com/JCP/A796 ).
Discusión
En el mayor estudio observacional de evaluación del riesgo de cáncer de mama en mujeres de EEUU (edades 18-64 años) que consumen antipsicóticos, observamos que las mujeres que surtieron prescripciones de antipsicóticos de las categorías 1 y 2 según su capacidad para elevar la prolactina, tienen un riesgo significativamente más elevado (54%-62%) de cáncer de mama por 1-unidad en las DDD, en comparación con mujeres con prescripciones de anticonvulsivantes y/o litio, después de ajustar por edad y otros factores de riesgo conocidos para el cáncer de mama. Este es el primer informe de aumento del riesgo de cáncer de mama en EEUU, en mujeres que inician tratamiento con antipsicóticos que se recetan con frecuencia. Muchos de los medicamentos de la categoría 2 se considera que tienen un potencial moderado para elevar la prolactina, pero aun así se asociaron con mayor riesgo de cáncer de mama. Dada la duración esporádica del uso de los medicamentos antipsicóticos en esta población del mundo real, podría ser más informativo comparar el riesgo asociado con pasar del percentil 25 al percentil 75 de DDD de fármaco expuesto. Para los medicamentos antipsicóticos de categoría 1, el incremento asociado con pasar desde el percentil 25 al percentil 75 (0,01 a 0,11 DDD) de utilización podría resultar en un 6,2% de incremento del riesgo de cáncer de mama invasivo en un seguimiento máximo de 6 años. De igual manera, por el mismo aumento de utilización de antipsicóticos de categoría 2 (0,03 DDD para el percentil 25 a 0,30 DDD para el percentil 75) el incremento de riesgo cáncer de mama asociado en esta población es de 14,6%.
Fortalezas del estudio
El estudio incluyó una amplia población de mujeres y utilizó tres categorías diferenciadas de antipsicóticos que se compararon con un grupo de control activo (tratamiento con solo anticonvulsivantes y/o litio). Al usar como comparador activo a los psicotrópicos que se utilizan con frecuencia, se compararon poblaciones con probables diagnósticos psiquiátricos para reducir la confusión por indicación [31]. Hemos controlado los factores conocidos de riesgo de cáncer de mama invasivo disponibles en los datos de las bases administrativas de datos y utilizamos un modelo riguroso para calcular la exposición a los medicamentos al utilizar DDD y calcular la exposición diaria a un medicamento individual a lo largo del periodo observado con un seguimiento máximo de 6 años. Hemos observado que la categoría 1 (mayor potencial de elevación de prolactina) y los medicamentos de categoría 2 se asociaron con aumento significativo del riesgo, mientras que los medicamentos de la categoría 3 sin potencial para elevar la prolactina no se asociaron con incremento del riesgo de cáncer de mama. Hubo suficiente número de pacientes en cada categoría de medicamentos. Los datos son consistentes con estudios previos con diseños similares que sugieren la posibilidad de que los antipsicóticos contribuyan al riesgo de cáncer de mama pero también se basa en investigaciones previas que sugieren que este riesgo podría estar limitado a los medicamentos con mayor propensión de elevar la prolactina [2-4, 6]. El hallazgo nulo para los medicamentos de la categoría 3 proporciona evidencia adicional de que el incremento del riesgo de cáncer de mama observado con las categorías 1 y 2 se puede deber a la elevación de los niveles de prolactina
Limitaciones de estudio
La mediana de duración del seguimiento en cada grupo fue aproximadamente de 4 años. Es posible que tengan que transcurrir varios años para desarrollar cáncer de mama cuando se eleva la prolactina sérica; por tanto, se precisan estudios con un periodo de observación más largo que confirmen nuestros hallazgos. El promedio de exposición diaria a las diferentes categorías de medicamentos durante el periodo de observación se utilizó para cuantificar la exposición, debido al uso intermitente de antipsicóticos. Para establecer una cohorte de nuevas usuarias, solo inscribimos a las mujeres que habían estado aseguradas durante 12 meses sin recibir los medicamentos incluidos en el estudio, sin embargo, dado el episódico uso de estos medicamentos y la duración promedio de cobertura de los seguros, es posible que algunas mujeres incluidas en nuestro estudio como “nuevas usuarias” hubiera utilizado previamente los fármacos en estudio. Aunque hemos sido incapaces de controlar por factores de confusión residuales como paridad, menopausia, historia familiar de cáncer de mama, alcohol, estilo de vida sedentario, dieta, obesidad, edad del primer parto, y raza, el ajuste por tipo de enfermedad mental diagnosticada puede haber reducido los factores residuales de confusión, debido a la coocurrencia con estas condiciones. Los niveles séricos reales de prolactina puede que no reflejen las tres categorías de antipsicóticos, y todos los pacientes que toman antipsicóticos pueden no tener la supuesta respuesta a la prolactina.
Los análisis de la población no incluyeron a mujeres de 65 años o más, porque nuestra versión de la base de datos Comercial está limitada a personas menores de 65 años. Aunque el número de encuentros E&M durante el periodo previo a la fecha índice fue muy similar en las mujeres con y sin cáncer de mama, la falta de detalles clínicos en la base de datos no nos permite descartar algún grado de sesgo de evaluación. También es posible que los clínicos favorecieran los antipsicóticos de la categoría 1 frente a otros dependiendo de la gravedad de la enfermedad mental, cobertura del seguro, etc. y que estos otros factores estuvieran asociados con factores de confusión del riesgo.
A pesar de estas limitaciones, los ajustes realizados han producido resultados consistentes con la literatura conocida sobre los factores de riesgo para cáncer de mama invasivo [32]. Finalmente debemos considerar posibles factores de confusión cuando se compara a las mujeres que toman anticonvulsivantes o litio con aquellas que toman antipsicóticos. Faltan datos epidemiológicos sobre el número de partos de las mujeres con enfermedad mental grave. Sin embargo, hemos señalado que un estudio ha informado un menor número de partos en las mujeres con trastorno bipolar [33], y otro estudio informó que las mujeres con esquizofrenia tuvieron un número de partos similar que la población general [34]. Estas fortalecen nuestros hallazgos, ya que un elevado número de partos ejerce un efecto protector sobre el riesgo de cáncer de mama.
Implicaciones clínicas
Los pacientes con enfermedad mental afrontan disparidades en el cribado y prevención de cánceres frecuentes y tienen mayor probabilidad de morir de cáncer de mama, y las mujeres con trastornos psicóticos tienen aproximadamente la mitad de las posibilidades que tiene la población general de recibir una mamografía de cribado [35]. Nuestros datos y los de otras publicaciones [36-43] sugieren que el uso de antipsicóticos que elevan la prolactina puede contribuir a casos incidentes de cáncer de mama. Nosotros también hemos informado una sorprendentemente elevada asociación del riesgo de cáncer de mama con antipsicóticos de la categoría 2, particularmente en mujeres jóvenes, edades 18 a 50 años. Hemos señalado que hay dos nuevos estudios europeos que han encontrado evidencia de aumento del riesgo de cáncer de mama tras la exposición a dosis acumuladas de medicamentos que elevan la prolactina. Un estudio de una cohorte danesa que incluyó a todos los residentes y su uso de antipsicóticos durante 20 años documentó un bajo riesgo de cáncer de mama asociado al uso de antipsicóticos de primera y de segunda generación en comparación con las mujeres con cáncer de mama que no recibieron tales prescripciones (HR: 1,18; 95%CI: 1,06–1,32). En este estudio danés se vio un patrón dosis-respuesta, con una asociación ligeramente más fuerte con mayor exposición acumulada [11]. Un estudio finés de ámbito nacional en mujeres con esquizofrenia observó que la exposición a antipsicóticos que elevan la prolactina versus antipsicóticos que no afectan la prolactina durante 5 o más años (pero no entre 1-4 años) se asoció con un incremento del riesgo de cáncer de mama (aOR: 1,56; 95% CI: 1,27–1,92) [36]. Nuestro hallazgo en mujeres de EEUU proporciona soporte adicional a que el aumento de la prolactina circulante podría ser el mecanismo biológico para el incremento del riesgo de cáncer de mama que se ha observado.
Los riesgos de todos los medicamentos se deben sopesar contra sus potenciales beneficios. Los medicamentos antipsicóticos pueden salvar vidas y no necesariamente se deben evitar por el posible riesgo de cáncer de mama [37]. Nuestro hallazgo aporta información adicional sobre el perfil de seguridad de los antipsicóticos y puede ser útil para los pacientes que estén considerando el uso de estos medicamentos. Para diseñar intervenciones apropiadas para mujeres que toman antipsicóticos es necesario hacer estudios prospectivos que incluyan biomarcadores predictivos (niveles de prolactina expresión de genes de prolactina, y densidad de las mamografías de mama). Mientras tanto, recomendamos vigilancia para mitigar el riesgo de cáncer de mama, monitorizando los niveles séricos de prolactina, particularmente en aquellas mujeres tratadas con medicamentos de las categorías 1 y 2, incluyendo las más jóvenes. Sin embargo, es posible que las mujeres con alto riesgo de cáncer de mama a quienes se les han prescrito medicamentos de categoría 1 o 2 sean consideradas para hacerse mamografías más frecuentes. El hallazgo de riesgo elevado de cáncer de mama en mujeres más jóvenes plantea interrogantes sobre los efectos a largo plazo del tratamiento de niños y adolescentes. Algo tranquilizador es que la hiperprolactinemia puede mitigarse reduciendo las dosis de antipsicóticos, cambiando a antipsicóticos de la categoría 3, añadiendo agonistas dopaminérgicos, o añadiendo bajas dosis de aripiprazol [6, 22].
Se necesitan antipsicóticos que modifiquen la prolactinemia o estudios con combinaciones con agonistas parciales de dopamina (particularmente con inyectables de larga duración).
En conclusión, los psiquiatras deben utilizar aproximaciones centradas en el paciente para reducir el riesgo de cáncer de mama, considerando la totalidad de riesgos y beneficios de los antipsicóticos en pacientes mujeres que comienzan tratamiento y los siguen utilizando. Además, hay que hacer investigación prospectiva sobre el riesgo de cáncer de mama relacionado con los antipsicóticos, incluyendo estudios de la prolactina sobre la densidad del tejido mamario (un fuerte correlato para el riesgo de cáncer de mama). Los clínicos deben considerar factores tales como mutaciones genéticas, alta densidad del tejido mamario, historia familiar, número de partos, y uso de hormonas exógenas cuando traten a pacientes que necesitan antipsicóticos [1]. Estamos de acuerdo con las conclusiones del reciente estudio de Finlandia, de que los antipsicóticos sin propiedades elevadoras de la prolactina deben ser considerados como la primera línea de tratamiento a largo plazo para las mujeres [36]. Muchos antagonistas de la dopamina elevan la prolactina, incluyendo los antieméticos [4], se utilizan para el cuidado de una amplia variedad de problemas, incluyendo las náuseas inducidas por la quimioterapia, así como para la agitación y el delirio. Es tranquilizador que con el uso a corto plazo de antipsicóticos no se ha notificado incremento de riesgo cáncer de mama [11, 36]. Para el uso a largo plazo se deben considerar las concentraciones de prolactina inicial y durante las dosis de mantenimiento (junto con los usuales lípidos, índice de masa corporal, y parámetros metabólicos) [36], y en casos de hiperprolactinemia, cambiar a medicamentos de la categoría 3 o también se debe considerar mitigar las concentraciones elevadas de prolactina con medicamentos concomitantes (aripiprazol / brexpiprazol [22] o agonistas dopaminérgicos), para reducir el riesgo de cáncer de mama.
Declaracion de conflicto de intereses.
Todo el trabajo se ha realizado en la escuela de medicina de la Universidad de Washington en St Louis. Los autores han recibido apoyo de: Alvin J. Siteman Investment Program (The Foundation for Barnes-Jewish Hospital Cancer Frontier Fund; NCI CCSG P30CA091842; Fashion Footwear Charitable Foundation of New York, Inc; Barnard Trust); Taylor Family Institute for Innovative Psychiatric Research; and Center for Brain Research in Mood Disorders. Los autores declaran no tener conflictos de intereses.
Referencias
Comentario:
El estudio de Rahman y cols [1] parte de la hipótesis de que hay una relación causal entre la capacidad hiperprolactemiante de un antipsicótico y el desarrollo del cáncer de mama, encontrándose un aumento del riesgo de sufrir cáncer (entre un 30 y un 90%, según distintos ajustes). La evidencia de dicha asociación se ha visto reforzada por nuevos datos [2].
Aunque se trata de un estudio observacional, parten de extensas bases de datos que contienen información relevante y pertinente para el problema que pretenden estudiar. Las variables escogidas para el análisis y la forma de clasificar los eventos de interés parecen dar poco lugar a subjetividad. El análisis y discusión de los resultados es riguroso y adecuado, además realizan diversos ajustes y análisis de sensibilidad, encontrando sistemáticamente los mismos resultados, lo que supone una fortaleza considerable. Los autores discuten adecuadamente los posibles sesgos, debilidades y fortalezas del estudio, y la coherencia con otros estudios sobre el mismo problema.
Rahman y cols [1] tratan de huir de la clasificación de los antipsicóticos en primera y segunda generación, inadecuada para el propósito. Agrupan los medicamentos antipsicóticos en tres categorías 1 a 3, según Rahman y cols, de más a menos capacidad hiperprolactemiante. En la categoría 1 incluyeron a los neurolépticos: clorpromazina, flufenazina, haloperidol, loxapina, molindona, paliperidona, perfenazina, pimozida, proclorperazina, risperidona, tioridazina y trifluoperazina. En la categoría 2 a iloperidona, lurasidona y olanzapina. Y en la categoría 3 a aripiprazol, asenapina, brexpiprazol, cariprazina, clozapina, quetiapina y ziprasidona. Encontraron que el riesgo de cáncer de mama era más elevado en las usuarias de antipsicóticos, como grupo en conjunto, y en las consumidoras de antipsicóticos de la categoría 1 y la categoría 2, pero era nulo para la categoría 3.
Sorprende que Rahman y cols [1] prácticamente no encontraron diferencias entre las categorías 1 y 2 en los diferentes ajustes y análisis de sensibilidad que llevan a cabo, a pesar de que los medicamentos de la categoría 1 son más hiperprolactemiantes, y por tanto debiera esperarse que surgieran diferencias en el incremento de riesgo relacionado.
Una posible explicación podría ser que la categoría 1 está compuesta por una mezcla demasiado heterogénea en cuando a la capacidad de producir hiperprolactinemia. Aunque se supone que todos los antipsicóticos de primera generación son hiperprolactemiantes, la verdad es que hay pocos datos al respecto [3]. Cuando se analizaron los métodos de evaluación de efectos adversos de los antipsicóticos, en la base de datos del Cochrane Schizofrenia Research Group, de 167ensayos clínicos publicados entre 2002 y 2007, solo el 34% aportaban medidas de los niveles de prolactina sérica en los participantes, y solo poco más del 20% en un diseño aleatorizado a doble ciego [4]. Un estudio de sustitución aleatorizada de antipsicóticos de primera generación en forma de inyectables de depósito (haloperidol decanoato y flufenazina decanoato) por risperidona microesferas de liberación sostenida inyectables encontró que los primeros causaban sensiblemente menos hiperprolactinemia que la risperidona [5]. No todos los antipsicóticos de primera generación son igual de hiperprolactemiantes que el amisulpride, risperidona y paliperidona, salvo sulpiride y posiblemente haloperidol y tioxantenos, lo que se manifiesta en una falta de acuerdo en la jerarquía sobre la capacidad hiperprolactemiante de los antipsicóticos y la desigual clasificación en distintas revisiones [3, 6-8]. La menor capacidad hiperprolactemiante de los antipsicóticos fenotiazínicos respecto a muchos antipsicóticos atípicos clasificados en las categorías 1 y 2 por Rahman y cols ha sido evidenciada también por un metaanálisis sobre la eficacia y seguridad de 32 antipsicóticos [9] y corroborado por otro metaanaálisis posterior [10]. Por otra parte, se ha observado una importante variabilidad en la elevación de la prolactina inducida por un mismo antipsicótico, y esta variabilidad además difiere de un agente a otro, posiblemente por múltiples causas biológicas y metodológicas [11].
Otra explicación adicional podría deberse a la errónea consideración de mayor benignidad de los antipsicóticos de la categoría 2, lo que puede facilitar que lleguen a prescribirse a dosis mayores, e incluso a prescribirlos selectivamente a mujeres con otros factores de riesgo de cáncer de mama. En el estudio de Rahman y cols [1] los antipsicótico clasificados en el grupo 2 podrían estarse empleando a dosis altas y en ellos el efecto hiperprolactemiante podría ser más fuertemente dosis dependiente, puesto que las dosis expresadas en DDD para los antipsicóticos de la categoría 1 (percentil 25: 0,01 DDD a percentil 75: 0,11 DDD) eran más bajas que para los de la categoría 2 (0,03 DDD para el percentil 25 a 0,30 DDD para el percentil 75). Paralelamente, el incremento de riesgo hallado al pasar del percentil 25 al percentil 75 de dosis; para la categoría 1 este aumento fue del 6% por 1DDD, mientras que para la categoría 2 fue 14,6%.
También consideramos necesario comentar las recomendaciones que hacen en la discusión para evitar o manejar la hiperprolactinemia y consecuentemente el incremento del riesgo de cáncer de mama por antipsicóticos. Acertadamente comentan [1] la necesidad de mejorar el acceso a servicios preventivos de cáncer de mama (en general de asistencia a la salud) de las personas, especialmente mujeres, con trastornos psicóticos (u otros problemas de salud mental), especialmente si reciben medicamentos antipsicóticos altamente hiperprolactemiantes, también recomiendan medir basal y periódicamente la prolactina sérica en las mujeres (pero también en los varones) que emplean antipsicóticos especialmente si estos pertenecen a las categorías 1 y 2. Además recomiendan limitar las dosis empleadas y evitar los fármacos de estos grupos en mujeres con riesgos adicionales de cáncer de mama.
La hiperprolactinemia inducida por antipsicóticos parece ser dosis dependiente [6]. Pero la reducción de la dosis es poco efectiva para reducir el efecto hiperprolactemiante, en el caso de algunos de los antipsicóticos más problemáticos: risperidona, paliperidona y amisulpiride, ya que esta se manifiesta ya a dosis bajas [7]. En estos últimos casos, la propuesta de cambiar de antipsicótico a otro con menor propensión a la hiperprolactinemia parece razonable, habida la diferencia entre los distintos agentes de este grupo farmacológico en su propensión a causar efectos adversos a dosis efectivas [9]. No obstante en ocasiones, por diversos motivos, el cambio de antipsicótico puede resultar problemático [12]. En este segmento, podría ensayarse la recomendación del uso conjunto de antipsicóticos hiperprolactemiantes con dosis bajas de antipsicóticos agonistas parciales de dopamina, como aripiprazol.. No obstante, no debe olvidarse que existe una carencia de estudios a largo plazo con esta asociación, y algunos de los problemas relacionados con el cambio de antipsicótico se producirían también al emplear la polifarmacia [13].
La práctica de cambiar a o de coprescribir aripiprazol ante la aparición de hiperprolactinemia en un sujeto que recibe antipsicóticos no debe ser automática. La disponibilidad de un nivel basal de prolactina ayudaría a establecer la relación causal con el empleo del antipsicótico. En caso de que no haya una clara evidencia temporal deberían descartarse otras posibles causas: hipotiroidismo, enfermedad renal crónica, embarazo, adenoma pituitario, que requieren una corrección específica [8].
La asociación con antagonistas de la dopamina, como cabergolina, debería reservarse para casos en los que la hiperprolactinemia se deba a prolactinomas, valorando el riesgo de valvulopatía y emergencia de síntomas psicóticos. Su empleo en sujetos con psicosis es solo anecdótico [14].
Las propuestas de asociación de fármacos antagonistas con agonistas parciales o con agonistas de los mismos receptores es una práctica irracional; taponar una cerradura y simultáneamente querer abrirla. En el problema que nos ocupa, los que proponen esta práctica olvidan que el uso de fármacos antipsicóticos no es imprescindible en el tratamiento de las psicosis y que existen alternativas para pacientes que no pueden o no quieren recibir antipsicóticos [15, 16].
Bibliografía del cometario