Un artículo publicado a comienzos de este año en Nature Reviews Drug Discovery [1] analiza la tendencia de aprobación de nuevas entidades terapéuticas (NTDs por sus siglas en inglés) por parte de la FDA para el período del 2000 – 2020, así como el valor de ventas máximas que se había proyectado durante el primer año de su aprobación. A continuación, nuestra selección de los contenidos principales del resumen en inglés de la citada publicación.
Algunas de las interesantes cifras que ofrece el artículo son:
- El número promedio de NTDs aprobadas anualmente para el período del 2000-2013 fue de 31.
- El número promedio de NTDs aprobadas anualmente para el período del 2014-2020 fue de 51.
- En el 2020, el Centro de Evaluación e Investigación de Medicamentos (CDER) y el Centro de Evaluación e Investigación de Productos Biológicos (CBER), ambos de la FDA, aprobaron 56 NTD. Según los investigadores, que este valor esté ubicado por encima del promedio para el período 2014-2020 va en línea con la perspectiva positiva que tenían para ese año [2]. Si se cuentan las dos vacunas que recibieron Autorización de Uso en Emergencia como NTD, se aprobaron 58 NTD.
- El promedio de ventas anuales proyectadas para todas las NTDs aprobadas cada año en el período del 2000-2020 fue de US$48.000 millones.
- La suma de las ventas máximas anuales proyectadas para la cohorte de NTD aprobadas en el 2020 está por debajo del promedio, en US$39.000 millones. Las ventas de las dos vacunas contra el COVID-19 agregarían aproximadamente US$7.000 millones a este total.
- El promedio de ventas pico por NTD para el período del 2000-2020 es de US$1.300 millones.
- La mediana de ventas pico por NTD para el período del 2000-2020 es de US$500 millones.
- El pronóstico de ventas pico promedio por NTD para el 2020 es de US$700 millones y la mediana es de US$400 millones. Si se agregan las vacunas contra el COVID-19, el promedio aumenta ligeramente a US$800 millones, mientras que la mediana se mantiene.
- El aporte a las de aprobaciones de NTD por parte de las grandes farmacéuticas disminuyó en el 2020, a pesar de un ligero incremento en el 2019.
- La contribución de las 20 principales compañías farmacéuticas al total de las aprobaciones en el 2020 fue del 35% y a las ventas anuales máximas proyectadas fue inferior al 50%. Este fue un mínimo histórico para ambas categorías.
- Las áreas de terapia que más aprobaciones recibieron fueron oncología y los antiinfecciosos, incluyendo las vacunas contra el COVID-19. Cada una aportó al total de aprobaciones analizadas el 31% y el 17%, respectivamente. En valores, la proporción de aporte fue aún mayor, con un 36% para oncología y un 21% para antiinfecciosos.
- Para más información puede verse la figura 1.
Figura 1. Número de NTDs aprobadas para el período del 2000-2020 y ventas máximas totales anuales
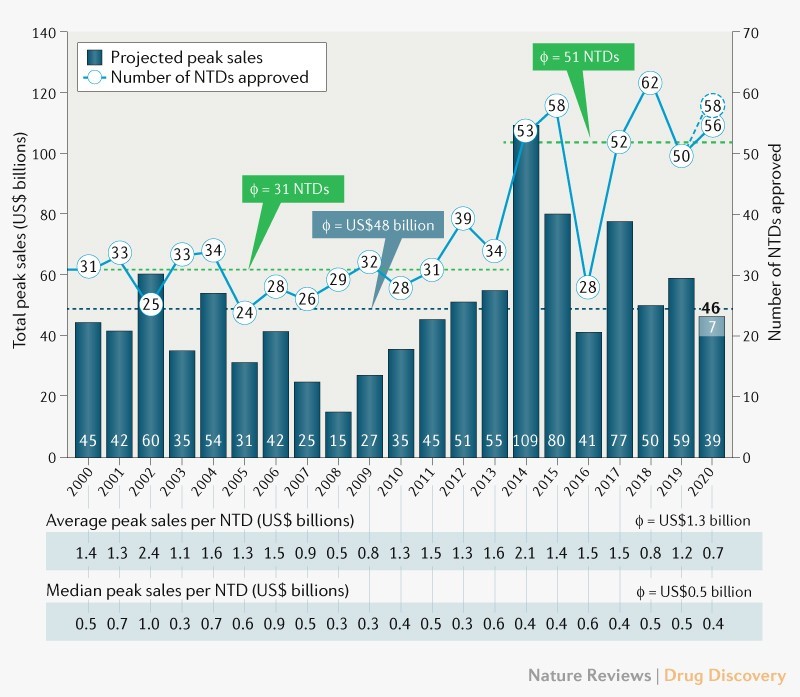
Fuente: [1] quien a su vez utiliza información de EvaluatePharma, la FDA y Boston Consulting Group analysis.
Aclaraciones de los investigadores:
- En el cálculo de las NTDs, se excluyeron los contrastes para las pruebas diagnósticas por imagen; y los productos combinados con al menos una entidad molecular nueva como ingrediente activo se incluyeron.
- Al igual que en años anteriores, se incluyeron las nuevas vacunas. Además, dado que se espera un uso generalizado de aquellas que recibieron Autorización para Uso en Emergencia antes de su aprobación oficial por parte de la FDA, también se evaluó su contribución a las proyecciones de ventas.
- El análisis se basa exclusivamente en las aprobaciones de la FDA y el año en el que tuvo lugar la aprobación de la primera indicación.
- Para el 2020, también se muestran los valores correspondientes cuando se cuentan como NTDs las dos vacunas contra el COVID-19 que recibieron Autorizaciones para uso en emergencia.
- EvaluatePharma fue la fuente de los valores máximos de ventas.
- Economist Intelligence Unit aportó los datos de inflación basados en el PIB global estándar, lo que permitió ajustar los valores máximos de ventas a la inflación al 2020.
- El valor de las ventas máximas de cada NTD se obtuvo revisando las ventas reales históricas y la gama completa de ventas previstas (disponibles en EvaluatePharma). Se seleccionó el valor más alto.
En concepto de los autores, “el mantenimiento de un elevado número de aprobaciones en el 2020 y la abundancia de líneas de producción a pesar del COVID-19 son una prueba más de que la productividad de la I+D ha dado un giro para romper la ‘Ley de Eroom’ en los últimos años [3]”. La ley de Eroom responde a la observación de que, a lo largo del tiempo, el descubrimiento de nuevos productos se ha enlentecido y es más caro, a pesar de la tecnología.
Finalmente, consideran que dicha tendencia podría seguir en los próximos años gracias a “las lecciones aprendidas con las estrategias de desarrollo de medicamentos que se han explorado durante la pandemia, como los ensayos descentralizados o híbridos, los diseños de ensayos adaptativos y el desarrollo de medicamentos basados en modelos”
Referencias
- Baedeker M, Ringel M, Schulze U. 2020 FDA approvals: momentum kept despite COVID-19, but value falls. Nature Reviews Drug Discovery. 15 de enero de 2020. https://doi.org/10.1038/d41573-021-00016-8 https://www.nature.com/articles/d41573-021-00016-8
- Baedeker, M., Ringel, M., Schulze, U. Value of 2019 FDA approvals: back to the recent average. Nature Reviews Drug Discovery. 7 de enero de 2020. https://www.nature.com/articles/d41573-020-00002-6
- Ringel, M. S., Scannell, J. W., Baedeker, M., Schulze, U. Breaking Eroom’s Law. Nature Reviews Drug Discovery. 16 de abril de 2020. https://www.nature.com/articles/d41573-020-00059-3
