Agencias Reguladoras
Estados Unidos
La FDA está aprobando medicamentos a una velocidad impresionante (The FDA is approving drugs at a staggering pace)
Caroline Chen, James Paton
Bloomberg News, 6 de octubre de 2017
https://www.bloomberg.com/news/articles/2017-10-06/flurry-of-drug-approvals-has-wall-street-eyeing-pharma-profits
Traducido por Salud y Fármacos
La parálisis (embotellamiento, en inglés gridlock) bajo la administración de Trump, particularmente los fracasos repetidos para derogar y reemplazar a Obamacare, está cautivando la atención de la nación. Sin embargo, al menos una agencia del gobierno funciona sin problemas e incluso acelera sus operaciones.
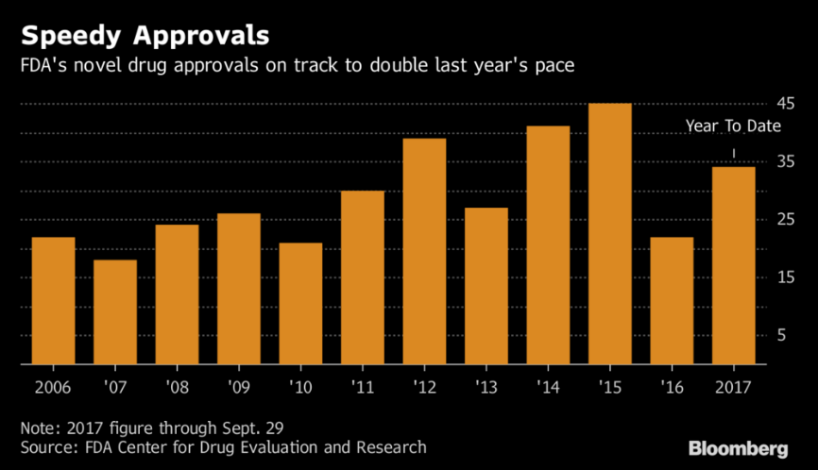
La FDA, bajo el comisionado Scott Gottlieb, está aprovechando las políticas que se establecieron en los últimos años para acelerar las aprobaciones de medicamentos. Treinta y cuatro medicamentos, que tratan todo tipo de problemas, desde cáncer hasta enfermedades genéticas raras, han sido aprobadas en lo que va de año. Parece que va camino de duplicarse el número de aprobaciones del año pasado. Hasta ahora, al menos nueve decisiones se hicieron más de 20 días antes de la fecha programada por la FDA.
Wall Street está prestando atención, algunos administradores de carteras de inversión están cambiando sus estrategias, anticipando aprobaciones más rápidas y etiquetas menos restrictivas. Desde su perspectiva, la vida bajo el nuevo jefe de la FDA tiene sus ventajas e inconvenientes. Por un lado, una agencia más permisiva es una gran ayuda para la industria, que típicamente solo llega a comercializar el 12% de los medicamentos experimentales que se testan en humanos. Por otro lado, aprobaciones más amplias sobre las indicaciones de los medicamentos puede dar más poder a las aseguradoras para forzar la competencia de precios, reduciendo las ganancias esperadas con los nuevos medicamentos.
Samuel Isaly es gerente de la empresa que trabaja en salud OrbiMed Advisors y legendario inversionista en biotecnología; de acuerdo a Barron’s Magazine, superó consistentemente al S & P 500 durante 25 años consecutivos, de 1990 a 2015. Dice que nunca ha visto nada como la reciente ráfaga de las aprobaciones de la FDA.
Trump, representado por Gottlieb, ha alentado la competencia como forma de reducir los precios”, dijo Isaly. “Me gusta la idea de poner más medicinas a disposición de más personas a un precio más razonable, así que como ser humano, no como inversionista, creo que es algo muy positivo”.
Ley de 2012
Las aprobaciones más rápidas no se deben solo a la nueva administración. Las acciones de la agencia se deben en parte a la legislación aprobada en 2012 que creó mecanismos para reducir los tiempos de revisión, como la designación de “Terapia Avanzada” (con implicaciones importantes para la salud) y la ampliación del uso de aprobaciones aceleradas. Ambas desembocan en una revisión más rápida de los medicamentos que se considera que proporcionan una mejora sustancial a los pacientes con necesidades extremas.
Las existencias de medicamentos también han aumentado. Desde el comienzo del año, el índice Nasdaq Biotechnology Index, una medida clave del sentimiento de los inversionistas en relación a la industria farmacéutica, ha subido un 29%, superando otros índices más amplios.
Desde que fue nombrado comisionado en mayo, Gottlieb ha resaltado su deseo de abordar el aumento de los precios de los medicamentos alentando la competencia, haciéndose eco de los sentimientos del presidente Donald Trump, quien durante la campaña se comprometió a reducir los costos de los medicamentos. Hace poco se habló de Gottlieb como posible nuevo jefe de los Servicios Humanos y de Salud, a raíz de la renuncia de Tom Price.
La agencia enfatiza que los cambios para acelerar el proceso no son a expensas de la seguridad.
“La FDA toma decisiones basadas en principios científicos consistentes y rigurosos”, dijo la portavoz Sandy Walsh en un correo electrónico. “Siempre estamos implementando reformas para modernizar y fortalecer la forma en que determinamos la seguridad y la eficacia, al tiempo que mejoramos la eficiencia del proceso de desarrollo y revisión de medicamentos”.
Buena información
Joep Muijrers, socio de la empresa de inversión LSP, recomienda algo de precaución para los inversionistas entusiastas: mientras se siente animado por las acciones rápidas de la agencia, no ve que se bajen los estándares.
“Todavía tiene que mostrar datos convincentes”, dijo Muijrers. “Si está pensando, llevemos a la FDA un conjunto de datos subóptimo y obtengamos la aprobación, no creo que suceda”.
Si bien las decisiones reguladoras rápidas se suelen considerar ventajosas para la industria farmacéutica, los administradores de carteras de inversión están indecisos con la aprobación de medicamentos para grupos de pacientes más grandes que en el pasado. Lynparza de AstraZeneca fue aprobado el 17 de agosto para pacientes con cáncer de ovario, independientemente de si las pacientes son portadoras de una mutación genética llamada BRCA.
Esto sorprendió a los analistas, que esperaban que la etiqueta solo incluyera a pacientes BRCA positivo, que fueron las que participaron en el ensayo clínico principal de AstraZeneca. Una etiqueta más amplia significaba que Lynparza es comparable al tratamiento competitivo de Tesaro Inc., que había demostrado en los ensayos que funcionaba tanto para pacientes BRCA positivos como negativos.
La decisión de la agencia llevó a Kennen MacKay, un analista de RBC Capital, a calificar a Tesaro como neutral en lugar de comprar porque su droga perdió la ventaja que tenía sobre AstraZeneca.
Competencia en el tratamiento del cáncer
John Schroer, jefe del sector de atención médica en EE UU en Allianz Global Investors, dijo que le preocupa que etiquetas más amplias introduzcan la competencia de precios al ámbito del cáncer, un área terapéutica que, hasta la fecha, ha sido bastante resistente a la presión por los precios.
“A menudo las etiquetas de los productos de oncología son ligeramente diferentes, y por lo tanto los financiadores no pueden decir ‘Dame una oferta'”, dijo Schroer. “Como financiador, si puedo sostener estas dos etiquetas y no veo diferencias, puedo ir a los fabricantes y decir: ‘¿Quién quiere medicar a todos mis pacientes?'”.
Otra sorpresa para Wall Street fue la decisión de la agencia de otorgar a Celgene Corp. y Agios Pharmaceuticals Inc. la aprobación completa de su medicamento contra el cáncer para adultos con una forma de leucemia mieloide aguda avanzada. La aprobación, el 1 de agosto, llegó casi un mes antes de la fecha prevista.
Las empresas habían presentado datos de un ensayo de brazo único, lo que significa que todos los pacientes recibieron el medicamento, sin compararlo con el estándar de atención o el placebo. Como tal, los analistas esperaban que la agencia otorgara una “aprobación acelerada”, un asentimiento condicional que permite que el medicamento salga al mercado, mientras el fabricante realiza estudios adicionales para confirmar el beneficio del tratamiento.
Isaly de Orbimed dice que ahora está incorporando esta tendencia en sus apuestas.
“Frente a la duda, estamos más dispuestos a apostar por la aprobación en lugar del rechazo”, dijo. “No solo hay una mayor probabilidad de aprobación, sino una etiqueta más amplia y expansiva”.