NOTA DE LOS EDITORES
En este número iniciamos una sección de Debates. Dada la importancia de los medicamentos genéricos, de los grandes ahorros que suponen tanto para el sector público como para el privado hemos escogido este tema para iniciar esta sección. La ocasión la ha dado la controversia surgida en Argentina por la decisión del ministro de salud de fomentar su uso y la reaccionaria respuesta de Asociación Médica Argentina. La posición de los editores de Boletín Fármacos es clara, seguimos los lineamientos avanzados por la OMS que recomienda a todos los países utilizar genéricos.
A continuación presentamos varios documentos que exponen posiciones divergentes y comentarios que hemos recibido de diferentes lectores. Esperamos que su lectura sea de utilidad no solo para los ciudadanos de Argentina sino para los de otros países de la región que se enfrentan realidades muy semejantes. Sabemos que muchos médicos así como el público prefiere medicamentos de marca, en parte por falta de conocimiento sobre el tema, en parte por el lavado de cerebro a que les ha sometido la gran industria farmacéutica. El marketing no tiene objetivos educativos, y es casi imposible contrarrestarlo por su grado de sofisticación y por la cantidad enorme de dinero que la industria invierte en la promoción de sus productos.
LA ASOCIACIÓN MÉDICA ARGENTINA SE OPONE A QUE LOS FARMACÉUTICOS SUSTITUYAN LAS RECETAS DE MEDICAMENTOS DE MARCA POR GENÉRICOS
Antonio Ugalde
INFORMACIÓN ACTIVA SOBRE MEDICAMENTOS. LOS MEDICAMENTOS GENÉRICOS: ¿QUÉ NECESITAMOS SABER?
Viviana Correa Salde, Sonia Uema, Nancy Solá, Centro de Información de Medicamentos, Departamento de Farmacia Facultad de Ciencias Químicas, Universidad Nacional de Córdoba
SOBRE LA PRESCRIPCIÓN POR NOMBRE GENÉRICO
Emilio Cermignani, Presidente eccermig@isis.unlp.edu.ar, Mario Meuli, Secretario mmeuli@sinectis.com.arGrupo Argentino para el Uso Racional de los Medicamentos
MEDICAMENTOS GENÉRICOS. BOLETÍN DEL COLEGIO DE MÉDICOS DE LA PROVINCIA DE SANTA FE. 2a, CIRCUNSCRIPCIÓN
Dr. Hugo Oteo, Asesor en Medicamentos, Colegio de Médicos de la Provincia de SanFe2a Circunscripción, Rosario, Argentina
RESPUESTA DEL GOBIERNO ARGENTINO A LA CRISIS: CANASTA DE MEDICAMENTOS, GENÉRICOS Y LA INDUSTRIA FARMACÉUTICA
Crearán una canasta de medicamentos La Nación 16-02-02, Acuerdo para lanzar una canasta de medicamentos Clarin 16-02-02, Un anuncio que no será gratuito Clarín 16-02-02, Acuerdo para retrotraer el precio de 50 remedios de consumo básico Página/12 – 16-02-2002, La escalada contra los laboratorios Página/12 22-02-2002
¿QUÉ PASA CON LOS GENÉRICOS DE LOS LABORATORIOS PÚBLICOS ARGENTINOS?
La Capital – Rosario, 15 de febrero de 2002, La Nación, 16 y 25 de febrero de 2002, La Capital (Rosario), 18 y 19 de febrero de 2002, La Arena(La Pampa) 13 y 15 de febrero de 2002, Noticias Urbanas, 14 de febrero de 2002, Rio Negro, 17 de febrero de febrero de 2002, La Gaceta (Tucumán), 19 de febrero de 2002, La Voz del Interior (Córdoba), 16 de febrero de 2002, Clarín 15 de febrero de 2002
MEDICAMENTOS GENÉRICOS
Colegio de Médicos de la Provincia de Buenos Aires Distrito II
JORNADA SOBRE MEDICAMENTOS
Colegio de Médicos de la Provincia de Buenos Aires, Distrito II y Fundación Óscar Eduardo Allende,
18 de abril de 2002
PRESENTARON AYER EL FORMULARIO NACIONAL DE MONODROGAS
La Nación, 17 de abril de 2002
GENÉRICOS EN COLOMBIA
Francisco Rossi, Red Nacional de Cooperativas de Hospitales de Colombia, Redsalud
COMUNICADO DE PRENSA. COMENTARIOS TÉCNICOS RELACIONADOS CON EL DEBATE DE LOS GENÉRICOS
BRASIL: ANVISA AUTORIZA GENÉRICOS MÁS MODERNOS
La lista de medicamentos para distintos tipos de enfermedades será anunciada en los próximos días.
VENEZUELA: LA INDUSTRIA CUESTIONA DEFINICIÓN DE GENÉRICOS
VENEZUELA: BOLSILLOS ALIVIADOS POR GENÉRICOS
LA ASOCIACIÓN MÉDICA ARGENTINA SE OPONE A QUE LOS FARMACÉUTICOS SUSTITUYAN LAS RECETAS DE MEDICAMENTOS DE MARCA POR GENÉRICOS
Antonio Ugalde
De acuerdo a una carta escrita por la Asociación Médica Argentina (AMA) al presidente de la nación la sustitución “en la dispensación, por parte de profesional farmacéutico, del medicamento recetado con marca registrada, por un medicamento que contenga los mismos principios activos, concentración, forma farmacéutica, cantidad de unidades por envase y menor precio…” afectaría a la población “al lesionar responsabilidades de la actividad médica.”
La AMA añade que transferir semejante responsabilidad menoscaba “no sólo el verdadero valor del acto médico al prescribir una receta, sino además amplía temerariamente las reales incumbencias de una profesión tan digna y necesaria como es la del profesional farmacéutico, cuyo verdadero y fundamental objetivo en la cadena de la atención médica es garantizar a la población de que el producto que expende sea de calidad probada.”
La carta también afirma que lesionaría gravemente la relación médico-paciente, porque “debe recordarse que el acto médico de la prescripción tiene un valor científico, y ético.”
En una comunicación del 18 de abril de 2002 Colegio de Médicos de la Provincia de Buenos Aires Distrito II que se presenta a continuación como parte de este debate clarifica que el problema de los genéricos se debe no tanto al concepto sino a la incapacidad del ANMAT de velar por la calidad de los medicamentos que se venden como genéricos. Añade que países desarrollados que tienen una infraestructura institucional adecuada para controlar la calidad de los medicamentos como es el caso de EE.UU. no hay problema en utilizar los genéricos.
Las declaraciones de AMA son contraproducentes porque equivoca el concepto de genéricos con su control y sirve para perpetuar el mito de que los genéricos son de calidad inferior a los de marca. Se sabe que en muchos países hay un gran fraude y medicamentos falsos se venden como auténticos. Argentina no es una excepción. Si se sigue el argumento de la AMA el ministerio no debería permitir la venta de medicamentos en el país hasta que tuviera un control de la calidad de todos los medicamentos en venta. La posición ética de AMA debiera ser dar su apoyo incondicional a los genéricos y presionar al gobierno para asegurar que los medicamentos genéricos en venta satisfacen la definición de genérico. AMA debiera ofrecer su apoyo para que el control de calidad sea efectivo. Si medicamentos que no son genéricos se venden como tal, estamos frente a un fraude que el gobierno debe castigar. La capacidad o incapacidad del gobierno para hacerlo no justifica atacar el concepto de medicamento genérico. Quizá con los ahorros que supone la venta de genéricos el gobierno puede dedicar más recursos a controlar la cantidad de los medicamentos en el país.
Tampoco es ético que la AMA sugiera que el profesional farmacéutico no tiene capacidad para hacer la sustitución de un medicamento de marca por uno genérico. Generalmente, el farmacéutico sabe más que el médico sobre medicamentos, es su profesión. Se sabe que el entrenamiento de los médicos sobre medicamentos es sumamente débil, y también se sabe que su conocimiento sobre los medicamentos depende un una gran medida en la información que le suministra el visitador pagado por la firma farmacéutica que produce el medicamento. Esta es una información limitada y sesgada, cuyo objetivo principal es aumentar las ventas, no generar conocimiento. Hay estudios ad nausea que confirman esta realidad. Si la persona que intercambia el medicamento en la farmacia es un asistente u otra persona no calificada, esta acción es también fraudulenta y debe ser punible. La posición de la AMA aquí también deber ser acusar el fraude más que atacar el concepto que está siendo utilizado en otros países con éxito.
En vista de estas afirmaciones se puede afirmar que la AMA es la mejor aliada de las transnacionales farmacéuticas e ignora lo que son los medicamentos genéricos. Tiene más intereses en proteger su espacio de poder que en la salud del pueblo y es increíble pensar que en estos momentos de crisis profunda que ha dejado a millones de conciudadanos sin acceso a medicamentos se oponga a la sustitución. Naturalmente, si sus miembros aprendieran a recetar genéricos esta discusión no tendría lugar. Como es sabido, el uso de genéricos está recomendado por la OMS. El consolidado general de propuestas desarrollado por el Colegio de Médicos de la Provincia de Buenos Aires, Distrito II y la Fundación Óscar Eduardo Allende que también se transcribe en esta sección de debates tiene algunas dimensiones positivas pero no debe convertirse en una táctica dilatoria para la venta de genéricos.
Afortunadamente este no parece ser el caso en Argentina, en donde el gobierno ha decidido obligar a las obras sociales a aceptar recetas de medicamentos por su nombre genérico y les exige, como indica la nota de prensa que se publica también en esta sección de Debate, costear los precios de referencia.
INFORMACIÓN ACTIVA SOBRE MEDICAMENTOS. LOS MEDICAMENTOS GENÉRICOS: ¿QUÉ NECESITAMOS SABER?
Viviana Correa Salde, Sonia Uema, Nancy Solá, Centro de Información de Medicamentos, Departamento de Farmacia Facultad de Ciencias Químicas, Universidad Nacional de Córdoba
Introducción
Los medicamentos genéricos son aquellos que están definidos por la Autoridad Sanitaria, con las normas técnicas que el producto debe satisfacer para asegurar calidad, seguridad y eficacia. Generalmente contienen un solo principio activo o una asociación reconocida universalmente como ventajosa y se los denomina por la Denominación Común Internacional (DCI) o por el nombre genérico “oficial” aceptado. Suelen tener un precio sustancialmente inferior que el del medicamento innovador que le sirve de referencia.
Frecuentemente, se emplean como sinónimos algunos términos farmacéuticos y pueden dar origen a confusiones. Es necesario conocer las definiciones precisas de cada uno para diferenciarlos y emplear un vocabulario adecuado.
La Organización Mundial de la Salud (OMS) ha elaborado una estrategia para mejorar el acceso a los medicamentos esenciales y desarrollar mercados nacionales de medicamentos genéricos.
No existen medicamentos genéricos en el mercado argentino. Esto se debe a que no se han definido aún las normas técnicas necesarias para su reconocimiento, por parte de la Autoridad Sanitaria Nacional. Hay algunas propuestas para modificar la legislación Argentina actual. Hasta ahora, legalmente sólo se hace referencia al empleo del nombre genérico.
¿Qué es un medicamento genérico?
Es una especialidad farmacéutica que tiene el mismo principio activo, la misma dosis, la misma forma farmacéutica y las mismas características farmacocinéticas, farmacodinámicas y farmacotécnicas que un medicamento que es utilizado como referencia legal.
El perfil de eficacia y seguridad de una especialidad farmacéutica genérica está suficientemente asegurado por su continuado uso clínico y por la aprobación oportuna de la Autoridad Sanitaria.
Los medicamentos genéricos se comercializan con el nombre de la sustancia medicinal correspondiente seguida de una sigla indicativa de su condición de genérico. En diferentes países se han utilizado como distintivos siglas tales como:
|
Sigla |
País |
|
EFG |
España |
|
GE |
Francia |
|
AIC/G |
Italia |
El medicamento genérico debe demostrar bioequivalencia terapéutica con el medicamento original que le sirve de referencia, por lo tanto ambos son intercambiables ya que poseen la misma eficacia terapéutica.1-2
¿Qué se entiende por bioequivalencia?
Se considera que dos medicamentos son bioequivalentes si:
1. Son equivalentes farmacéuticos: contienen la misma cantidad del mismo principio activo en la misma forma de dosificación.
2. Poseen igual biodisponibilidad: no exhiben diferencias significativas en la cantidad y velocidad de absorción de un mismo principio activo, cuando se administran en la misma dosis, bajo condiciones experimentales similares.
Así, en términos de eficacia y seguridad, los efectos serán esencialmente los mismos (equivalencia terapéutica) y una de las especialidades farmacéuticas puede sustituir a la otra en el tratamiento de una enfermedad o síntoma en un paciente concreto. 1, 3
¿Cuáles son las diferencias que existen entre los medicamentos genéricos y las demás especialidades medicinales?
Las especialidades medicinales autorizadas por la Autoridad Sanitaria competente, para su comercialización en cualquier país, pueden incluirse en distintas categorías entre las que se encuentra el medicamento genérico. En la siguiente tabla se muestran las diferencias observadas entre ellas:
|
Medicamentos Genéricos vs. Especialidades Medicinales |
||||||
|
Medicamento |
Igual principio activo y dosis |
Igual forma farmacéutica |
Bioequivalencia demostrada |
Autorización sanitaria previa |
Derechos de patente |
Nombre de la especialidad |
|
Genérico (1) |
Sí |
Sí |
Sí |
Sí |
No |
DCI+Titular |
|
Innovador |
Sí |
Sí |
No |
Sí |
Sí |
Marca registrada |
|
Similar (2) |
Sí |
Sí |
Sí o No |
Sí |
No |
Marca registrada o DCI+Titular |
|
Similar (3) |
Sí |
Sí |
Sí o No |
Sí |
Sí |
Marca registrada o DCI+Titular |
|
(1) Debe estar definido y reconocido por la Autoridad Sanitaria. (2) Podría considerarse como medicamento genérico si presenta el estudio de bioequivalencia, adapta el nombre de la especialidad y formula la solicitud correspondiente a la Autoridad Sanitaria. (3) No puede ser considerado como medicamento genérico (ver “segundas marcas”). |
||||||
Cuando se menciona a los medicamentos denominados “Copias” o productos “Similares” a otros ya autorizados, se hace referencia a los medicamentos que pretenden ser iguales al producto original. Con sólo “copiar la fórmula”, de alguna manera, estos productos se han beneficiado de la investigación realizada por la compañía innovadora. En esta categoría se pueden, por lo tanto, agrupar todas aquellas especialidades que salen al mercado después del innovador, conteniendo el mismo principio activo, pero sin consentimiento de éste.
Es necesario tener presente que no se puede agrupar como genéricos a todo el mercado de “copias”, ni se puede restringir el conjunto de genéricos a las especialidades denominadas por el principio activo seguido del nombre del titular o fabricante.
Los medicamentos denominados Licencias o “Segundas Marcas” son los mismos productos que el medicamento innovador, comercializados por otras compañías farmacéuticas con autorización expresa del investigador. Se podría hablar de un “medicamento clónico” del original. 2
¿Cómo surgen los medicamentos genéricos?
Los medicamentos genéricos surgen como una alternativa terapéutica de igual calidad y más barata que los productos innovadores.
Un medicamento innovador u original es aquel que contiene un principio activo nuevo, con el que se ha realizado un proceso de investigación y desarrollo completo, desde su síntesis química hasta su utilización clínica. El laboratorio productor, propietario de los derechos, lo comercializa bajo un nombre de marca registrada.
Una vez caducados los derechos de patente, los principios activos incluidos en los medicamentos innovadores, pueden ser comercializados libremente por diferentes laboratorios. A partir de ese momento, un medicamento que ha demostrado su seguridad y eficacia por el uso continuado, puede ser considerado por la Autoridad Sanitaria competente para ser reconocido como medicamento genérico.2, 4
¿Por qué son más baratos los medicamentos genéricos?
La razón que permite explicar que un medicamento genérico se pueda comercializar con todas las garantías, a un precio sensiblemente inferior al original de referencia, es la diferencia que existe entre el precio de un producto original o innovador (que soporta los gastos de investigación y desarrollo) y el precio de los medicamentos una vez caducados los derechos de patente, ya que al ser comercializados libremente se posibilita la competencia entre los laboratorios quedando sujeto a las leyes de mercado. 1
En la “Estrategia revisada en materia de medicamentos” de la Organización Mundial de la Salud (OMS) se menciona que: “Los medicamentos genéricos pueden resultar de un 50% a un 90% más baratos que los fármacos de marca equivalentes. Sin embargo, los países en los que se ha desarrollado un gran mercado para esos medicamentos son relativamente pocos”. 5
¿Qué ocurre a nivel mundial con los medicamentos genéricos?
La distribución del mercado mundial de medicamentos genéricos es muy desigual, tal como se aprecia en la siguiente figura: Estados Unidos, Japón y Alemania representan más del 80 %.
Figura: Distribución mundial del mercado de genéricos en 1997. Fuente: Scrip’s Complete Guide to the World Generic Drugs Market, 1999
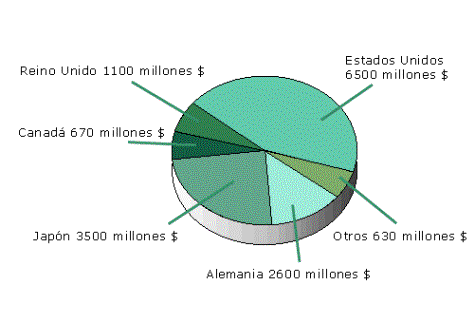
Según datos del año 1997, a escala mundial, el mercado de los medicamentos genéricos representa el 5 % del mercado total. 3 Con la aparición de los medicamentos genéricos, surge la discusión en relación con las inversiones destinadas a las actividades de investigación y desarrollo de nuevos medicamentos, dado que se temía que las mismas disminuyeran. Sin embargo, en EE.UU. el mercado de genéricos aumentó desde el 18% en el año 1984 hasta el 44% en el año 1997, mientras que las inversiones en investigación y desarrollo farmacéutico se han multiplicado por diez entre 1980 y 1998.4
Además en este país el Centro para la Evaluación e Investigación de Fármacos (CDER por sus siglas en inglés) es el organismo encargado de garantizar que los medicamentos genéricos sean seguros, eficaces y bioequivalentes con el producto de referencia; y de asegurar que estén al alcance de la población de los Estados Unidos. Esta labor está a cargo de la Oficina de Fármacos Genéricos del CDER (Office of Generic Drugs o OGD).6
Para obtener más información se puede acceder a la página web de la Oficina de Fármacos Genéricos en www.fda.gov/cder/ogd/index.htm.
En España, la Ley del Medicamento del 30 de Diciembre de 1996, le brinda un marco legal a las Especialidades Farmacéuticas Genéricas, estableciendo los siguientes requisitos:
A partir del Real Decreto 1035/1999 que regula el sistema de precios de referencia en la financiación de medicamentos, se calcula que el mercado global de medicamentos genéricos podría pasar del 11% al 20-25% en los 5-10 años siguientes.4
¿Cuál es la posición de la OMS?
En el marco del programa de medicamentos esenciales, la OMS ha elaborado una estrategia para mejorar el acceso a los mismos que consta de cuatro componentes fundamentales:
“Entre los esfuerzos desplegados para lograr que los precios sean asequibles cabe mencionar la promoción de los medicamentos genéricos y del concepto de fijación de precios equitativos, la mayor difusión de información sobre los precios de los medicamentos y la elaboración de métodos para realizar encuestas sobre los precios de los medicamentos”.
La OMS en la “Guía Internacional de Indicadores de Precios de Medicamentos” presenta precios e información de referencia seleccionada sobre medicamentos esenciales correspondientes a casi 300 principios activos en más de 500 formas farmacéuticas. 5
“Como resultado de investigaciones patrocinadas por la OMS se han determinado cuatro factores clave para desarrollar mercados nacionales de medicamentos genéricos, a saber:
¿Hay medicamentos genéricos en la Argentina?
Según la definición de medicamentos genéricos en donde se menciona que: “Los medicamentos genéricos son aquellos que están definidos por la Autoridad Sanitaria, con las normas técnicas que el producto debe satisfacer para asegurar calidad, seguridad y eficacia”, se desprende que en Argentina “no existen medicamentos genéricos”.
En Argentina no se han definido aún las normas técnicas necesarias para la elaboración de medicamentos genéricos. Es decir que, legalmente no se dispone de medicamentos genéricos en nuestro país. En la actualidad se están debatiendo, en la Cámara de Diputados, tres proyectos de ley de medicamentos genéricos.
En el Artículo 2º del Decreto Nacional Nº 150/92 (Capítulo II: Registro de Medicamentos Autorizados) se menciona que todos los medicamentos requieren la autorización previa de la Autoridad Sanitaria nacional para ser comercializados. Este proceso de autorización implica una evaluación técnica y administrativa del producto y se realiza mediante un procedimiento cuyo fin es garantizar que se cumplan las exigencias establecidas por la ley, es decir, que se cumplan las garantías de CALIDAD, SEGURIDAD y EFICACIA. Para otorgar esta autorización, ningún criterio económico o de otro tipo debe ser tenido en cuenta, limitándose a la evaluación del producto en sus aspectos técnico-sanitarios.7
Todos los medicamentos autorizados por la Administración Nacional de Alimentos, Medicamentos y Tecnología Médica (ANMAT), satisfacen los requerimientos de calidad, seguridad y eficacia, pero técnicamente ninguna especialidad medicinal puede ser considerada como medicamento genérico. Esta Autoridad Sanitaria ha confeccionado un listado de medicamentos por “nombre genérico” de los productos autorizados para su comercialización en el país.8
¿Qué contempla la legislación vigente en Argentina?
En el Decreto Nacional Nº 150/92 (Artículo 1º) se definen los siguientes términos: medicamento, principio activo o droga farmacéutica, nombre genérico y especialidad medicinal o farmacéutica. En estas definiciones no se incluye al medicamento genérico.
|
Decreto Nacional Nº. 150/92, “Capítulo I: Ámbito de Aplicación”, Artículo 1º |
|
|
Términos |
Definición |
|
Medicamento |
Toda preparación o producto farmacéutico empleado para la prevención, diagnóstico y/o tratamiento de una enfermedad o estado patológico, o para modificar sistemas fisiológicos en beneficio de la persona a quien se le administra. |
|
Principio Activo o Droga Farmacéutica |
Toda sustancia química o mezcla de sustancias relacionadas, de origen natural o sintético, que poseyendo un efecto farmacológico específico, se emplee en medicina humana. |
|
Nombre Genérico |
Denominación de un principio activo o droga farmacéutica o, cuando corresponda, de una asociación o combinación de principios activos a dosis fijas, adoptada por la Autoridad Sanitaria nacional o, en su defecto, la Denominación Común Internacional, de un principio activo recomendada por la Organización Mundial de la Salud. |
|
Especialidad Medicinal o Farmacéutica |
Todo medicamento, designado por un nombre convencional, sea o no una marca de fábrica o comercial, o por el nombre genérico que corresponda a su composición y contenido, preparado y envasado uniformemente para su distribución y expendio, de composición cuantitativa definida declarada y verificable, de forma farmacéutica estable y de acción terapéutica comprobable. |
En el Artículo 10º (Capítulo IV: Prescripción y Expendio de Medicamentos) se declara “obligatorio el uso de los nombres genéricos en los textos normativos, rótulos, prospectos y en todo documento vinculado a las especialidades medicinales, y en las adquisiciones realizadas por o para la Administración Pública Nacional”.
“Los profesionales autorizados a prescribir medicamentos, podrán optar libremente por hacerlo por el nombre genérico o la marca comercial del producto”. 7
En el Artículo 11º (Capítulo IV), se menciona que “los centros de expendio de medicamentos (farmacias) deberán ofrecer al público las especialidades medicinales que correspondan a cada nombre genérico prescripto, según el listado indicado de medicamentos por nombre genérico, el que deberá estar a disposición del público indicando los precios de venta, en lugar visible”. 7
Entre las sustituciones farmacéuticas posibles se incluyen los medicamentos en envase hospitalario y a granel siempre que se cumpla con lo dispuesto en el siguiente artículo:
Artículo 13º (Capítulo IV – Resoluciones Reglamentarias): “se autoriza la venta de medicamentos a granel y en envase de tipo hospitalario a las farmacias que cuenten con laboratorio acreditado ante la Autoridad Sanitaria, y el fraccionamiento por parte de éstas para su expendio comercial”.7
“El farmacéutico responsable del fraccionamiento deberá tener a disposición del paciente prospectos en cantidad suficiente para el caso de serle requeridos”. Además “en el rótulo del envase entregado al usuario deberá figurar el nombre del farmacéutico responsable del fraccionamiento y otros datos que permitan la identificación del medicamento y su uso correcto”.7
En la situación actual de la Argentina ¿qué se espera de la prescripción y dispensación de medicamentos por nombre genérico?
El día 12 de marzo del corriente año, el Poder Ejecutivo Nacional firmó el Decreto Nº 486 en el que se declara la Emergencia Sanitaria Nacional, hasta el 31 de diciembre de 2002, a efectos de garantizar a la población el acceso a los bienes y servicios básicos para la conservación de la salud. Uno de los objetivos es reestablecer el suministro de medicamentos e insumos en las instituciones públicas. Dentro de este Decreto, en el Capítulo II: Del suministro de insumos y medicamentos a instituciones públicas de salud con servicios de internación, bajo el Título IV: “Monitoreo de precios e importación, listados de medicamentos e insumos, precios de referencia, prescripción por genéricos y su sustitución”. En el Artículo 10 se menciona: "Facúltase al Ministerio de Salud para establecer un mecanismo de monitoreo de precios de insumos y medicamentos y de alternativas de importación directa, frente a posibles alzas injustificadas o irrazonables que afecten el acceso de la población a los mismos de manera que puedan poner en riesgo su salud".
El mismo artículo permite al Ministerio "dictar normas complementarias tendientes a implementar:
Además, según el mismo artículo, "el Ministerio de Salud creará una Comisión Técnica destinada al análisis de la sustitución de medicamentos por profesional farmacéutico".9
Este Decreto faculta al Ministerio de Salud "para crear normas complementarias tendientes a implementar…". El “espíritu de la ley” pretende promover un sistema de prescripción y dispensación de medicamentos por nombre genérico.
En el marco del estado de emergencia sanitaria en el país, el Gobierno nacional acordó con los laboratorios nacionales y extranjeros la conformación de una canasta de medicamentos que contemple el 80 por ciento de las necesidades primarias de la población argentina, retrotrayendo los precios al mes de diciembre de 2001. La canasta de medicamentos contemplaría 50 monodrogas (el número de productos es mayor, ya que cada monodroga se utiliza para más de un medicamento). 10
¿Qué sucede en Argentina con los medicamentos similares a los genéricos?
Los medicamentos similares a los genéricos se ofrecen como alternativas terapéuticas de más bajo costo respecto de los medicamentos innovadores, sujetos a las leyes de patente.
Por esta razón, es posible disminuir los costos de los tratamientos, cuando los medicamentos se prescriben por su nombre genérico, y cuando el farmacéutico dispensa la especialidad medicinal más barata correspondiente a la prescripción.
¿Cómo es el circuito de utilización de un medicamento?
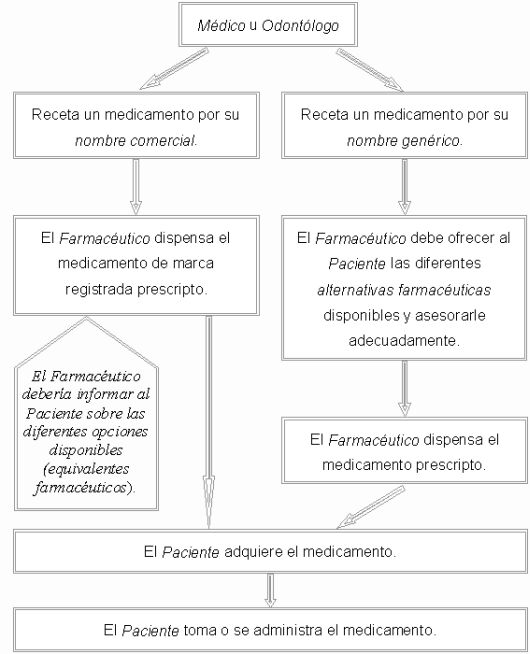
En la adquisición y en la administración del medicamento pueden intervenir otras personas en lugar del paciente (profesionales, cuidadores o familiares).
En cuanto a la comunicación con el paciente (o público en general), los profesionales sanitarios deberían ser cuidadosos en el lenguaje empleado para informar, asesorar y/o educar respecto de la utilización de medicamentos. Es conveniente:
|
Terminología |
|
|
¿Qué son los Medicamentos Esenciales? |
Los medicamentos esenciales son aquellos que satisfacen las necesidades de salud de la mayoría de la población; por lo tanto, deberían estar disponibles en todo momento en cantidades adecuadas y en apropiadas formas de dosificación.11 |
|
¿En qué consiste una sustitución genérica? |
Consiste en dispensar un medicamento genérico del producto prescripto. |
|
¿Qué son los equivalentes farmacéuticos? |
Son medicamentos que contienen idénticas cantidades del mismo principio, la misma sal o éster, en idéntica forma farmacéutica, pero no contiene necesariamente el mismo excipiente. 12 |
|
¿Qué son las alternativas farmacéuticas? |
Son medicamentos que contienen idéntica porción activa de la molécula o su precursor (complejo terapéutico) y la misma potencia, pero no necesariamente en una misma forma farmacéutica, sal o éster, y que se administran por la misma vía. 12 |
|
¿En qué consiste una sustitución farmacéutica? |
Consiste en dispensar un equivalente farmacéutico o una alternativa farmacéutica en cambio del medicamento prescripto. 12 |
|
¿Qué son las alternativas terapéuticas? |
Son medicamentos que contienen diferentes complejos terapéuticos pero que pertenecen a la misma clase farmacológica y terapéutica, y de los que se esperan efectos terapéuticos similares cuando se administran en dosis terapéuticas equivalentes. 12 |
|
¿En qué consiste una sustitución terapéutica? |
Consiste en dispensar una alternativa terapéutica en cambio del medicamento prescripto.12 |
Conclusiones
Los criterios de calidad de los medicamentos genéricos son evaluados con rigor y exigidos de la misma manera que a cualquier otra especialidad farmacéutica, y su bioequivalencia debe ser demostrada en relación con la especialidad de referencia.
En Argentina no existen medicamentos genéricos por no haber normas técnicas definidas por la ANMAT. La prescripción de medicamentos por nombre genérico, se plantea como alternativa terapéutica de bajo costo empleando especialidades farmacéuticas similares a los medicamentos genéricos.
La existencia en el mercado argentino de estas especialidades farmacéuticas similares, oportunamente autorizadas por la ANMAT, es absolutamente legítima y están garantizados los criterios de calidad, seguridad y eficacia.
Sería deseable que se legislara sobre los medicamentos genéricos de modo que se pueda asegurar además la bioequivalencia.
“La falta de acceso a medicamentos esenciales por razones económicas abre nuevas cuestiones sobre derechos humanos en un mundo que permanece dividido entre países ricos, países en desarrollo, y el resto del mundo. Además, el acceso económico a los medicamentos no implica necesariamente su correcto uso. La formación continua para profesionales de la salud, la difusión de datos farmacológicos fidedignos y la mejora de la gestión de medicamentos son pasos fundamentales para mejorar la calidad de la atención en el mundo en desarrollo”.13
Bibliografía
Díez Rodrigálvarez M. Del V. (coordinador). Genéricos. Claves para su conocimiento y comprensión. Madrid: Editores Médicos S. A. 1999.
Antonio Salgado (Director) MEDICAMENTOS GENÉRICOS: realidad y perspectivas. [en línea] España. Acceso: 12/03/02 Disponible en: www.webgenéricos.com/farmac/libro/default.asp
Poder Ejecutivo Nacional. Decreto Nº 150/92. República Argentina. (20 de enero de 1992).
Ministerio de Salud y Acción Social. Anexo I: Listado de Medicamentos Genéricos Autorizados. En la Resolución Nº 945/92 República Argentina. (30 de septiembre de 1992).
Albert I. Wertheimer, Charles E. Daniels. Editores Científicos. Organización Panamericana de la Salud. Programa Regional de Medicamentos Esenciales. “Manual para la Administración de Farmacias Hospitalarias”. Washington, D.C. EE.UU. 1989.
Médicos sin Fronteras. Acceso a medicamentos esenciales en países pobres, ¿una batalla perdida? [en línea] Acceso 25/02/02 Disponible en: www.msf.es/PDF/JAMA.doc
COMENTARIO
Frances RJ, Grin JJ, Sánchez Ordóñez R La Capital – Rosario 16-04- 02
¿Qué son los fármacos genéricos?
El Ministerio de Salud Pública proyecta implantar el uso de medicamentos genéricos en nuestro país. Dado que la población carece de conocimientos para evaluar la nueva disposición ministerial, trataremos en este artículo de brindar información básica sobre el tema.
¿Qué son los fármacos genéricos? Las compañías farmacéuticas en el mundo desarrollan fármacos a partir de investigación solventada por la propia compañía. Por ello, la empresa productora patenta un nuevo fármaco que saca al mercado y tiene el derecho exclusivo para su manufactura y distribución durante el tiempo definido por la patente. De esta forma, se retribuye a la compañía los altos costos que insume la investigación de un nuevo fármaco. Vencida la patente, otras compañías pueden manufacturar y comercializar el fármaco con otro nombre comercial o con el nombre farmacológico de la droga que lo compone. Cada nuevo fármaco recibe dos denominaciones: la del genérico, o sea la del fármaco que lo compone (ejemplo: aspirina), y la marca registrada o nombre comercial o de fantasía del producto.
¿Quién fabrica los genéricos? Los genéricos son producidos por las mismas compañías farmacéuticas que fabrican drogas o fármacos con su propia marca y viceversa, las productoras de genéricos también pueden producir fármacos con marca propia.
¿Cuál es su calidad y confiabilidad? En países desarrollados la compañía productora del fármaco y genérico debe mantener la calidad del producto porque existen controles estrictos y normas establecidas por entidades gubernamentales que fiscalizan su cumplimiento. En EE.UU. la FDA (Administración de Alimentos o Drogas) realiza la fiscalización de todos los fármacos que se venden en el país. La FDA requiere información acerca de ingredientes activos y excipientes, manufactura, equipo de producción y personal involucrado en la producción de un fármaco. Este es meticulosamente inspeccionado y obtener la información es un proceso que requiere muchas veces varios años.
Un hecho importante radica en que la compañía que quiere manufacturar el fármaco genérico no tiene que realizar nuevamente los estudios médicos hechos cuando éste fue desarrollado. Sin embargo, la manufactura del genérico debe satisfacer los mismos estrictos requisitos impuestos por la FDA para los de la marca registrada. La FDA aprueba solamente los genéricos que demuestran eficacia terapéutica equivalente a la del fármaco que lleva marca registrada.
¿Hay diferencias en la eficacia? El genérico debe tener una "eficacia terapéutica equivalente" a la del fármaco con marca registrada y debe tener idénticos componentes químicos. Los fármacos administrados por vía oral deben tener absorción digestiva, concentración sanguínea y distribución en el organismo semejante para que la eficacia sea equivalente. Los comprimidos, tabletas, etcétera, pueden ser de forma o color diferente.
¿Por qué se usan los genéricos? La principal ventaja es el precio: el genérico es de menor precio porque su costo de producción no incluye gastos de investigación original o costos de comercialización. En Estados Unidos los médicos recetan en ocasiones una marca determinada y en otras un genérico, dando alternativa al farmacéutico de ofrecer uno u otro producto o al paciente de solicitar el genérico. A veces, aunque el médico recete un determinado nombre comercial, el farmacéutico se comunica telefónicamente con el profesional prescribiente y pregunta si puede cambiar el producto por el genérico. En otros casos, las obras sociales pagan por la droga efectiva al precio más bajo, lo cual hace que el genérico sea la mejor alternativa.
El paciente debe sentirse en libertad de expresar cualquier duda que tenga tanto al médico como al farmacéutico. Debe sentirse confiado de que el fármaco genérico es en un todo semejante al de marca registrada.
Comentarios finales. Recientemente, al tratar el tema en medios de difusión, el ministro de Salud Pública de la Nación ha incurrido en errores producto quizá de la mala información. En primer lugar, ha dicho que en EE.UU. los médicos recetan sólo genéricos, lo cual vimos que es erróneo. En segundo lugar, el genérico no es el producto comercial más barato en la farmacia como fue sugerido. Si aceptáramos esto incurriríamos en un grave error que tendría como consecuencia la venta de un producto basada nada más que en su precio. En tercer lugar, los médicos no tienen en su consultorio un listado de productos con precios y eligen el más caro, como ha inducido a pensar la máxima autoridad en Salud Pública. El problema no se resuelve obligando a los médicos a recetar el fármaco y dejar que en la farmacia se decida cuál producto vender al paciente.
Finalmente, debemos recalcar que existen dos elementos indispensables para poner en marcha este sistema de utilización de genéricos: el primero, que los genéricos tengan eficacia equivalente al mismo producto con nombre comercial, lo cual se logra cuando existen compañías productoras responsables y un organismo estatal de contralor de máxima confiabilidad, como la FDA en EE.UU.; en segundo lugar, el paciente deber ser atendido por un profesional farmacéutico que es el único que tiene la capacitación necesaria para interpretar la prescripción médica.
SOBRE LA PRESCRIPCIÓN POR NOMBRE GENÉRICO
Emilio Cermignani, Presidente eccermig@isis.unlp.edu.ar, Mario Meuli, Secretario mmeuli@sinectis.com.ar Grupo Argentino para el Uso Racional de los Medicamentos
El Grupo Argentino Para el Uso Racional del Medicamento (GAPURMED), es una ONG que está abocada desde hace más de diez años a promover el uso de medicamentos que tienen eficacia y seguridad documentada (de acuerdo a la mejor información científica disponible) y que resultan adecuados para atender las necesidades de salud de la población. Estos medicamentos deben estar disponibles en todo momento, en cantidades adecuadas y en las formas farmacéuticas apropiadas.
Es por ello que hemos recibido con entusiasmo la firma del decreto número 486/02, en el cual se hace hincapié en el uso y prescripción de medicamentos por su denominación común internacional o nombre genérico. No existen dudas que recetar y dispensar de acuerdo a la denominación genérica constituye un primer paso importante para racionalizar la oferta, ordenar la demanda y mejorar la accesibilidad.
El GAPURMED reconoce el valor de estas disposiciones, teniendo en cuenta que todos sus miembros siempre han bregado por señalar a los medicamentos por su verdadero nombre, la denominación común internacional. Sin embargo, si bien este paso tomado es de vital importancia, resulta necesario señalar que todavía estamos lejos para la elaboración en el país de auténticos medicamentos genéricos (aquellos comercializados sin una autorización o una licencia de la compañía innovadora, después que ha expirado la patente u otros derechos de exclusividad). Por lo tanto, sería política, económica y socialmente conveniente estimular la fabricación de productos genéricos, ya que hasta ahora solo un sector minoritario elabora genéricos de marca o similares.
Además de facilitar una prescripción razonada, los medicamentos genéricos resultan económicamente más asequibles, como es posible observar en todos los países donde existen verdaderas políticas de salud al respecto (Estados Unidos, Inglaterra, Francia, España, Brasil).
Para una verdadera posibilidad de intercambiabilidad de productos entre el medicamento de referencia o de marca original y el verdadero genérico, este último debe poseer el mismo principio activo, excipientes y manufactura (farmacotécnia) similares, que permitan asegurar que son bioequivalentes. Sin embargo, no todos los productos genéricos requieren pruebas de biodisponibilidad y bioequivalencia in vivo (por ejemplo, los productos en solución acuosa). Por otra parte, para todos aquellos genéricos o de marca que tienen un margen terapéutico estrecho resultan indispensables los estudios de bioequivalencia.
Asimismo, debe tenerse en cuenta que todos los medicamentos registrados en nuestra Agencia Reguladora (Administración Nacional de Medicamentos, Alimentos y Tecnología -ANMAT-), tanto de marca, como genéricos (similares) y copias, cumplen con los requisitos de calidad, eficacia y seguridad, de acuerdo a los estándares de dicha agencia, garantizando así el uso de todos los productos inscriptos.
Por lo tanto consideramos sumamente importante el desarrollo de esta política de permitir a los médicos prescribir por el nombre genérico, resaltando la importancia que adquiere el farmacéutico en el acto de dispensación.
Recordemos que:
· Un nombre comercial no proporciona mayor seguridad ni brinda un mejor conocimiento científico.
· La utilización del nombre genérico en la prescripción le permite al médico identificar el principio activo y su indicación más precisa y al farmacéutico una dispensación adecuada en calidad y costo.
Se ha generado una oportunidad histórica para mejorar antiguos defectos de nuestro sistema de salud. Queda mucho por recorrer. Este es el primer paso, las transformaciones finales llegarán para la elaboración de verdaderos genéricos, con los requisitos de bioequivalencia (para aquellos que lo requieran) e intercambiabilidad acompañados por una Ley de Genéricos y una Ley de Farmacia.
¿Porqué un médico elige una determinada marca y no otra? Por las influencias comerciales a veces, por las recomendaciones de lecturas o de profesionales otras, pero rara vez está enterado de las igualdades de calidad, eficacia y seguridad de las marcas existentes.
MEDICAMENTOS GENÉRICOS. BOLETÍN DEL COLEGIO DE MÉDICOS DE LA PROVINCIA DE SANTA FE. 2a, CIRCUNSCRIPCIÓ
Dr. Hugo Oteo, Asesor en Medicamentos, Colegio de Médicos de la Provincia de SanFe2a Circunscripción, Rosario, Argentina
El momento actual de crisis en el mercado del medicamento ha llevado a un primer plano de discusión el tema del genérico. Es ineludible brindar una información objetiva sobre el mismo para evitar la paradoja de la desinformación. ¿Que es un medicamento genérico? Veamos las definiciones:
Medicamento genérico (FDA 1990): Es una versión de un medicamento que es equivalente al pionero o producto de marca y que no se comercializa hasta que la exclusividad de la droga patente ha expirado.
Medicamento genérico (Ley del Medicamento de España, del 30 de diciembre de 1996) : Especialidad farmacéutica genérica: La especialidad con la misma forma farmacéutica e igual composición cualitativa y cuantitativa en sustancias medicinales que otra especialidad de referencia cuyo perfil de eficacia y seguridad esta suficientemente establecido por su continuado uso clínico. La especialidad farmacéutica genérica debe demostrar la equivalencia con la especialidad de referencia mediante los correspondientes estudios de bioequivalencia.
Medicamento similar (Disposición ANMAT 5755/96): El que contiene el(los) mismo(s) principio(s) activo(s), la misma(s) forma(s) farmacéutica(s), la misma vía de administración, la misma indicación terapéutica, la misma posología y que es equivalente al producto de referencia, pudiendo diferir en características tales como tamaño y forma, periodo de vida útil, envase primario.
Medicamento copia: Es el que tiene igual formulación química que la molécula original pero que no ha sido probado con estudios de bioequivalencia por lo cual no puede ser categorizado como genérico (según definiciones que anteceden).
Nombre registrado o de fantasía: es el elegido por el laboratorio para identificar un producto medicinal que comercializa. No tiene ninguna relación con la denominación común internacional (DCI) o genérica de la droga que contiene su formula. Simplemente es un nombre de imaginación propuesto por el departamento de marketing o publicitario de la industria que no posibilita ninguna identificación del medicamento con su acción farmacoterapéutica.
Queda sin lugar a dudas explicitado por definición que el único medicamento original es el llamado pionero en Estados Unidos y de referencia en España y Argentina. Erróneamente a los restantes se los llama genéricos y se trata de una importante equivocación; para evitar la confusión en conceptos que deben ser precisos, se debe señalar:
Primer error: en nuestro medio solo se utiliza esta denominación “genéricos” para identificar los productos elaborados por laboratorios no lideres intentando descalificarlos. Habitualmente son comercializados en el sector publico, ya sea con el nombre de la monodroga o también con uno de fantasía y son productos que tienen escasa presencia en las farmacias privadas. Son copias. No son genéricos. Si fueran realmente genéricos con bioequivalencia demostrada serian de calidad optima no objetable, igual a los originales. Exactamente, lo contrario al intencionado mensaje peyorativo que abunda por estos días.
Segundo error: En el sector no publico del mercado de medicamentos, es decir las farmacias que dispensan recetas particulares, de obras sociales, prepagos, etc., están impuestos los medicamentos con nombres registrados de los laboratorios "conocidos y/o lideres". En su gran mayoría, también son copias, tampoco son genéricos, ya que a la fecha en nuestro país, no se exige obligatoriamente la comprobación de bioequivalencia para otorgar el certificado de autorización a la especialidad medicinal. La excepción en este grupo, corresponde a drogas originales que el inventor habitualmente por medio de co-marketing o pago de royalty cede a otros laboratorios para que las puedan comercializar con otro nombre registrado. Es la droga original vendida por distintas empresas con diversos nombres de fantasía. Cuando expira la patente del laboratorio inventor es el momento en el cual la formula pierde la protección de registro, se hace publica y "liberada" para ser producida por otros laboratorios como genérico. Aquí se utiliza el concepto inapropiadamente para referirse a medicamentos copias no amparados por patentes de invención, pero sin considerar el requerimiento técnico-científico que deben cumplimentar para demostrar igual eficacia que el original (estudios de bioequivalencia). Convengamos entonces, que se tergiversa el significado real de medicamento genérico ya que el medicamento copia es catalogado como tal incorrectamente.
Hecha esta salvedad, en merito a resguardar el rigor científico de los términos, se propone para ser prácticos adoptar esta terminología (asimilar la denominación copia con la de genérico) ya que es el lenguaje corriente en la actualidad.
Además debe señalarse expresamente que no todos los medicamentos copias necesitan revalidar su eficacia terapéutica con estudios de bioequivalencia en humanos. Numerosas drogas la aseguran, con la realización de las pruebas habituales de control de calidad in vitro (caracteres generales, disolución, ensayo de identificación, ensayo de cuantificación, etc.).
Caben algunas reflexiones: Respecto a la calidad: en este escenario (exceptuando el original), ¿quién está en condición cierta de adjudicarse ser proveedor de calidad y descalificar a la competencia sin pruebas de bioequivalencia? ¿acaso la publicidad que impone una marca y un precio más elevado son suficientes para ello, dejando de lado la comprobación científica? Un laboratorio menos conocido por operar en otro sector del mercado (por ejemplo: público) con distinto sistema de comercialización (por ejemplo: licitaciones) y con precio bajo, ¿obligatoriamente debe ser señalado como productor no confiable?
Son preconceptos cargados de subjetividad que se movilizan por necesidad de intereses comerciales y que no se corresponden necesariamente con la verdad. Respecto a la eficacia terapéutica: no debe privar la idea de que el único medicamento eficaz es la droga original, ya que esto no es cierto. El genérico con buena practica de manufactura (GMP) de acuerdo a farmacopea y correcto control de calidad es igualmente comparable en eficacia. Esto esta avalado por profusa bibliografía objetiva (FDA) y amplia experiencia de uso internacional.
En Estados Unidos el genérico ocupa un significativo porcentaje del mercado y su uso es obligatorio en los sistemas de salud publica para jubilados y el personal de fuerzas armadas (MEDICAID y MEDICARE). A nivel nacional, se debe haber comprendido por el desarrollo de este artículo que el consumo mayoritario de medicamentos de marca corresponde a los no originales, con excelentes resultados terapéuticos. En numerosas drogas prevalecen ampliamente las ventas de los productos nacionales y como comprobación se puede consultar la inserción predominante en el mercado farmacéutico de los laboratorios argentinos. Es decir son confiables y de uso corriente para nuestro médicos.
Por otro lado, desde hace muchos años los efectores públicos compran los medicamentos fabricados por los laboratorios menos conocidos que según lo ya explicado, comercializan por nombres genéricos o de fantasía. La eficacia terapéutica es la esperable, ya que la experiencia en el tiempo con millones de pacientes y de prescripciones así lo demuestran. Si fuera cierta la divulgada mala calidad de estos medicamentos, a no dudar que el sector publico no podría brindar asistencia sanitaria y estaría afectado por índices de iatrogenia por medicamentos imposibles de ignorar e incompatibles con el funcionamiento de un sistema de salud. Estas realidades de la practica medica diaria no pueden ser discutidas y contradicen mensajes alarmistas y sin fundamentos.
Respecto a la producción: corresponde mencionar una situación poco conocida en la producción de medicamentos que es la tercerización, por la cual una planta industrial elabora el mismo medicamento para distintos laboratorios, incluso para los reconocidos como líderes. Curiosamente pese a ser productos con un mismo origen de fabricación, algunos de marca reconocida serán ponderados como excelentes en confiabilidad terapéutica y otros estarán sospechados como de baja calidad. La tercerización debería estar obligatoriamente expresada en el envase y/o prospecto del producto citando la planta elaboradora. De esta forma el mercado comercial sería mas transparente para los consumidores que desconocen esta realidad (prescriptores y pacientes).
Prescripción por nombre genérico: merece una consideración especial la obligatoriedad de prescribir por nombre genérico que esta vigente en muchos países y que el Ministerio Nacional intenta en estos momentos implementar en el nuestro. Si bien este ítem esta incluido como hecho fundamental en una política de medicamentos genéricos, es distinto a lo desarrollado en este articulo, que intenta clarificar que es un medicamento genérico. Este modelo de prescripción intenta prioritariamente evitar una receta de un producto comercial con su nombre de fantasía, que tiene fijado un determinado precio. Como el medicamento es un bien que debe ser adquirido por el paciente para el cuidado de su salud, se considera esta imposición de marca y precio como una limitante de accesibilidad. Es una receta direccionada en forma inequívoca a un producto del mercado e influenciada por medidas de publicidad muy diversas, que no siempre están estrictamente relacionadas con las cualidades reales del fármaco. No ofrece alternativa de cambio al paciente para que pueda obtener la ventaja de pagar menos por un producto con igual acción terapéutica. La receta por denominación genérica invalida esta modalidad que obliga exclusivamente a un tercero: el paciente. Esta forma de prescripción es obligatoria por ley desde hace muchos años en algunas provincias. Una de ellas es Santa Fe que tiene en plena vigencia la ley 10.496 del año 1990. Como era de esperar no se ha cumplido.
RESPUESTA DEL GOBIERNO ARGENTINO A LA CRISIS: CANASTA DE MEDICAMENTOS, GENÉRICOS Y LA INDUSTRIA FARMACÉUTICA
Crearán una canasta de medicamentos La Nación 16-02-02, Acuerdo para lanzar una canasta de medicamentos Clarin 16-02-02, Un anuncio que no será gratuito Clarín 16-02-02, Acuerdo para retrotraer el precio de 50 remedios de consumo básico Página/12 – 16-02-2002, La escalada contra los laboratorios Página/12 22-02-2002
En el marco del estado de emergencia sanitaria en el país, el Gobierno nacional acordó el 15 de febrero de 2002 con las cuatro cámaras que agrupan a los laboratorios nacionales y extranjeros la conformación de una canasta de medicamentos que contemple el 80 por ciento de las necesidades primarias de la población. Estos remedios volverán a costar lo mismo que en diciembre, antes de los aumentos de precios de las últimas semanas.
En la reunión participaron el jefe de Gabinete, Jorge Capitanich, el ministro del Interior, Rodolfo Gabrielli, y los representantes de las cámaras que representan a los laboratorios. Durante la reunión, el ministro Gabrielli advirtió a los empresarios que si no cumplen con este acuerdo, se les aplicarán las sanciones que correspondan de acuerdo con las leyes de defensa de la competencia y de abastecimiento. Y remarcó que los productos que queden fuera de la canasta, no podrán volver a aumentar.
Según López Bernabó, de CILFA (Centro Industrial de Laboratorios Farmacéuticos Argentinos) "todavía no está definida la canasta. Tendrá que ver con las necesidades primarias. No podremos descartar antibióticos, y seguramente habrá drogas para enfermedades tales como diabetes, cáncer y SIDA. Los laboratorios ya habían acordado donar al Ministerio de Salud dos millones de unidades de medicamentos, por un total de 30 millones de pesos, para abastecer a los hospitales".
Clara Suárez, directora ejecutiva de Cooperala (Cooperativa de Laboratorios Argentinos de Especialidades Medicinales) agregó que la canasta de medicamentos contemplaría 50 drogas (principios activos) (el número de productos es mayor, ya que cada droga se utiliza para más de un medicamento).
El decreto que declara la emergencia sanitaria está listo para la firma el lunes (18 de febrero) y, según una fuente de del ministerio de salud, "avanza sobre los medicamentos, pero también sobre las obras sociales, el PAMI, la mala praxis". Y ataca la médula de la cuestión sanitaria, con un seguro de medicamentos "mediante el que se cubrirá, con 30 a 40 medicamentos, a 4.000.000 de personas hoy sin obra social", se anunció en el ministerio.
"El control de precios no funciona, pero la industria farmacéutica debe saber que el Gobierno se reserva esta alternativa si considera que la salud de la población está en riesgo", aseguró el ministro. El ministro Ginés González García estudia entonces la alternativa de habilitar a los farmacéuticos de todo el país a vender marcas de medicamentos optativas a las que recetan los médicos y también establecer precios de referencia.
Se preguntó a tres de los funcionarios que ayer se sentaron a la mesa de negociación por los medicamentos: ¿Cómo compensarán a los laboratorios por la confección de la canasta? Las respuestas fueron tres: "No habrá compensación"; "Lo estamos estudiando"; "Daremos de baja el proyecto de recetar por genéricos".
La divergencia no parece casual: los voceros de los ministros del Interior, el de Salud, el Jefe de Gabinete y el secretario de Defensa del Consumidor prefirieron pasar un mensaje de éxito: "quedémonos con que la gente tendrá productos más baratos, tendrá acceso a los medicamentos", dijeron.
Sin embargo, es difícil pensar que empresas que han demostrado vocación por la rentabilidad como son los laboratorios medicinales sacrifiquen ingresos sin pedir nada a cambio. Por eso, la siguiente pregunta fue hacia ellos, los privados: "¿Qué pidieron como compensación por la canasta?"
Aquí las respuestas fueron más coincidentes, y podrían resumirse en la expresión de uno de los laboratorios que domina el mercado: "Tenemos tres temas pendientes con el Gobierno. Uno es la plata que nos debe el PAMI, que ronda los 150 millones. Otro es la plata que nos deben las obras sociales y los organismos de salud estatales, como hospitales. Y el tercero es el de los genéricos, que es el más actual". ¿Y a cuál creen que le darán una solución? La contestación: “Bueno, el Gobierno no tiene plata para pagar las deudas, así que es más probable que destrabe lo de genéricos.
"Lo de genéricos" es el anuncio hecho por el ministerio de Salud de que la Emergencia Sanitaria, un decreto que está a la firma del presidente Eduardo Duhalde, incluiría la obligación para los médicos de recetar con el nombre de la droga, y no con la marca comercial del remedio. El Gobierno lanzó el decreto "de necesidad y urgencia" que autoriza a importar genéricos si sobreviene un "alza injustificada" en los precios de los medicamentos.
"Prescripción de medicamentos por su nombre genérico": esta apacible frase, en uno de los 40 artículos de un decreto al que tuvo acceso este diario, abre un nuevo capítulo en un conflicto con las empresas farmacéuticas, que se prolonga por décadas y cuyo final es incierto. El decreto abre la posibilidad (sólo la posibilidad) de un sistema que aliente la elección del paciente entre distintos fármacos con el mismo efecto, para bajar los precios. El Ministerio de Salud queda facultado también para importar medicamentos, en el marco de su conflicto con los laboratorios por "alzas injustificadas" de precios.
El decreto, que es de necesidad y urgencia y establece la "emergencia sanitaria" hasta fin de año, reconoce que "se encuentra afectado el sistema de provisión de medicamentos". Además, reconoce que el PAMI está "próximo al quebranto financiero y al colapso institucional", y autoriza a su interventor a "renegociar los contratos vigentes y fijar unilateralmente los pliegos de contrataciones". Suspende las sentencias de cobro de pesos contra el PAMI y los agentes del Seguro de Salud.
La joya del decreto es el artículo 10: "Facúltase al Ministerio de Salud para establecer un mecanismo de monitoreo de precios de insumos y medicamentos y de alternativas de importación directa, frente a posibles alzas injustificadas o irrazonables que afecten el acceso de la población a los mismos de manera que puedan poner en riesgo su salud".
El mismo artículo faculta al Ministerio "para dictar normas complementarias tendientes a implementar: listado de medicamentos e insumos a ser adquiridos; precios de referencia de insumos y medicamentos críticos; prescripción de medicamentos por su nombre genérico; sustitución de la dispensación, por parte de profesional farmacéutico, del medicamento recetado con marca registrada, por un medicamento que contenga los mismos principios activos, concentración, forma farmacéutica, cantidad de unidades por envase y menor precio".
Además, según el mismo artículo, "el Ministerio de Salud creará una Comisión Técnica destinada al análisis de la sustitución de medicamentos por profesional farmacéutico". De todos modos, el decreto no pone esto en vigencia como norma, sino que faculta al Ministerio de Salud "para crear normas complementarias tendientes a implementar…". Es decir, no es todavía una realidad sino una perspectiva.
En su parte dispositiva, el decreto declara "la Emergencia Sanitaria Nacional, hasta el 31 de diciembre de 2002, a efectos de garantizar a la población el acceso a los bienes y servicios básicos para la conservación de la salud"; uno de los objetivos es "restablecer el suministro de medicamentos e insumos en las instituciones públicas".
Enviado por Martín Cañas
¿QUÉ PASA CON LOS GENÉRICOS DE LOS LABORATORIOS PÚBLICOS ARGENTINOS?
La Capital – Rosario, 15 de febrero de 2002, La Nación, 16 y 25 de febrero de 2002, La Capital (Rosario), 18 y 19 de febrero de 2002, La Arena(La Pampa) 13 y 15 de febrero de 2002, Noticias Urbanas, 14 de febrero de 2002, Rio Negro, 17 de febrero de febrero de 2002, La Gaceta (Tucumán), 19 de febrero de 2002, La Voz del Interior (Córdoba), 16 de febrero de 2002, Clarín 15 de febrero de 2002
En estos 15 días se han difundido, como nunca, los emprendimientos municipales y estatales para la producción de medicamentos. Han sido acompañados por más proyectos provinciales para la prescripción por genéricos (Río Negro, Misiones, Santiago del Estero) y la difusión de los mismos, que se suman a los de larga data y los más recientes de enero último y al menos en dos casos han llegado a presentarse otros dos proyectos nacionales con el mismo objetivo.
En pocos casos se han publicado objeciones a las sustituciones y prescripción por genéricos en algunas provincias, y otras en donde resalta una de hace 8 días en la Nación donde, si bien se corrigen algunos términos confusos, se termina denostando en forma injustificada (desde las evidencias digo) el uso de monodrogas, que lo único que hace es generar más confusión. También un grupo de legisladores bonaerenses llevó a la Justicia los aumentos de medicamentos y piden que se investigue el "accionar oligopólico" de los laboratorios y sus presiones al Gobierno, a través del desabastecimiento.
Los laboratorios estatales producen medicamentos diez veces más baratos donde a veces la diferencia entre el precio que paga la farmacia y el costo en el Estado llega a 4.000%. La enorme diferencia entre el precio que paga una farmacia por cualquier medicamento y el costo de producción en los laboratorios que tienen la provincia y la Municipalidad deja al desnudo el gran negocio de la industria farmacéutica. "Lo que en la farmacia se vende a 10 pesos, nosotros lo producimos a un peso: lo que hace una diferencia del 90 por ciento", reveló el director del Laboratorio Productor de Fármacos Medicinales de la provincia, Luis Martina. El director del Laboratorio de Especialidades Medicinales de la Municipalidad (LEM), Antonio Longo, coincidió con su par provincial y aseguró que "nada de lo que se fabrica cuesta más del 30 por ciento del precio de droguería". El costo de fabricarlos es el 10% del precio final. Los laboratorios estatales elaboran genéricos medicinales con un costo diez veces menor al del precio de venta al público en farmacias y se ahorran 3.000.000 de dólares.
En el caso de la provincia, el laboratorio funciona desde hace trece años y provee el 70 por ciento de lo que consumen los hospitales y centros de salud de Santa Fe; mientras que el Laboratorio de Especialidades Medicinales de la Municipalidad (LEM) opera desde 1993 aportando el 30 por ciento de lo que demandan los establecimientos sanitarios que dependen de ella.
La comuna de Trenque Lauquen tiene su propio laboratorio desde hace diez años es el Laboratorio Municipal de Especialidades Medicinales que produce medicamentos hasta 30 veces más baratos y abastece a los dos hospitales del partido de comprimidos y jarabes. El intendente de Trenque Lauquen, afirmó que el ANMAT, organismo público que autoriza el uso de los medicamentos es quien genera que "en la Argentina haya 30.000 remedios diferentes y afirmó que en el laboratorio municipal de esa localidad los medicamentos se venden, en promedio, a un costo "diez veces menor" que en las farmacias.
Con una producción única de drogas para la tuberculosis y el sistema nervioso, los Talleres Protegidos (una institución gubernamental de la ciudad con capacidad para producir medicamentos) volverían a fabricarse medicamentos en los hospitales porteños. La propuesta que se discute incluye reactivar -como hace décadas- la capacidad de la red hospitalaria de la Ciudad de Buenos Aires para elaborar medicamentos e insumos básicos.
Sin embargo, la respuesta llega con demora. A principios de febrero, la Asociación de Médicos Municipales reclamó al gobierno la compra y fabricación de medicamentos genéricos, en virtud de los fuertes aumentos que los laboratorios impusieron esta semana. Se registró un incremento promedio de entre el 10 y el 50 por ciento para los insumos básicos y hospitalarios, y algunas fuentes incluso afirman que en algunos casos se remarcaron los precios por encima del 100 por ciento, llegando a un 300 por ciento en los medicamentos psiquiátricos.
La importación de insumos, el aumento del dólar y la especulación ponen en riesgo la producción de comprimidos en Río Negro. La amoxicilina y la cefalexina, dos productos básicos para la elaboración en la Productora Zonal de Medicamentos (PROZOME), sufrieron un aumento del 300%. Río Negro realizó una compra de 100 kilos de cada uno de esos productos como para asegurarse la producción por tres meses y esperar la evolución de la economía ante la expectativa de que se estabilicen los precios. Sucede que el PROZOME realiza elaboraciones por campañas y además debe producir con anticipación por el proceso de controles de calidad al que deben ser sometidos los medicamentos antes de su distribución en los hospitales rionegrinos.
Por el aumento de precios tambalea la producción de las monodrogas en la Universidad Nacional de Tucumán. Los medicamentos genéricos -cuatro veces más baratos que los tradicionales e igualmente eficaces- también sufren el aumento generalizado de precios. Los insumos para la elaboración de drogas base llegaron a los dos laboratorios locales que las preparan, con más del 400 % y hasta del 600% de incremento en los costos. El Dr. Somaini, director del Centro de Elaboración de Medicamentos de la Facultad de Bioquímica de la UNT, mostró preocupación porque el 95% de las drogas con que se trabaja viene del exterior.
En Tucumán hay dos lugares donde se elaboran en forma masiva las monodrogas: la Farmacia Oficial -desde donde se hace la distribución a los hospitales y CAPS- y el Centro de Elaboración de Medicamentos de la Facultad de Bioquímica de la UNT, que provee medicamentos a dos obras sociales. Ellas son Asunt y Asociación de Prensa, bajo la condición de que se entreguen gratuitamente (el afiliado sólo paga $1 o $2 por el envase). El laboratorio de la UNT elabora 60 drogas diferentes, a precios muy accesibles.
La venta de los remedios genéricos aumentó en un 30% en Tucumán y los médicos han comenzado a recetarlos a sus pacientes. El titular del Colegio de Farmacéuticos, Héctor René Cárdenas, afirma que, de cada diez medicamentos vendidos, tres son monodrogas. "La razón principal es la subida de precios: del 32% al 35% en productos importados y del 12% al 15% en los nacionales", afirma.
Córdoba, en sintonía con las autoridades nacionales, también elaboró un proyecto para el fraccionamiento de drogas y la fabricación de fármacos. De esta manera, lo que antes significaba el 8 por ciento del consumo de remedios en la provincia, pasaría a ocupar ahora el 60 por ciento.
A partir de la compra de "drogas madre" o principios activos, diversos laboratorios del ámbito estatal estarían en condiciones de elaborar una importante cantidad de los medicamentos de uso habitual en la provincia.
El laboratorio de la Facultad de Ciencias Exactas de la Universidad de La Plata también prevé un programa para elaborar cinco monodrogas para abastecer hospitales y centros sanitarios de la provincia. El decano de esa facultad, Guillermo Bibiloni, dijo que en 40 días comenzarían las obras de ampliación de la Unidad de Producción de Medicamentos (UPM), que funciona en un edificio del Bosque platense. También en el laboratorio Provincial se producen más de 15 fármacos.
Compilado y editado por Martín Cañas
MEDICAMENTOS GENÉRICOS
Colegio de Médicos de la Provincia de Buenos Aires Distrito II
Carta al Sr. Ministro de Salud de la Nación (Argentina)
18 de abril de 2002
Sr. Ministro de Salud de la Nación
Motiva esta nota la promulgación y puesta en vigencia del decreto 486/2002 del 13/03/02 y sus alcances.
Algunos de sus artículos ya fueron objetados por este colegio de médicos, en nota del veintiuno de marzo, dirigidas al señor Presidente de la Nación y a usted mismo.
Hicimos entonces hincapié en especial en el artículo décimo inciso "d", donde se habilita al farmacéutico a modificar la prescripción médica, ya que puede cambiar el fármaco indicado por otro "con los mismos principios activos, concentración y forma farmacéutica, minimizando el acto médico a una simple prescripción medicamentosa, vulnerando los principios éticos, y dejando virtualmente en manos de un empleado de farmacia la responsabilidad de este hecho.
También fue objetada la utilización en la Argentina de medicamentos por el nombre genérico de la droga, ya que por la experiencia recogida, su uso cotidiano ha demostrado a lo largo de los años que no siempre se produce el efecto esperado, transformando en fantasía el pretendido ahorro conseguido por su menor precio, toda vez que la complicación de una patología primaria, puede concluir con la utilización de fármacos más onerosos e incluso con la internación del paciente, con el consiguiente gasto que esto significa, situación que es bien conocido por usted. Así se entiende esta medida solo como de carácter económico, y no conducente al declamado "uso racional del medicamento" con la prescripción de genéricos.
La aplicación del genérico en países con la suficiente capacidad y recursos para su manufactura, con el posterior control y seguimiento ha sido uno de los elementos (no el único) que contribuyeron a una mejor asignación del recurso en salud, sería muy fácil aceptarlo en nuestro país si pudiéramos tener tan solo, organismos de control con medios "similares" a la FDA por mencionar uno.
Sostenemos esta afirmación conocedores de los escasos o nulos recursos con que cuenta la ANMAT, inmersa ahora en la profunda recesión de estos últimos años y la emergencia sanitaria y de país ya dictada por el gobierno nacional y algunos provinciales, haciéndola totalmente ineficaz en el control y seguimiento de la gran cantidad de productos farmacéuticos autorizados a la venta.
Pero volviendo al tema central que nos preocupa y con el fin de encontrar alguna respuesta contundente a todas las dudas planteadas, ya que seguramente podrá el Señor Ministro abundar en datos acerca de las apreciaciones vertidas en esta nota, nos permitimos en carácter de representantes de los médicos de la Provincia de Buenos Aires que se encuentran inscriptos en este Colegio de Médicos de la Provincia de Buenos Aires Distrito 11 y en salvaguarda de la salud de la población que cotidianamente y por las distintas modalidades de atención es asistida por los mismos, solicitar nos proporcione a la brevedad posible los siguientes datos.
1. Si al referirse a los "medicamentos genéricos", quiere Usted decir nombre genérico de la droga "copia" del original, o en su defecto tenga a bien informarnos cuales drogas han perdido su patente en la Argentina y que laboratorios han desarrollado el "genérico" cumpliendo las normativas internacionales sobre biodisponibilidad, bioequivalencia, farmacodinamia y farmacocinética, entre otras, vigentes para el desarrollo del producto.
2. La infraestructura propia y de apoyo con que cuenta la ANMAT, para que los profesionales y técnicos idóneos que trabajan en ella, puedan desarrollar adecuadamente las funciones que le competen.
3. Productos farmacéuticos autorizados a la venta por la ANMAT, en los últimos diez años, y algoritmo de los controles y seguimiento efectuados a los mismos en ese período.
4. Qué elementos de evaluación se pusieron en consideración para concluir como adecuada y positiva en todo su contexto, la decisión de poner en manos del profesional farmacéutico la potestad de cambiar un fármaco prescripto por el profesional médico, o si a la hora de tomar esta decisión, solo se consideró el supuesto ahorro por el precio del mismo.
5. Si evaluó las consecuencias directas de la aplicación de este decreto, sus alcances en el corto y mediano plazo, así como las responsabilidades que le atañen a sus actores, y que medidas se implementaron para que efectivamente sea el farmacéutico, y no él empleado de turno en la farmacia, el que cumpla en todo su contexto con lo expresado en el decreto, aunque esto solo garantice el expendio del nombre genérico del principio activo prescripto por el médico.
Señor ministro estamos expresando nuestro sentimiento con total honestidad y conocimiento de la situación, no se soluciona el complicado problema de la salud en la Argentina con medidas populistas, pretendiendo cuidar el bolsillo de las personas, cuando en realidad están vacíos por la falta trabajo, de educación y salud, tan vacíos como de esperanza por recuperar su dignidad.
Tampoco se soluciona encontrando al médico como culpable de las innumerables y fallidas políticas de salud implementadas en nuestro país por los gobiernos de turno, teñidas de imprevisión, corrupción y prebendas que dilapidaron el recurso en salud, no es serio, no lo podemos admitir. Con esta forma de actuar, olvidando principios éticos y morales hemos llegado al actual estado de situación, con el total descreimiento de las personas y las instituciones, haciendo cada día más complicada la convivencia entre los argentinos.
Sin duda hay buenos políticos, jueces, religiosos, empresarios, profesionales, comerciantes, trabajadores, ciudadanos comunes, y también los hay de los otros, el generalizar es una actitud irracional, débil y poco sostenible.
Esperamos que su respuesta sea lo suficientemente esclarecedora, para poder entender lo que para nosotros esta claro, en salud, toda medida que se pretenda tomar en salvaguarda de los intereses de la población debe contar con el compromiso político ineludible, el recurso económico imprescindible y el suficiente respaldo técnico y de infraestructura como para hacerlo viable y efectivo en el tiempo.
Consejo Directivo
Referencias:
Food and Drug Administration Home Page
ISO 9001 Compliance ISO 9000 & CE Marking software
New and Generic Drug Approvals
Página de acceso a la ANMAT
FAO Food and Agriculture Organization of the United Nations
La OPS en Argentina
World Health Organization
Consulta a la Base de Datos de Normativas Alimentarias – BIREME
Pan American Health Organization – Homepage
Universidad de Buenos Aires
Facultad de Farmacia y Bioquímica
ANMAT – Retiro de Productos del Mercado
JORNADA SOBRE MEDICAMENTOS
Colegio de Médicos de la Provincia de Buenos Aires, Distrito II y Fundación Óscar Eduardo Allende,
18 de abril de 2002
Consolidado general de propuestas:
1. Creación de un Vademécum con carácter ético, universal, confiable y accesible que contenga las monodrogas de reconocida utilidad y los genéricos que oportunamente desarrolle la Industria Farmacéutica Argentina cumpliendo con las normas internacionales.
2. Protocolización de las patologías prevalentes y más frecuentes por parte del Colegio de Médicos con consulta, asesoramiento y apoyo de las Sociedades Científicas.
3. Difusión por parte del Colegio de Médicos a través de las entidades médicas en forma periódica de la información y actualizaciones realizadas sobre medicamentos.
4. Solicitar y mantener un control de calidad y biodisponibilidad por parte del Estado Provincial y/o Nacional con participación de las entidades médicas colegiadas.
Recomendaciones:
1. Integrar el ANMAT con médicos representativos de las entidades colegiadas.
2. Posibilitad de realizar cursos sobre prescripción de medicamentos en la Escuela Superior de Educación Médica del Colegio de Médicos.
3. Habilitar en el portal del Colegio de Médicos en Internet una sección de consulta para los médicos colegiados sobre cuestiones relacionadas con los medicamentos.
4. Necesidad de la presencia de farmacéuticos en los hospitales.
5. Mancomunar fuerzas con los farmacéuticos para consensuar con los laboratorios.
6. La industria debería pagar el control de calidad con el canon.
Enviado Martín Cañas
PRESENTARON AYER EL FORMULARIO NACIONAL DE MONODROGAS
La Nación, 17 de abril de 2002
El Ministerio de Salud firmó ya las resoluciones que obligan a las obras sociales a aceptar recetas de medicamentos por su nombre genérico y les exigen costear, en lugar de un porcentaje del precio de venta al público, los precios de referencia que, en breve, serán impuestos a las drogas.
Así las cosas, gradualmente cambiarán las reglas de expendio en las farmacias: el farmacéutico recibirá la orden del médico para dispensar una monodroga, ofrecerá al paciente todas las presentaciones comerciales existentes y el consumidor -en función de sus necesidades y de la nueva cobertura de la seguridad social- elegirá cuál remedio compra.
¿Cómo funcionan los precios de referencia? El Estado establece un valor, por lo general el más bajo del mercado, para un fármaco determinado. Entonces, las obras sociales se hacen cargo de ese monto y el excedente corre por cuenta del cliente. Por ejemplo, si la ampicilina recibe un precio de referencia de 7 pesos, tal será la porción que absorba la seguridad social. Si el paciente opta por adquirir una marca que valga 7 pesos, no pagará nada; si escoge una de $ 20, deberá abonar $ 13 de su bolsillo.
Como queda expuesto, la política de medicamentos del Gobierno pretende instalar la competencia en el mercado farmacéutico para lograr abaratar los productos sin instalar un control de precios y contrarrestar así la disparada de costos registrada durante los últimos meses.
En consonancia con la expansión del sistema de prescripción por genéricos, el ministro de Salud, Ginés González García, dio ayer el respaldo oficial al Formulario Terapéutico Nacional (FTN) confeccionado por la Confederación Médica de la República Argentina (COMRA).
El listado -explicó el vicepresidente de la Comisión de Medicamentos de la COMRA, Héctor Buschiazzo- incluye 300 monodrogas y 15 combinaciones de dosis clínicas, más 194 drogas de uso restringido, suficientes para atender el 90 por ciento de las patologías prevalentes, es decir que afectan a mayor número de personas.
"El FTN resulta más amplio que el listado de fármacos del nuevo Plan Médico Obligatorio (modificado con la declaración de la emergencia sanitaria), que integra 197 monodrogas, porque abarca medicamentos oncológicos, contra el SIDA y anestésicos. Pero las obras sociales pueden tomarlo como modelo porque contiene principios con eficacia y seguridad aseguradas", agregó Buschiazzo.
Luego, González García indicó a La Nación: "Este formulario servirá como base instrumental a las obras sociales para diseñar sus vademécum. Además, orientará a los médicos a la hora de prescribir y a los farmacéuticos a la hora de dispensar".
Coincidió con estos conceptos el titular de la Comisión de Medicamentos, Jorge Coronel. "Este formulario reactualizado, que confeccionamos desde 1978, ha tomado hoy un auge mayor. Debido a la política para uso racional de medicamentos propiciada por el Gobierno, el listado puede insertarse en la práctica de los profesionales y facilitar el acceso a los remedios de la población más careciente", aclaró Coronel.
Cuestionado sobre la instalación del sistema de prescripción por monodrogas, que convivirá con la receta por marca salvo que el Senado apruebe la ley de genéricos, el ministro defendió su posición. "Hay temores inducidos por la industria farmacéutica, que son de mala fe, sobre la calidad de los medicamentos. Pero la gente debe tener en claro que van a venderse los mismos remedios que hasta ahora", dijo González García.
Además, descartó las "estrategias que plantean una controversia entre los médicos y los farmacéuticos" por la habilitación otorgada a los boticarios de sustituir una marca recetada por otra más barata. "La norma revaloriza la profesión del farmacéutico porque ya no será un simple vendedor. A los médicos, los saca de la comercialización y los lleva a su origen: los hace volver a la ciencia y refuerza su compromiso social", consideró.
Precisamente, los laboratorios expresaron ayer su rechazo a la sustitución de las recetas. "En el mercado argentino no existen medicamentos intercambiables. La obligatoriedad de prescribir genéricos vulnera la libertad del médico, toda vez que es responsable de los actos que hacen al tratamiento de los pacientes", indicaron.
GENÉRICOS EN COLOMBIA
Francisco Rossi, Red Nacional de Cooperativas de Hospitales de Colombia, Redsalud
En Colombia como en todas partes supongo, hemos celebrado como debe ser el triunfo de Sudáfrica. Pero cuando menos lo esperábamos, se nos han volteado las cosas de una manera increíble, al punto de estar viviendo hoy uno de los momentos de mayor desprestigio de los genéricos en nuestra historia, que había registrado avances notables.
Esto se debe a que a raíz de la detección de una cadena de falsificadores y adulteradores de medicamentos se ha logrado crear en el publico, y en los médicos, (quien lo creyera) la imagen que los genéricos son -casi- una forma de falsificación. Por aquello de ser copias, de no ajustarse a patentes o de manejar diferentes estándares de calidad.
Como resultado, y no estoy exagerando, se ha ordenado no comercializar productos de CIPLA (India) y de ERON (Cuba) y de manera sutil se ha insinuado que todos los productos de estos países (!!!!) no son confiables. Todo esto para explicar el texto de una declaración -comunicado de prensa- que a nombre de AIS Colombia, hemos producido el día de hoy y que pego al texto.
Es para alertar a todos, que las nuevas facetas de estas "diferencias" se van a mover en todos los terrenos posibles, como las presiones comerciales (Brasil con sus productos de exportación), la calidad o las nuevas reglamentaciones.
Acaba de aprobarse en Colombia una reglamentación que exige que sea el INVIMA quien visite cualquier laboratorio productor para darle certificado de BPM antes de otorgarle registros.
Excepción hecha de la Comunidad Europea, USA y Japón. ¿A que huele? Escuchamos propuestas, ideas o al menos voces de aliento.
COMUNICADO DE PRENSA. COMENTARIOS TÉCNICOS RELACIONADOS CON EL DEBATE DE LOS GENÉRICOS
Con respecto a las comunicaciones que vienen apareciendo en los medios de comunicación en los últimos días, consideramos que se ha generado una confusión a raíz de las actuaciones del INVIMA. Al respecto queremos ofrecer las siguientes consideraciones técnicas.
1. La denominada cadena del medicamento que comprende desde la investigación, diseño, producción, comercialización, distribución, uso y vigilancia de su impacto sobre la salud de la comunidad universal, nacional, local e individual, compromete a distintos actores cuyos roles están cada día mas definidos y en general normalizados y estandarizados y mas aun en el marco de la globalización. A pesar de los distintos intereses que puedan tener los actores todos deben cumplir el propósito fundamental de contribuir al cuidado de la salud.
2. Los investigadores tienen normas, estándares, metodologías y un código de ética para ofrecer productos eficaces y seguros.
3. Los diseñadores están comprometidos con la garantía de calidad de su producto farmacéutico y el mantenimiento de la eficacia y seguridad.
4. Los productores deben cumplir con los estándares de calidad y Buenas Prácticas de Manufactura, en proceso de implantación en nuestros países.
5. Los distribuidores cuentan con diversas pautas para el mantenimiento de la calidad entregada por los productores garantizando la idoneidad de los productos desde su origen. Este quizá sea uno de los puntos más débiles de la cadena en nuestro país.
6. Los consumidores que pueden ser categorizados en aquellos grandes compradores para ofrecerlos a sus pacientes o beneficiarios, EPS(s) e IPS(s) en nuestro sistema de seguridad en salud y los particulares que compran sus medicamentos.
7. Finalmente las entidades estatales encargadas de vigilar y controlar que todos los actores cumplan las normas, estándares, códigos de ética, practicas y pautas para garantizar que el medicamento sea eficaz, seguro y de calidad, y equitativamente accesible a la población para salvaguardar su salud, función esta considerada como esencial del estado. En Colombia estos principios se dan en la ley 100 de 1993, que creó el SGSSS, dando cobertura de los medicamentos esenciales mediante el POS, creando el Instituto de vigilancia y control de medicamentos y alimentos, INVIMA, y dando paso a la actualización de las normas para garantizar el acceso de medicamentos seguros eficaces y de calidad.
8. Dado lo anterior no se entiende la intervención del INVIMA que por un lado otorga los registros sanitarios a los productos farmacéuticos elaborados en la India y en Cuba y una vez encuentra una cadena de falsificación centrada sobre un distribuidor lo confunde con los productores y condena sus productos que han contribuido en forma significativa en la disminución de precios y de paso a aumentar el acceso a los medicamentos por parte de los colombianos.
10. Tal confusión independientemente de la opinión personal que individualmente se pueda formar, inclina la balanza hacia las grandes transnacionales productoras de medicamentos, que han dado pruebas contundentes al mundo de que sus intereses financieros están por encima de la salud, como fue el caso de la pretendida demanda contra Sudáfrica y que despertó la reacción del mundo.
11. Otra muestra de esta injusta posición se puede ver claramente al ordenar el INVIMA el congelamiento de los medicamentos adquiridos por el ISS a los productores CIPLA y Eron, de paso ordena comprar a otros laboratorios, pero no congela productos de otros laboratorios que se encontraron falsificados como el Voltaren.
12.Técnicamente, cuando existen dudas o se comprueban deficiencias de calidad de un determinado medicamento, se toman medidas sanitarias de seguridad con respecto al LOTE DE FABRICACION. Pero estas medidas mal pueden aplicarse a todo el producto y menos aun hacerse extensivas a los países de origen. Además debe resaltarse que la medida ha sido aplicada selectivamente, lo que no resulta coherente con el principio de aplicar las Leyes a todos por igual.
Múltiples actores del sistema han sido enfáticos en afirmar que las iniciativas destinadas a desacreditar los genéricos, atentan contra la salud de la población y la estabilidad del Sistema de Seguridad Social. Los genéricos no son otra cosa que aquellos productos fabricados por quien no fue el titular de su patente (con frecuencia las grandes multinacionales compran las patentes a Universidades y otros grupos de investigación) o por quien no fue el productor titular del producto original. Todo genérico debe cumplir los mismos parámetros del producto original y de ello debe dar fe el INVIMA al otorgar el registro. Es decir, que de ninguna manera pueden ser de calidad diferente.
Unido a estos hechos, se presentan otros elementos que lesionan la política de genéricos y el sistema de seguridad social: Tanto la legislación de Patentes, ya vigente en Colombia, como el debate sobre la confidencialidad y el secreto de la información técnica.
También la reciente legislación que obliga a obtener Certificado de Buenas Practicas de Manufactura para registrar medicamentos, cuando provengan de países diferentes a la Comunidad Europea, Japón y USA. Estas medidas tienen sin duda su lugar en el mercado, pero requieren de una juiciosa ponderación. Por eso invitamos a todos los comprometidos con este tema, a brindar claridad en todos los espacios posibles, para evitar que la confusión tenga consecuencias indeseables.
BRASIL: ANVISA AUTORIZA GENÉRICOS MÁS MODERNOS
La lista de medicamentos para distintos tipos de enfermedades será anunciada en los próximos días.
Brasilia – La ANVISA va a autorizar, en los próximos días, la fabricación de remedios genéricos a base de hormonas producidas en laboratorios. Los medicamentos son usados en tratamientos de osteoporosis, cáncer de próstata, hipertensión, diabetes, hipotiroidismo y terapias de reposición hormonal. Con una diferencia de precio inferior hasta en un 40% a los remedios de marcas, los nuevos genéricos saldrían a la venta a partir de junio.
"Los genéricos en base a hormonas sintéticas van a asegurar los mismos efectos de las marcas similares, a un precio mucho más accesible", afirmó Vera Valente, directora del área de Genéricos de la ANVISA. "Distintos estudios comprobaron que no hay riesgos de fabricar esos productos en la versión de genéricos".
La agencia va a autorizar la fabricación de 40 tipos de hormonas sintéticas. La sustancia alendronato de sodio, usado en la lucha contra la osteoporosis es otra de las que van a ser autorizada. Una caja del similar de marca Fosamax de 15 comprimidos x 10 mg. cuesta alrededor de R$ 52,95 (la versión genérica, R$ 31). La caja de 4 comprimidos de 70 mg. cuesta R$ 99,23 (el genérico, R$ 59,53).
Productos – En el caso de la diabetes, la ANVISA va a autorizar el genérico glimepirida. Una caja de 30 comprimidos de 1 mg. de la marca Amaryl cuesta R$ 13,98 (R$ 8,38 como genérico). También serán incluidos en la nueva lista de genéricos, remedios para reposición hormonal a base de ciproterona con estradiol. Un blister de 21 grageas fabricada por Climene cuesta R$ 14,79 y puede reducir su precio como genérico a R$ 8,87.
Considerada la "enfermedad de la mujer moderna", la endometriosis también podrá ser tratada con genéricos hechos con hormonas sintéticas. La sustancia danazol será vendida como genérico en tres versiones, de 50mg. 100mg. y 200mg., que costarán R$ 30,87, R$ 56,45 y R$ 66,81. Los precios están por debajo de los que se venden con la marca Ladogal. En Brasil, alrededor de 5 millones de mujeres en edad fértil utilizan esos remedios, según cálculos del Ministerio de Salud. Sin causa definida, la enfermedad se caracteriza por el crecimiento de las capas internas del útero.
En dos años la ANVISA ya registró 500 productos genéricos. De ellos, 305 ya están a la venta. Otros 293 pedidos de registros fueron protocolizados por laboratorios nacionales y extranjeros. La agencia estima que un 53% de las principales enfermedades del país están cubiertas por los genéricos. Las industrias del sector invirtieron más de R$ 300 millones en la producción de genéricos, que responde por el 6% del mercado de productos farmacéuticos. Antes de fines del 2003 se espera que ese porcentaje se eleve hasta llegar al 30%.
Enviado Martín Cañas
Extractado de: O ESTADO DE S PAULO (Brasil), 18-01-02
Quito. Ampliar el mercado y los clientes de los medicamentos genéricos es tarea que deberá enfrentar el Ministerio de Salud en el 2002. La estrategia para convencer a la población de que estos fármacos son de calidad pasa por una campaña informativa para combatir, en algunos casos, los mitos, y en otros, el desconocimiento sobre estos productos farmacéuticos.
La homologación de registros sanitarios hasta el control de calidad de los productos son parte del plan para este nuevo año. La comercialización de genéricos en el país podría alcanzar flujos de dinero por alrededor de 100 millones de dólares anuales.
La inversión de 3,3 millones de dólares permitió financiar, durante el segundo semestre del año, la importación de 53 medicamentos adquiridos a través de la Organización Panamericana de la Salud (OPS). Cuatro productos adicionales por intermedio de la Unicef también se incluyeron en esa lista. Es decir, un total de 57 productos de los 92 que tiene como meta el Ministerio de Salud para ingresar a las farmacias hospitalarias públicas.
La asignación, vía presupuesto del Estado, al Programa de Medicamentos Genéricos será de 10 millones de dólares en el 2002. De esta manera se triplicaría la inversión egresada en este año.
"Más dinero, pero también más difusión y control", explicó Francisco Carrasco, director general de Salud. Hasta el 15 de enero próximo, la Unidad tendrá la lista de los nuevos productos que serán importados de acuerdo a los perfiles epidemiológicos de cada centro médico, perteneciente a la red de hospitales.
El control de calidad entrará en una segunda fase que se llamará "post registro de medicamentos". Esta labor, ya no estará a cargo de una entidad neutral como los laboratorios de la Universidad Central, sino que el responsable será el Instituto Nacional de Higiene Izquieta Pérez, dependiente del Ministerio de Salud.
La difusión será la segunda estrategia para incentivar el mercado. Desde enero, el Ministerio de Salud abrirá espacios informativos, sobre todo en las radios, para explicar las "bondades" de los genéricos, frente a los productos de marca que tienen precios, en muchos casos dos y hasta tres veces superiores al primero.
La ley sobre genéricos fue publicada en el Registro Oficial 59, de mayo del 2001. El artículo 15 dispone la creación de registros de las farmacias que expenden genéricos.
Sobre la fabricación: El artículo 16 de la Ley de Medicamentos Genéricos autoriza la inspección de los laboratorios de las empresas fabricantes para garantizar que el 20 por ciento de su producción corresponda a los medicamentos genéricos.
Enviado Martín Cañas
Extractado de: EL COMERCIO (Ecuador), 31-12-01
VENEZUELA: LA INDUSTRIA CUESTIONA DEFINICIÓN DE GENÉRICOS
El Tribunal Supremo de Justicia se declaró a favor, por mero derecho, de un recurso de nulidad que, el 28 de abril de 1998, introdujo un grupo de laboratorios venezolanos sobre una confusa definición de medicamentos genéricos plasmada en el decreto gubernamental número 2.433, del 25 de febrero de 1998.
La cuestionada definición restringía la clasificación de genéricos sólo a los medicamentos cuya patente de invención ha caducado, lo cual es imposible en Venezuela, donde la Ley de Propiedad Industrial, vigente desde 1956, prohíbe la patente de medicamentos.
El TSJ admite que no es necesaria la apertura de pruebas pues no hay hechos que probar y decidió publicar carteles, otorgando 15 días hábiles para la comparecencia de los interesados en el juicio.
Enviado Martín Cañas
Extractado de: EL UNIVERSAL (Venezuela), 10-01-02
VENEZUELA: BOLSILLOS ALIVIADOS POR GENÉRICOS
El alendronato es un medicamento que se ingiere para atacar la osteoporosis, enfermedad de los huesos que sufre la mayoría de las mujeres mayores de 50 años. La droga se vende en casi todas las farmacias del país a un costo de 29.843 bolívares por su nombre comercial y a 7.200 bolívares en su presentación genérica. La diferencia de precios es de 76%.
Este es apenas un caso representativo de un inmenso grupo de fármacos que se venden en el país para tratar enfermedades crónicas que tienen versiones genéricas y su compra proporciona salud y un significativo ahorro de hasta 80%.
‘No se trata de quitarle espacio a los laboratorios comerciales, pero para un país que no tiene un buen sistema de salud y en el que la mayoría de las personas tienen bajos ingresos económicos, lo más lógico es que se le dé prioridad a los medicamentos genéricos’, dice Jorge Rivas, presidente de la Cámara Nacional de Medicamentos Genéricos y Afines. Rivas comenta que en Venezuela los genéricos ocupan 15% del mercado farmacéutico, mientras que en Estados Unidos superan el 45% y en Chile llegan a 50%.
‘La misma Ley de Medicamentos reza en su artículo 8 que los organismos del sector público deben adquirir medicamentos en su denominación genérica salvo que no existan en el mercado. Los enfermos crónicos, que dependen de un tratamiento médico para poder sobrevivir, deberían ser los más informados acerca de las alternativas en terapias genéricas, ‘pero esto no ocurre con la frecuencia deseada’.
La amlopidina, por ejemplo, es un antihipertensivo que en su forma genérica se consigue en 1.600 bolívares y la marca comercial lo ofrece en 9.370 bolívares. El porcentaje de diferencia es de 83%.
Ivonne de Herrera, dueña de la farmacia Nuevo Mundo de San Martín, tiene a la disposición la caja de 20 tabletas del antihipertensivo captopril genérico en 2.310 bolívares ‘que trae de regalo 20 tabletas más’, mientras que la marca comercial líder, con 20 tabletas, tiene un costo de 9.020 bolívares. ‘Este medicamento se lo tienen que tomar, generalmente, dos veces al día’, dice Herrera, por lo que se deduce que una persona que ingiriera la droga en su versión comercial hará un gasto mensual de 27.060 bolívares, pero si consume el genérico esta cantidad se reduce a menos de dos mil.
‘Lo que pasa es que la mayoría de los médicos no les gusta recetar los medicamentos genéricos y en las redes de farmacias ofrecen sólo los comerciales’, agrega la farmaceuta.
‘No hay diferencia en cuanto a la calidad del producto. Los genéricos y los comerciales son exactamente iguales en este aspecto’, asegura Otto González, representante de Laboratorios OFA (Organización Farmacéutica Americana).
La Ley de Propiedad Industrial, vigente desde 1956, prohíbe la patente de medicamentos, por lo que no es necesario esperar 20 años hasta que caduque la licencia del invento para disponer de la receta de fabricación.
La Cámara Nacional de Medicamentos Genéricos debió dirigirse directamente al presidente Hugo Chávez para informarle que la entrega de registros sanitarios para productos farmacéuticos por parte del Instituto Nacional de Higiene se paralizaba en reiteradas oportunidades atrasando la entrega de los certificados hasta por tres años.
‘El Presidente se mostró asombrado cuando le informamos que entre estos medicamentos represados habían drogas para tratar las enfermedades del corazón, antihipertensivos y reductores de colesterol entre otros fármacos importantes para reducir el índice nacional de muertes anuales’.
Ejemplos
Diclofenac sódico. La versión genérica de este antirreumático _antiinflamatorio tiene un precio de Bs. 3.780, y la comercial se consigue en Bs. 9.100.
Lansoprazol. Es un medicamento que actúa contra las úlceras y cuesta Bs.12.600 bolívares sin marca y Bs. 20.495 en presentación comercial.
Simvastatina. Reductor de colesterol. Se consigue en empaque genérico a un costo de Bs. 9.390 y con marca a 18.835.
Bromazepan. Antidepresivo que se ofrece a Bs. 2.600 en versión genérica y a 3.200 en presentación comercial.
Extractado de: EL UNIVERSAL (Venezuela), 22-01-02