Los anuncios de productos farmacéuticos en EE UU son molestos. Absurdos. Y casi exclusivamente estadounidenses.
De hecho, en el mundo, solo hay otro país de ingresos altos, Nueva Zelanda, que permite que las empresas de medicamentos de venta con receta anuncien directamente a los consumidores. Todos los demás han decidido que no vale la pena lidiar con los inconvenientes. Entonces, ¿por qué EE UU no los ha prohibido?
Desde un principio, Robert Francis Kennedy Jr. ha declarado que uno de sus objetivos es eliminar los anuncios farmacéuticos. Y, lo crea o no, estoy de acuerdo con él en esto. (¡Qué sorpresa!). Pero, ¿puede realmente la administración tomar medidas al respecto? Ellos creen que sí. Ayer, en un nuevo memorándum ejecutivo y en el correspondiente comunicado de prensa de la FDA, se afirmó que se iba a intensificar la aplicación de la ley contra los anuncios de medicamentos [1, 2].
Pero en la década de 1980, la FDA decidió que eso no era del todo cierto. La agencia concluyó que los anuncios de medicamentos eran legales siempre que incluyeran un “breve resumen” de la etiqueta del medicamento que la misma agencia hubiera aprobado. Fue entonces cuando los anuncios en lustrosas revistas tomaron vuelo: grandes fotos llamativas en una página, y en la siguiente, un resumen de los riesgos escritos con letra pequeña.
En 1997, la FDA hizo otro cambio importante: en la tele y la radio, los fabricantes de medicamentos ya no tenían que poner todo el resumen. En vez de eso, podían incluir una “declaración importante” sobre los riesgos clave del medicamento. Ahí fue cuando empezó la era moderna de los anuncios de medicamentos.
Pero los anuncios sí determinan qué medicamentos piden los pacientes, y estos suelen ser los más caros.
Los fabricantes de genéricos rara vez hacen publicidad porque se enfrentan a lo que los economistas denominan el problema del “aprovechado”. Varias empresas fabrican la misma pastilla genérica. Si le pide a su médico que le recete un genérico, su farmacia le dará la versión que tenga disponible, no una marca específica. Eso significa que un anuncio de una empresa de genéricos también podría favorecer las ventas de sus competidores. ¿Para qué molestarse?
Como resultado, casi todos los anuncios de medicamentos son de costosos medicamentos de marca. Esto significa que los pacientes que reaccionan a los anuncios a menudo terminan pagando por estos medicamentos caros, incluso cuando existe una versión genérica más barata e igual de efectiva, o incluso un tratamiento sin medicamentos.
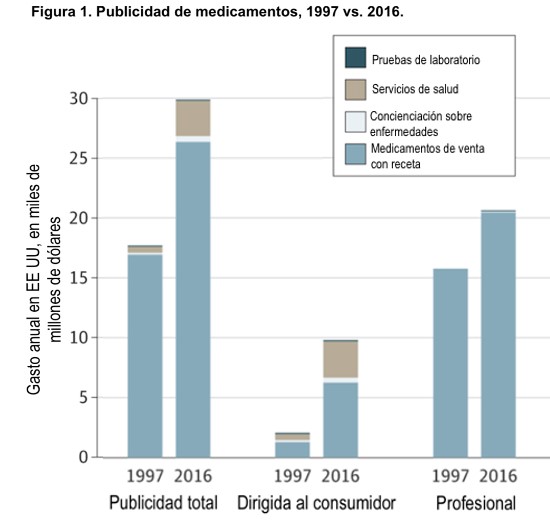
Sí, especialmente los que están dirigidos a pacientes (o consumidores), en comparación con los dirigidos a médicos. Un estudio reveló que, entre 1997 y 2016, el gasto en publicidad dirigida al consumidor pasó de US$2.100 millones a US$9.600 millones [4]. En la actualidad, los fabricantes de medicamentos invierten aproximadamente US$6.000 millones al año en estos anuncios, la mayor parte de los cuales se concentran en los medicamentos de marca más vendidos —que no son necesariamente los mejores—.
Otro estudio reveló que menos de un tercio de los medicamentos más comunes, que aparecen en los anuncios televisivos dirigidos al consumidor, fueron calificados como de alto valor añadido para los pacientes [6].
Además, los anuncios de medicamentos deben ofrecer un “equilibrio justo”, lo que significa que se deben presentar tanto los aspectos positivos como los negativos. En la práctica, esto suele significar que la primera mitad del anuncio muestra a gente divirtiéndose en la playa, mientras que la segunda mitad es un vertiginoso recital de advertencias.
La Oficina de Promoción de Medicamentos de Venta con Receta (OPDP o Office of Prescription Drug Promotion) de la FDA se debe asegurar de que los anuncios sean precisos, no engañosos y bastante equilibrados. Pero el problema es que las empresas no tienen que presentar los anuncios para su aprobación antes de emitirlos. Cuando la OPDP encuentra anuncios inadecuados, a menudo después de varios meses de haberse estado emitiendo.
Y lo que se considera “engañoso” no siempre es sencillo de determinar. Tomemos como ejemplo un anuncio que promociona un nuevo medicamento para dormir, que ayuda a las personas a “conciliar el sueño rápidamente” [7]. Esto suena impresionante hasta que uno se entera de que, en el ensayo que llevó a que la FDA aprobara el medicamento, los pacientes que lo tomaron se quedaron dormidos en 30 minutos, mientras que los que tomaron placebo lo hicieron en 45 minutos. No es una gran diferencia. ¿Es el anuncio técnicamente engañoso? Es difícil decirlo.
La psicología complica aún más las cosas. Los estudios demuestran que cuando los riesgos de los medicamentos se leen en voz alta mientras se reproducen imágenes relajantes de fondo, los espectadores se distraen de la información relevante [8]. El anuncio cumple con las normas, pero el impacto en los pacientes es un tema aparte.
Por un lado, los anuncios de medicamentos aumentan la prescripción de los fármacos que promocionan. Se puede imaginar un caso en el que eso sea algo positivo. Los pacientes que, de otro modo, podrían sufrir en silencio, por ejemplo, con disfunción eréctil o depresión, se podrían sentir alentados a tocar el tema con sus médicos. En teoría, los anuncios pueden empoderar a las personas para que busquen tratamiento para enfermedades estigmatizadas.
Por otro lado, los anuncios pueden inducir a la “prescripción excesiva”. Si un paciente entra en la consulta del médico y pide un medicamento por su nombre, los estudios demuestran que es más probable que lo obtenga, incluso si otro tratamiento podría haber sido más adecuado [9]. Esto ha suscitado preocupación por el hecho de que los anuncios fomenten un uso innecesario o inadecuado, especialmente en el caso de trastornos como el TDAH en adultos, la sequedad ocular o el trastorno de adaptación.
La verdad es que los anuncios de medicamentos son una mezcla de cosas buenas y malas. Pueden lograr que el paciente busque atención médica, pero lo más probable es que, en la mayoría de los casos, fomenten recetas costosas e incluso innecesarias.
La más importante es la Primera Enmienda a la Constitución. La prohibición de los anuncios de medicamentos tendría que defenderse ante los tribunales, ya que las empresas farmacéuticas presentarían inmediatamente una demanda para anular la prohibición. Sin embargo, la Corte Suprema ha interpretado que la protección de la libertad de expresión de la Primera Enmienda se extiende a las entidades comerciales, aunque las empresas no sean personas. Lamentablemente, es difícil imaginar un cambio en la perspectiva actual de los tribunales sobre el discurso comercial, sin una enmienda constitucional que aclare que las empresas no son personas y no merecen la misma protección en materia de libertad de expresión.
Entonces, si no se van a prohibir —y a falta de un acuerdo voluntario de las empresas farmacéuticas para dejar de hacer publicidad—, el gobierno podría intentar regular más estrictamente los anuncios de medicamentos. Por ejemplo, la FDA podría crear reglas sobre su contenido o dónde y cuándo se pueden mostrar. Los anuncios en línea, en particular, pueden tener características que se prestan a interpretaciones erróneas, por ejemplo, la forma en que se muestra la información sobre los riesgos o cómo los elementos de diseño que distraen la atención (como los vídeos de reproducción automática o las ventanas emergentes) pueden afectar la comprensión. La FDA podría intentar identificar esas situaciones y establecer normas para abordarlas. El Congreso también podría proporcionar más recursos y autoridad a la FDA para que detecte rápidamente los anuncios problemáticos y los retire de su difusión.
En una palabra: cabildeo.
La industria farmacéutica cuenta con el sistema de cabildeo más poderoso y con más recursos de Washington D.C. Históricamente, se ha opuesto a cualquier iniciativa que restringiera la capacidad de los fabricantes para hacer publicidad a gran escala porque, como se ha señalado anteriormente, los anuncios de medicamentos ayudan a que los fabricantes de marcas ganen dinero. A lo largo de los años, la industria ha proporcionado fondos sustanciales a muchos legisladores y ha ayudado a elegir a presidentes que han definido la agenda y la financiación de la FDA.
Los pasos clave que se incluyen en la directiva son:
Es probable que el impacto de estas medidas sea limitado. Las cartas de advertencia casi siempre solo logran que la empresa retire o modifique el anuncio sin que se le impongan multas ni sanciones adicionales —a menudo meses después de que el anuncio ya se haya difundido ampliamente—. Con los recientes recortes de personal y presupuesto en la FDA, también será difícil mantener una supervisión constante y rigurosa de las redes sociales. La directiva ni siquiera intenta proporcionar detalles sobre la denominada supervisión ampliada, como por ejemplo las guías esenciales sobre lo que se debe y no se debe permitir en la publicidad de medicamentos en las redes sociales. Estos detalles han hecho falta durante muchos años (y todavía hacen falta).
Conclusión
Los anuncios de fármacos son una forma limitada e intrínsecamente problemática de informar a la gente sobre los medicamentos de venta con receta. Tenemos que hacer un trabajo mucho más eficiente para empoderar a los pacientes para que obtengan la atención médica que necesitan y para educarlos sobre los verdaderos beneficios y riesgos de los medicamentos de venta con receta de manera imparcial.
La posibilidad de que esto cambie alguna vez dependerá no solo de una administración, sino de cómo decidamos, como país, equilibrar el poder corporativo, el discurso comercial y la salud de nuestros ciudadanos.
Referencias