ECONOMÍA Y ACCESO
Acceso
Cada día hay más solicitudes para la aprobación de medicamentos para enfermedades raras
Salud y Fármacos
Según la revista Nature Medicine [1] cada día las agencias reguladores, tanto la estadounidense como la de la Unión Europea, reciben más solicitudes para aprobar la comercialización de medicamentos para enfermedades raras [2]. La razón es que estas enfermedades se van reclasificando en subgrupos. El ejemplo que ofrece Nature es el caso del linfoma, que se ha subdividido en docenas de clases de cáncer dependiendo de la célula inmune afectada.
Como la célula de cáncer, la definición de linfoma se ha dividido. Casi 700.000 personas en EE UU tienen esta enfermedad, pero en las últimas décadas, el linfoma se ha divido en varias docenas de subgrupos según el tipo de célula inmune que llega a ser cancerígena. Las farmacéuticas se han enfocado en estos subtipos y han pedido que se consideren enfermedades raras [2].
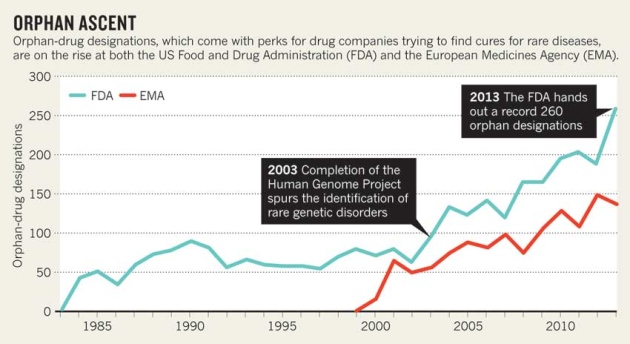
Nature indica que en 2013, la FDA concedió la designación de enfermedad rara a por lo menos 21 tratamientos de linfomas específicos. Y en total, hubo un record de solicitudes para recibir la designación de enfermedades raras que fueron aceptadas: 260, lo que representa un incremento de 38% con relación a 2012. Una tercera parte de los medicamentos aprobado en 2013 fueron para enfermedades raras.
Para la FDA esto crea un problema, porque la legislación estadounidense de enfermedades raras libera a las farmacéuticas de pagar la tasa de US$2,17 millones que tienen que pagar por los otros medicamentos nuevos a la FDA. A parte de esto, cuando se trata de medicamentos para enfermedades raras, los gastos de los ensayos clínicos se pueden desgravar de los impuestos que las empresas pagan al gobierno.
Y como se ha reducido el número de solicitudes que se procesan por la vía normal, los recursos económicos de la FDA, que ya son insuficientes, se van reduciendo aún más.
En 1999, la EMA creó un programa para enfermedades raras que también ofrece privilegios, entre ellos diez años de exclusividad en el mercado, y como en EE UU, las peticiones de clasificación de enfermedades raras van en aumento.
Ya existen docenas de tratamientos para la diabetes. Las farmacéuticas innovadoras están descubriendo que el mercado de los medicamentos para enfermedades raras es mayor de lo se pensaba. Pfizer está desarrollando un medicamento para depranocitosis, que aunque rara en EE UU (afecta a menos de 100.000) es muy común en África, y por ello Pfizer piensa que será un medicamento que genere un buen beneficio.
|
Pero la posibilidad de buenos márgenes también existe aunque los enfermos sean pocos. Nature pone el ejemplo de Kalydeco (ivacaftor) un medicamento para una mutación genética que causa fibrosis cística que afecta a unas 30.000 personas en EE UU. Y aunque el medicamento es efectivo solamente para un 4% de los enfermos de fibrosis cística, Vertex, la farmacéutica productora del medicamento tiene previsto obtener buenos beneficios ya que el precio de tratamiento/año es US$373.000.
Algunos críticos, continúa Nature Medicine, han manifestado su preocupación por la posibilidad de que para obtener la clasificación de enfermedad rara las empresas fraccionen artificialmente las enfermedades. Para evitarlo, la FDA en 2013 aprobó una regulación que exige que para obtener la designación de enfermedad rara es necesario presentar evidencia científica plausible de la singularidad de la enfermedad. Pero los avances científicos pueden ofrecer oportunidades para encontrar singularidades, por ejemplo los genetistas han conectado mínimas mutaciones a síndromes raros.
Además la definición de enfermedad rara de la FDA incluye medicinas que tratan un subgrupo de pacientes de un desorden común, por ejemplo aquellas personas depresivas para las que un tratamiento existente no ha tenido éxito. Incluso una infección bacterial con resistencia a cierto tipo de antibiótico podría llegar a ser designada rara.
Referencias y Notas