Agencias Reguladoras y Políticas
Agencias Reguladoras
EE UU y Canadá
En 2014 la unidad de la FDA de controlar los anuncios de medicamentos solo envió diez cartas (FDA’s marketing police wrote only 10 tickets in 2014)
Tracy Staton
FiecePharma, 6 de enero de 2015
http://www.fiercepharmamarketing.com/story/fdas-marketing-police-wrote-only-10-tickets-2014/2015-01-06Traducido y resumido por Salud y Fármacos
Cuando se trata de conseguir que la industria farmacéutica cumpla la regulación, la Oficina de Prescription Drug Promotion (OPDP Promoción de los Medicamentos de Venta con Receta) es como la policía que pone multas a los coches mal aparcados. Las cartas de la OPDP no son tan amenazantes como las cartas de aviso que envían otros reguladores de la FDA y que pueden llegar a cerrar una fábrica o un lugar en donde se hacen ensayos clínicos [1]. Y tampoco tienen el poder de las citaciones judiciales del Departamento Federal de Justicia.
A pesar de ello, nadie quiere recibir una carta de la OPDP por una violación de la regulación. Pueden ser costosas; sino que se lo pregunten a Bayer, que tuvo que hacer varios anuncios para corregir la información que había diseminado anteriormente sobre los beneficios del medicamento Yaz [2]. Pero para otros, las misivas de la OPDP son como telegramas. O como mensajes codificados que hay que leer entre líneas, escritos con tinta invisible, ya que primero tienen que ser descifrados y luego tienen que leerse al trasluz por si hay algún mensaje oculto a nivel subtextual.
Hay gente que se gana la vida haciendo ese tipo de análisis de la FDA. Para ellos, y para los que seguimos la política de la FDA sobre temas de marketing de medicamentos, en 2014 la FDA no ha ofrecido casi nada de interés. En realidad, la OPDP solo realizó 10 notificaciones, la mitad de las que hizo en 2007, que fue el año con menos notificaciones, y ni siquiera la décima parte de las que enviaba a finales de los 1990s. En 1998, por ejemplo, la oficina anterior a la OPDP, –the Division of Drug Marketing and Advertising Communications, or DDMAC – envió 156 notas disciplinarias.
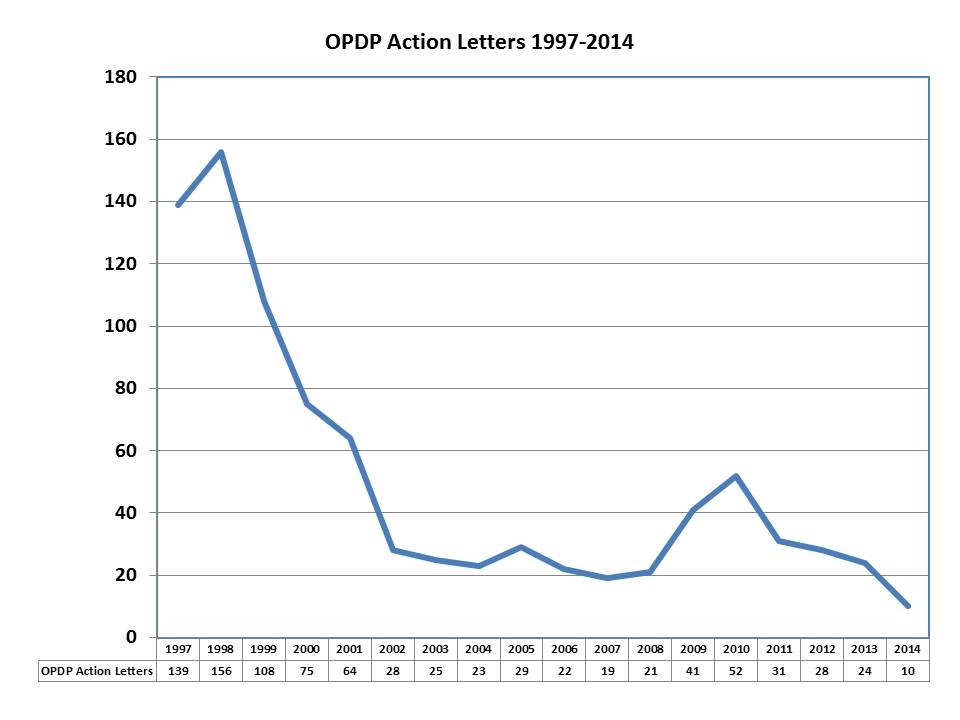
Fuente: Eye on FDA. Warning and NOV Letters Plummet in 2014, 6 de enero, 2015
http://www.eyeonfda.com/eye_on_fda/2015/01/warning-and-nov-letters-plummet-in-2014.html
El blog Eye on FDA se pregunta si esto puede significar que las compañías han ido asimilando lo que no pueden hacer, o simplemente que la OPDP está exigiendo menos. Vamos a dejar que usted lo adivine.
En cualquier caso tenga en consideración lo siguiente. A partir de 2009, la FDA emitió una serie de cartas sobre violaciones al utilizar los medios sociales, y cada caso había ido minuciosamente analizado por expertos en marketing. En ese momento, los comentaristas se quejaron de la falta de una guía oficial sobre el uso de los medios sociales y de que la FDA estaba regulando a través de las cartas de advertencia.
En 2014, la FDA emitió finalmente dos borradores de guías sobre publicidad y promoción de medicamentos enlos medios sociales de comunicación, breves y decepcionantes [a]