Este resumen de datos acompaña las actualizaciones de la base de datos del Libro de Patentes de Medicamentos de I-MAK [1], que ahora incluye nueve de los productos farmacéuticos que formaron parte de la primera lista de negociación de Medicare bajo la Ley de Reducción de la Inflación (IRA), así como los productos Ozempic, Rybelsus y Wegovy (semaglutida), que se han incluido en la lista de medicamentos seleccionados para la segunda ronda de negociaciones.
Introducción
Este informe analiza el uso de patentes y las prácticas de fijación de precios para los medicamentos Eliquis y Ozempic, Ryblesus y Wegovy (semaglutida) en EE UU. En nuestros estudios de caso para estos fármacos, observamos las siguientes tendencias:
La negociación de precios de medicamentos de Medicare que ordena la Ley de Reducción de la Inflación (IRA) representa un paso positivo para frenar los monopolios de mercado excesivos como resultado del abuso de patentes y las disparidades de precios. Sin embargo, solo ofrece una solución limitada para cierto número de medicamentos y pacientes [4], y no aborda las causas fundamentales del abuso de patentes.
Si no se hace una reforma integral del sistema de patentes ni se amplía la negociación de los precios de los medicamentos a todo el mercado, los estadounidenses que no son elegibles para Medicare seguirán pagando precios más altos durante un período más prolongado. Los siguientes estudios de caso analizan cómo Bristol Myers Squibb, Pfizer (Eliquis) y Novo Nordisk (Ozempic, Rybelsus, Wegovy) han explotado el sistema de patentes, las consecuencias financieras de estas acciones y los marcados contrastes entre los precios de los medicamentos y el acceso asequible en EE UU y en otros mercados internacionales comparables.
Este análisis forma parte del trabajo continuo de I-MAK para mantener y ampliar su base de datos “Libro de Patentes de Medicamentos”, que proporciona a legisladores, investigadores y defensores de los derechos de los pacientes información basada en evidencia sobre la forma en que se utilizan las patentes farmacéuticas, sus implicaciones para los precios que los estadounidenses deben pagar por sus medicamentos y la necesidad de una reforma sistémica de las patentes.
Eliquis (apixabán), un anticoagulante de gran éxito comercializado conjuntamente por Bristol Myers Squibb (BMS) y Pfizer, demuestra cómo las compañías farmacéuticas pueden ampliar la protección de sus patentes y su monopolio de mercado de diversas maneras. Gracias a los sistemas legales actuales de ajustes y extensiones a los plazos de las patentes, BMS y Pfizer se han beneficiado de la ampliación del plazo de la patente del producto original, lo que ha ayudado a retrasar la entrada de versiones genéricas de Eliquis.
Insatisfechos con esta ampliación del plazo de la patente, BMS y Pfizer también han obtenido patentes adicionales que han retrasado aún más la entrada de la competencia de genéricos, a la vez que siguen subiendo los precios y generan miles de millones en ingresos adicionales [5]. Aunque la FDA aprobó las versiones genéricas en 2019, gracias a la extensión del plazo de patente (PTE) y a patentes adicionales, BMS y Pfizer han logrado bloquear la entrada al mercado de versiones genéricas de bajo costo de Eliquis al menos hasta 2028.
Extensión de la protección de patentes
BMS y Pfizer han logrado ampliar la protección de patentes, y por ende el monopolio en el mercado de Eliquis, de más de una manera.
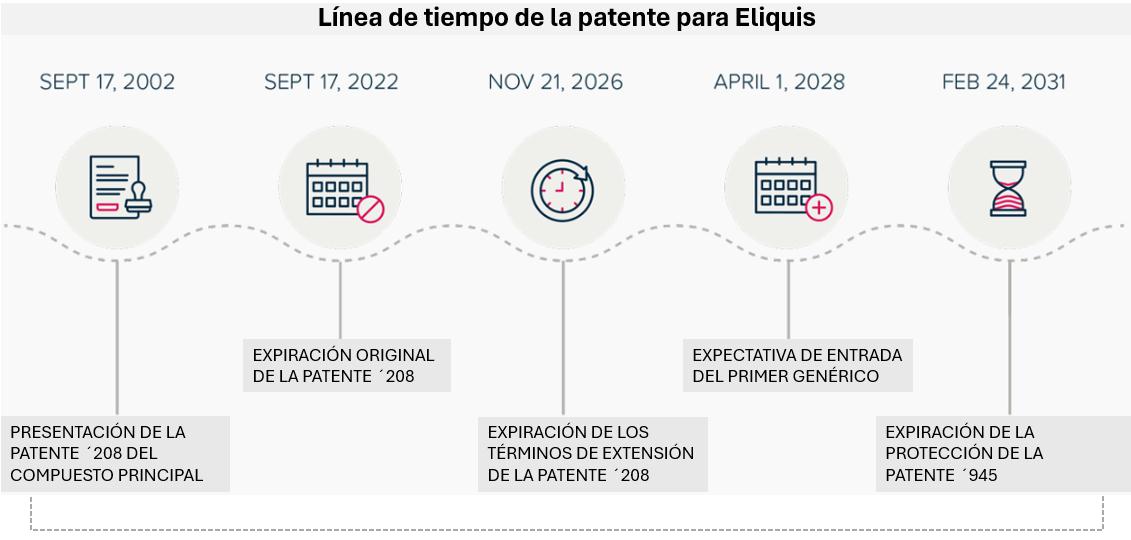
El costo de la ampliar el periodo de protección de la patente y de retrasar la competencia
El costo de la extensión del plazo de patente (PTE)
La extensión legal (PTE) concedida a la patente del compuesto original ‘208 ha retrasado de forma significativa la entrada de competencia genérica para Eliquis. Sin esta extensión, la patente habría expirado el 17 de septiembre de 2022, veinte años después de su presentación. En cambio, la PTE trasladó la fecha de expiración al 21 de noviembre de 2026, otorgando más de cuatro años adicionales de protección de patente y monopolio de mercado. Durante este periodo, se proyecta que Eliquis genere aproximadamente US$39.100 millones en ingresos en EE UU. Este resultado constituye una ganancia extraordinaria derivada únicamente de la PTE.
El costo de la protección mediante patentes secundarias
Incluso después de que expire la PTE de la patente de compuesto ‘208, BMS y Pfizer han asegurado su protección adicional mediante patentes secundarias, en particular la patente ‘945 que cubre una formulación de apixabán. En el intervalo de 16 meses entre la expiración de la patente del compuesto original ‘208 extendida por la PTE (noviembre de 2026) y la entrada anticipada del primer genérico (abril de 2028), se estima que Eliquis generará alrededor de US$11.600 millones en ventas en EE UU. Estos ingresos adicionales provienen únicamente de una patente secundaria que protege una propiedad inherente ya divulgada y cubierta por la patente del compuesto original ‘208.
Impacto financiero total de ampliar el monopolio en el mercado
Estos dos escenarios ponen en evidencia las enormes consecuencias financieras de la extensión de la protección de patentes y del monopolio de mercado para un solo medicamento. Entre la ampliación del plazo de la patente y la protección otorgada por las patentes secundarias, se proyecta que BMS y Pfizer recaudarán más de US$50,000 millones por las ventas de Eliquis en EE UU, ingresos que de otro modo habrían estado sujetos a la competencia genérica.
Esta suma refleja el costo extraordinario que asumen pacientes, aseguradores y contribuyentes debido a un sistema de patentes que permite que las empresas farmacéuticas utilicen múltiples mecanismos para prolongar su protección y mantener su monopolio de mercado.
Disparidades de precios: EE UU versus mercados globales
Negociaciones de Medicare: avances, pero persisten las brechas de precio
El costo de estas ampliaciones de la protección de los monopolios recae de manera significativa sobre los pacientes y los contribuyentes. Solo la Parte D de Medicare gastó más de US$16.400 millones en Eliquis entre junio de 2022 y mayo de 2023, cubriendo a más de 3,7 millones de afiliados [11].
El programa de negociación de precios de medicamentos de la IRA representa un avance positivo, con un “precio justo máximo” definido por los CMS de US$231 para un suministro de 30 días, lo que supone una reducción del 56% frente al precio de lista actual. Sin embargo, incluso esta tarifa negociada sigue siendo muy superior a los precios de lista internacionales. La persistente brecha entre los precios negociados en EE UU y los precios de referencia internacionales pone de relieve cómo la extensión de la protección de las patentes, que bloquea la entrada temprana de genéricos, continúa inflando los costos de los medicamentos en EE UU, incluso con la implementación de la IRA.
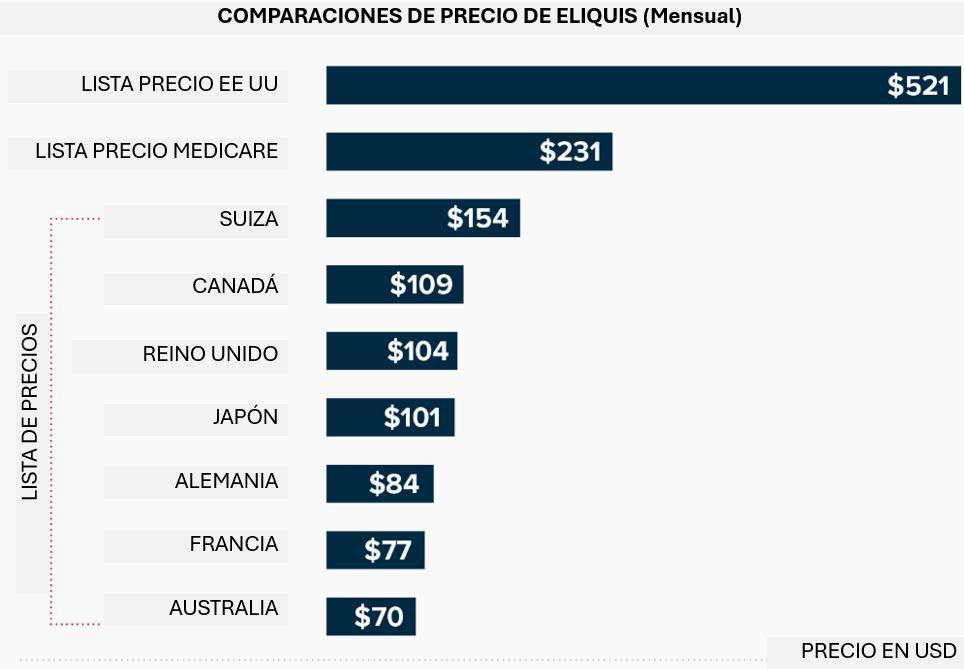
Precios de marca en distintas partes del mundo
El precio de marca de Eliquis en EE UU supera ampliamente al de otros mercados comparables. Las compañías farmacéuticas cobran lo que cada mercado puede asumir, y en EE UU el precio de Eliquis ha aumentado un 124% desde su lanzamiento en 2012 [12]. En 2023, el precio minorista típico en EE UU rondaba los US$8,68 por tableta antes de los reembolsos, lo que equivale a unos US$521 por un mes de tratamiento.
En otros países de altos ingresos se paga solo una fracción de ese monto. Por ejemplo, en Canadá el precio de Eliquis de marca es de aproximadamente US$109 al mes, es decir, un 7 % menos que en EE UU. En Alemania, el costo mensual fue de apenas US$84 en comparaciones recientes, lo que significa que el precio en EE UU fue más de seis veces mayor. Japón (alrededor de US$101) y el Reino Unido (US$104) también han mantenido precios similares.
Incluso tras aplicar los reembolsos en EE UU, el precio neto estimado después de las negociaciones de Medicare (US$231) sigue siendo muy superior al precio de lista en Suiza (US$154, el segundo precio más alto de Eliquis) [13].
Los mercados genéricos de la UE, el Reino Unido y Canadá dejan rezagado a EE UU
El contraste en el acceso al mercado resulta evidente al comparar los tiempos de aprobación y lanzamiento de los genéricos en Canadá, la Unión Europea y el Reino Unido. Esto pone de manifiesto que EE UU lleva un retraso de seis años respecto a estos países de altos ingresos en cuanto al acceso a equivalentes genéricos de menor precio de Eliquis.

Canadá cuenta con un mercado competitivo saludable, en el que múltiples fabricantes están produciendo apixabán genérico a precios sustancialmente más bajos. El costo mensual del genérico en Canadá es de aproximadamente US$20 [20], lo que representa solo una fracción del precio negociado por Medicare en EE UU (US$231) y es considerablemente inferior al precio de Eliquis de marca en otros países desarrollados del mundo (US$70 a 154) [21].
Conclusión
El caso de Eliquis ejemplifica cómo el sistema estadounidense de patentes permite que las compañías farmacéuticas dispongan de más de un mecanismo para ampliar la protección por patentes y los monopolios de sus medicamentos. A través de las extensiones al plazo de las patentes y de las patentes secundarias (follow-on patents), BMS y Pfizer se han asegurado aproximadamente US$50.700 millones en ingresos adicionales en EE UU que, de otra forma, habrían estado sujetos a la competencia de genéricos.
Mientras que los pacientes del Reino Unido y Canadá obtuvieron acceso a versiones genéricas asequibles en 2022, los pacientes en EE UU deberán esperar hasta por lo menos 2028. Esta disparidad se refleja de forma contundente en los precios: todos los pacientes canadienses pueden acceder a versiones genéricas por alrededor de US$20 al mes, mientras que los beneficiarios de Medicare en EE UU seguirán pagando US$231, incluso después de las negociaciones de precios.
Este caso pone de relieve la urgente necesidad de una reforma en la legislación de patentes, con el fin de evitar que las compañías farmacéuticas cuenten con múltiples vías para extender su protección de patentes y mantener precios monopólicos.
Nota de SyF: Puede seguir leyendo (en inglés) sobre lo sucedido con los tres productos que contienen semaglutida en el enlace que aparece en el encabezado.
Referencias