Os reguladores aprovaram terapias controversas em meio a mortes excessivas, eficácias questionáveis e conflitos de interesse.
Seis anos atrás, Genevieve Lane levava uma vida ativa na Flórida quando começou a esquecer os nomes dos vizinhos e onde colocava as chaves. Aos 76 anos, ela poderia ter ignorado esses lapsos como meros sinais de envelhecimento, mas quando começou a ter momentos de confusão e ocasionalmente se perder enquanto caminhava, sua amiga de longa data, Vicki Holmes, lhe contou sobre um centro de pesquisa nas proximidades. Lá, um médico diagnosticou-a com Alzheimer precoce e lhe contou sobre um estudo que testava um novo medicamento promissor. Lane se inscreveu, dizendo à filha que queria ter mais tempo.
Logo após começar a receber as infusões duas vezes ao mês, ela e Holmes criam que sua memória estava melhorando. “No início, realmente achávamos que estava funcionando”, disse Holmes. Mas Lane não estava tomando o medicamento; ela estava recebendo placebo, infusões de solução salina. Quando o ensaio foi concluído após 18 meses, ela começou a receber o medicamento real, chamado Leqembi, como parte da fase de extensão do estudo.
Seis semanas depois, Lane morreu.
A família de Lane solicitou uma autópsia. “Achei que o medicamento a tivesse matado”, disse Yvonne Battaglia, sua filha, ao The Lever. “Não confiava no medicamento nem na empresa farmacêutica.” Mas a empresa de pesquisa contratada pela farmacêutica e o hospital onde ela faleceu afirmaram que não poderiam realizar uma autópsia. Então, Battaglia e sua família contrataram um neuropatologista independente.
O patologista encontrou o cérebro de Lane repleto de vasos sanguíneos rompidos, inflamação generalizada e áreas de células mortas. Uma segunda autópsia, realizada no Centro Médico da Universidade Vanderbilt, para onde a família doou o cérebro, confirmou a causa da morte: inflamação cerebral severa, provavelmente devido ao Leqembi [1].
Ela não foi a única paciente que sofreu danos ao tomar o medicamento. Embora a empresa que fabrica o Leqembi não tenha relatado nenhuma morte relacionada ao medicamento durante seu estudo de 18 meses, quatro mortes relacionadas ao medicamento ocorreram posteriormente, durante a fase de extensão do estudo, que envolveu 714 pacientes que tomaram o medicamento [2]. E a morte não foi o único resultado catastrófico. Durante o ensaio principal, pelo menos dois pacientes que começaram com problemas de memória leves ficaram deficientes após serem medicados, incapazes de cuidar de si mesmos ou reconhecer seus familiares [3]. Vinte e dois por cento dos pacientes que tomaram Leqembi desenvolveram hemorragia cerebral ou inchaço — mais do que o dobro dos 10% que tomaram placebo [4].
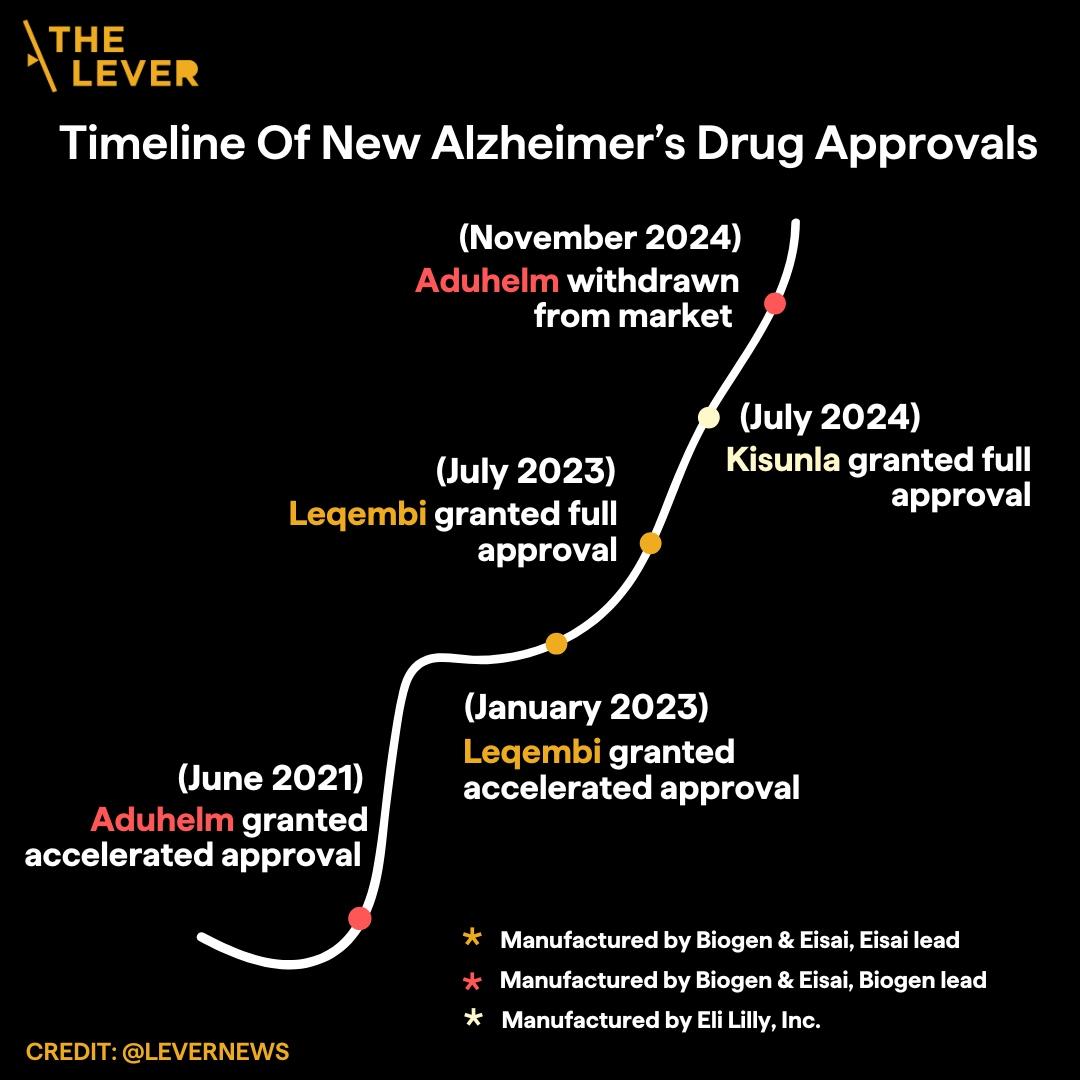
Mesmo assim, a Administração de Alimentos e Medicamentos dos EUA (FDA), que regula os produtos médicos, aprovou o medicamento em 2023.
O Leqembi é um dos três medicamentos para Alzheimer da mesma classe, todos introduzidos com uma estranha mistura de ceticismo e entusiasmo nos últimos quatro anos. O antecessor do Leqembi, o Aduhelm, lançado em 2021, já saiu do mercado após alegações de um acordo secreto entre fabricantes de medicamentos e reguladores (os fabricantes citaram razões comerciais para retirar o medicamento). O terceiro medicamento da classe, Kisunla, foi aprovado em julho de 2024. Nos estudos com Kisunla, os pacientes apresentaram lesões cerebrais associadas ao medicamento em uma taxa mais elevada do que com Leqembi. Porém, ambos os medicamentos estão sendo aclamados por alguns médicos, executivos farmacêuticos e jornalistas como medicamentos “revolucionários”, os primeiros que poderiam “mudar o curso” da doença de Alzheimer [5,6].
O terceiro fármaco dessa classe, Kisunla, foi aprovado em julho de 2024. Nos estudos sobre o Kisunla, os pacientes apresentaram lesões cerebrais associadas ao fármaco em proporção maior do que com o Leqembi [7, 8]. No entanto, ambos os medicamentos foram aclamados por alguns médicos, executivos da indústria farmacêutica e jornalistas como fármacos “inovadores” que poderiam “mudar a evolução” da doença de Alzheimer [9, 10].
Mas eles são realmente revolucionários?
Poucas doenças são tão perniciosas quanto o Alzheimer, que pode lentamente destruir uma pessoa. Se o curso da doença pudesse ser alterado de forma significativa por meio de medicamentos, alguns pacientes estariam, sem dúvida, dispostos a correr alguns riscos, e a aprovação de um medicamento eficaz daria aos pacientes e suas famílias mais opções para a gestão da doença. Os fabricantes do Leqembi e do Kisunla afirmam que os estudos realizados com seus medicamentos e a aprovação subsequentemente concedida pela FDA confirmam que os benefícios potenciais dos tratamentos superam os riscos.
Mas esta investigação revelou evidências de que tanto os fabricantes do medicamento quanto a FDA subestimaram os possíveis danos, enquanto exageraram os benefícios potenciais. A Lever revelou dados relacionados à aprovação do Kisunla: quando o medicamento foi submetido à análise pela primeira vez, a agência recusou sua aprovação, observando um “desequilíbrio nas mortes”, assim como a falta de dados, pois a empresa havia perdido o rastro de quase um quarto dos pacientes envolvidos em um estudo importante. A FDA informou à empresa que ela teria que descobrir se eles estavam vivos ou mortos [11].
A Lever também descobriu que três dos quatro médicos consultores da FDA que votaram a favor do Leqembi tinham ligações financeiras com os fabricantes ou outras empresas farmacêuticas. Além disso, dados dos ensaios clínicos mostram que os efeitos dos medicamentos sobre a cognição e a função podem ser menores do que os pacientes e seus cuidadores normalmente são capazes de perceber. Quando os resultados ruins dos estudos começaram a surgir, um painel convocado por uma influente organização de pacientes ligada aos fabricantes de medicamentos sugeriu um critério de referência mais baixo para medir a eficácia dos medicamentos.
O governo Trump está enviando mensagens ambíguas sobre sua reforma planejada da FDA e do processo de aprovação de medicamentos. O indicado do presidente para secretário do Departamento de Saúde e Serviços Humanos, Robert F. Kennedy Jr., quer facilitar a chegada de tratamentos questionáveis ao mercado, alegando que a FDA está promovendo uma “guerra à saúde pública” ao bloquear a aprovação de terapias não comprovadas, como a hidroxicloroquina, para prevenir a COVID-19 [12, 13]. Kennedy, porém, também promoveu uma regulamentação mais rigorosa das vacinas. Ele deve iniciar sua audiência de confirmação na quarta-feira [14,15].
No dia 3 de janeiro, a FDA enviou um e-mail informando que estava trabalhando em uma resposta a uma consulta da The Lever sobre críticas de que os efeitos dos novos medicamentos para Alzheimer são muito pequenos para serem percebidos pelos pacientes e cuidadores e que os medicamentos apresentam “sérias preocupações de segurança”. Porém, em 23 de janeiro, a agência enviou um e-mail ao The Lever informando que o Departamento de Saúde e Serviços Humanos dos EUA “emitiu uma pausa em comunicações em massa… que não estão diretamente relacionadas a emergências ou críticas à preservação da saúde” [16].
A empresa farmacêutica japonesa Eisai, que desenvolveu o Leqembi em parceria com a empresa americana de biotecnologia Biogen, disse ao The Lever que seus estudos mostram que o medicamento é seguro e eficaz. A empresa citou a votação unânime dos consultores da FDA para aprovar o Leqembi como confirmação do “benefício clínico” do medicamento e seu “perfil geral de risco-benefício”. A Eli Lilly, fabricante do Kisunla, disse que seu estudo mostrou que o retardamento da demência foi “alcançado de forma muito confiável”. A FDA também mantém que os novos medicamentos são “seguros e eficazes”, conforme descrito em seus documentos de revisão [17].
Apesar das garantias da agência e dos fabricantes, muitos neurologistas continuam relutantes em prescrever os novos medicamentos. Madhav Thambisetty, ex-investigador sênior do Instituto Nacional sobre Envelhecimento do Instituto Nacional de Saúde (atualmente diretor executivo de medicina translacional em neurociência na empresa farmacêutica Novartis), disse-nos que acredita que o Leqembi pode oferecer benefícios modestos, mas que somente o prescreveria após alertar seus pacientes sobre o que se sabe — e o que não se sabe — sobre os efeitos colaterais potencialmente graves. Quando questionado se recomendaria o medicamento se seus próprios parentes desenvolvessem Alzheimer, sua resposta foi direta: “Absolutamente não”.
Reshma Ramachandran, uma codiretora da Colaboração de Yale para Rigor Regulatório, Integridade e Transparência (Yale Collaboration for Regulatory Rigor, Integrity, and Transparency) e especialista em análise de ensaios clínicos, disse-nos que o Leqembi e o Kisunla “apresentam sérios riscos à segurança e, na melhor das hipóteses, benefícios pouco claros” e “estão dando falsas esperanças aos pacientes e seus médicos”. Rudolph Castellani, um professor de neuropatologia da Universidade Northwestern, contou pra gente que está preocupado que, se os remédios forem receitados pra muita gente, os efeitos tóxicos deles poderiam se tornar “um desastre de saúde pública”.
Os medicamentos devem ser administrados por via intravenosa, e não serem tomados na forma de comprimidos, o que até agora tem limitado o mercado. Em uma reunião sobre os resultados financeiros de novembro de 2024, a Eisai informou que cerca de 4.000 pacientes haviam tomado Leqembi, e os hospitais estão criando centros de infusão para oferecer o tratamento de forma mais ampla. (A empresa se recusou a divulgar dados mais recentes.)
Uma informação fundamental que médicos e pacientes precisam para avaliar se vale a pena tomar os medicamentos é a taxa de eventos adversos graves que eles causam. Eventos adversos graves são definidos como deficiência permanente, necessidade de internação ou morte. De acordo com os fabricantes dos medicamentos, os pacientes que tomaram Leqembi ou Kisunla sofreram eventos adversos graves durante os ensaios clínicos em taxas mais altas do que aqueles que tomaram um placebo.
Estima-se que cinco a sete milhões de pessoas tenham comprometimento cognitivo leve devido à doença de Alzheimer, mas somente 1,28 milhão foram diagnosticadas com a condição. Mesmo que somente aqueles que foram diagnosticados acabassem tomando um dos medicamentos, dados revelados pelo The Lever sugerem que dezenas de milhares de pacientes poderiam ficar gravemente feridos, deficientes ou morrerem [19, 20].
Durante o ensaio clínico chave do Leqembi, cinco pacientes sofreram grandes hemorragias cerebrais (conhecidas como “macrohemorragias”) em comparação com somente um paciente que recebeu placebo [21]. “Mesmo que a taxa de mortalidade não se revele mais elevada, o aumento das hemorragias cerebrais graves é preocupante”, disse Steven Goodman, médico e professor de epidemiologia na Universidade de Stanford e especialista em desenho de ensaios clínicos, ao The Lever. “Alguns dos efeitos colaterais dos medicamentos são tão graves quanto os sintomas da doença de Alzheimer que os pacientes estão tentando evitar.”
As empresas farmacêuticas agora visam mercados ainda maiores, expandindo o tratamento para indivíduos com síndrome de Down e aqueles que não têm nenhum problema de memória, mas podem estar em risco de desenvolver Alzheimer [22, 23]. O preço de tabela do Leqembi é de US$ 26.500 por ano, e o do Kisunla é de US$ 32.000 [24, 25]. Some isso ao custo não apenas dos medicamentos, mas também o preço dos exames de sangue, punções lombares e exames diagnósticos por imagem necessários, e o preço total por paciente nos EUA para o Leqembi é estimado em US$ 109.000 por paciente por ano [26].
O fracasso como destino
O caminho para os novos medicamentos contra o Alzheimer foi traçado há mais de 30 anos, com o desenvolvimento de uma teoria de que a doença é causada principalmente pelo acúmulo de uma proteína no cérebro chamada beta-amilóide. Embora os depósitos de amilóide estejam presentes no cérebro de pacientes com Alzheimer, algumas pessoas com amilóide nunca desenvolvem demência, e ninguém jamais demonstrou definitivamente que a proteína causa a doença, e que não é somente um subproduto dela.
Os especialistas têm questionado a chamada “hipótese amilóide” há anos [29 30]. Recentemente, as dúvidas sobre a teoria aumentaram quando uma investigação em andamento, detalhada na revista Science em 2022, descobriu que as imagens técnicas usadas em um estudo importante que apoiava a hipótese tinham sido adulteradas.
Sem muitas outras opções, a indústria farmacêutica investiu bilhões de dólares nas últimas duas décadas na pesquisa e no desenvolvimento de medicamentos antiamilóides. De 2004 a 2021, as empresas desenvolveram pelo menos 23 deles [31], todos os quais se mostraram inúteis ou até mesmo perigosos. Em alguns estudos, a cognição dos pacientes piorou; em outros, eles sofreram efeitos colaterais graves, incluindo convulsões, encefalite e morte [32, 34].
Entram em cena Aduhelm, Leqembi e Kisunla. Esses medicamentos utilizam anticorpos monoclonais para atacar a amilóide, de forma muito semelhante à maneira como o sistema imunológico ataca um vírus. Todos os três se mostraram altamente eficazes na remoção da amilóide do cérebro. Infelizmente, quase nada a mais sobre eles é tão claro.
O primeiro da classe, Aduhelm, foi desenvolvido em conjunto pela Biogen e pela Eisai. A Biogen suspendeu prematuramente seus dois estudos fundamentais sobre o Aduhelm, alegando “futilidade” [35]. Em outras palavras, o medicamento não funcionou. Mais tarde, a empresa reanalisou os mesmos dados, desta vez obtendo resultados conflitantes: um estudo mostrou uma ligeira desaceleração da demência; o outro, que era quase idêntico em seu desenho, ainda era negativo: o medicamento não confirmou nenhum sequer benefício para os pacientes.
Enterradas nas quase 1.000 páginas das análises da FDA sobre o Aduhelm, havia algumas descobertas preocupantes. Quando os revisores da FDA compararam a redução da amilóide em pacientes que tomavam os medicamentos com sua função cognitiva, não houve nenhuma correlação [36]. Em outras palavras, os pacientes poderiam apresentar uma redução significativa da amilóide sem nenhuma desaceleração da perda de memória.
Depois que a Biogen apresentou seus dados à FDA, a agência convocou uma reunião do comitê assessor de especialistas externos em 2020. (Essas reuniões são realizadas quando os resultados dos estudos são conflitantes ou incertos). Os funcionários da FDA disseram ao painel de revisão externo que o estudo negativo não era confiável, orientando-os a se concentrarem no estudo positivo, que mostrou alguma desaceleração da demência. Billy Dunn, principal funcionário da agência na área de neurociência, também informou que a agência não consideraria a remoção do amilóide como base para a aprovação, dizendo: “Não estamos usando o amilóide como substituto da eficácia” [37]. Em vez disso, a FDA queria que os consultores avaliassem o efeito do medicamento na desaceleração da demência.
Os membros do comitê argumentaram que os estudos eram quase idênticos em seu desenho e que era irracional focar somente no estudo positivo [38]. Eles deram ao medicamento uma avaliação negativa (10 dos 11 membros do comitê disseram que não havia evidências suficientes da eficácia do medicamento; o 11º disse que estava “incerto”) [39].
Por sugestão de Dunn, a Biogen solicitou a aprovação acelerada do Aduhelm com base na sua capacidade de remover a amilóide, em vez de basear-se na comprovação de que realmente retarda a demência ou não [40].
Essa era precisamente a abordagem que Dunn havia dito aos consultores que a FDA não usaria. Então, quando a agência anunciou no início de 2021 que estava ignorando seus consultores e concedendo a aprovação com base na redução do amiloide, três dos assessores pediram demissão em protesto [41]. Um deles, Aaron Kesselheim, professor de medicina em Harvard e um dos principais especialistas no processo de aprovação de medicamentos da FDA, chamou-a de “provavelmente a pior decisão de aprovação de medicamento na história recente dos Estados Unidos” [42] .
O resultado foi um desastre de relações públicas para a FDA e para o medicamento. A imprensa descobriu uma série de desvios do protocolo da agência, incluindo um plano que a Biogen apelidou de Projeto Onyx, no qual seus cientistas e gerentes da FDA, incluindo Dunn, trabalharam juntos para obter a aprovação do medicamento [43, 45]. Uma investigação do Congresso concluiu que Dunn era inadequadamente próximo da Biogen e que a aprovação estava “repleta de irregularidades” [46]. Alguns hospitais de renome recusaram-se a fornecer Aduhelm aos pacientes e, no início de 2024, a Biogen anunciou que iria descontinuar o medicamento [47, 48]].
Quando o próximo medicamento da classe, Leqembi, foi submetido a revisão em 2022, parecia-se com o Aduhelm em muitos pontos. Ambos os medicamentos foram desenvolvidos pela Biogen e pela Eisai (com a Eisai assumindo o papel principal no Leqembi). Assim como o Aduhelm, o primeiro ensaio clínico do Leqembi não conseguiu confirmar que os pacientes que tomaram o medicamento tiveram um desempenho melhor no teste cognitivo primário da empresa do que aqueles que receberam placebo [49]. A Eisai usou efeitos secundários, incluindo a remoção de amilóide, para solicitar a aprovação acelerada, e a FDA aprovou o medicamento em janeiro de 2023 — com base nos resultados de apenas 152 pacientes.
Ao mesmo tempo, havia evidências de que o medicamento causava efeitos graves. A FDA detectou complicações associadas ao Leqembi, complicações que a empresa minimizou ou não incluiu em seu resumo de “eventos adversos” [49]. A FDA observou que a Eisai não havia relatado sintomas causados por inchaço cerebral em dois pacientes (um deles teve uma convulsão) e omitiu dois casos de hemorragia cerebral [50].
Conflitos de Interesses
Antes que um segundo estudo maior sobre o Leqembi fosse submetido à revisão, a FDA substituiu seu comitê consultivo de 11 membros, que era composto principalmente por médicos acadêmicos independentes que haviam rejeitado o Aduhelm. O novo comitê consultivo, composto por seis membros, incluía quatro médicos, um bioestatístico e um representante dos pacientes.
De acordo com a análise da The Lever, três dos quatro médicos consultores tinham conflitos de interesse financeiro com a Biogen, parceira da Eisai no desenvolvimento do Leqembi, incluindo o recebimento de honorários de consultoria, palestras e financiamento para pesquisa da empresa [51]. Um quarto consultor era o CEO de um consórcio de desenvolvimento de medicamentos cujos membros incluíam a Eisai, a Biogen e a Eli Lilly. O consórcio recebe financiamento de fabricantes de medicamentos e afirma como um de seus sucessos que “impulsionou avanços cruciais” para a aprovação do Aduhelm e do Leqembi [52].
Os regulamentos da FDA exigem que os consultores sejam os mais independentes das empresas farmacêuticas possível. Embora suas ligações financeiras não sugiram necessariamente má conduta, estudos demonstraram que pesquisadores e médicos com tais ligações com a indústria são mais propensos a ver os medicamentos de forma favorável do que especialistas sem conflitos de interesses [53].
Como o painel consultivo recém-constituído deu aprovação unânime ao Leqembi, não houve espetáculo de demissões públicas por causa da aprovação da FDA, e o medicamento não foi alvo da mesma crítica da imprensa que o Aduhelm [54]. Na verdade, a cobertura foi comemorativa. A revista Time considerou o medicamento uma das “melhores invenções de 2023” [55].
Em uma coletiva de imprensa realizada em 7 de março de 2024, a Eisai anunciou um plano coordenado para impulsionar as vendas do Leqembi, incluindo o lançamento planejado de um novo exame de sangue para a doença de Alzheimer que identificaria rapidamente mais pacientes [56]. O exame de sangue, juntamente com o desenvolvimento de uma versão injetável do medicamento que os pacientes podem usar em casa, poderia ajudar a levar o tratamento às mãos dos prestadores de cuidados primários.
Mas o maior aumento nas vendas poderá vir dos resultados de um ensaio clínico que testa o Leqembi em pessoas que não têm problemas de memória, mas que podem estar em risco de desenvolver a doença devido a uma predisposição genética ou sinais de depósitos amilóides no cérebro. Na conferência de imprensa, a empresa estimou que o seu mercado potencial duplicaria para 6 milhões de potenciais clientes até 2032, se a FDA aprovasse o Leqembi para este uso “pré-clínico” [57].
Mas os riscos e efeitos do Leqembi (juntamente com o Kisunla, que também foi amplamente elogiado quando foi lançado no verão passado) são bastante semelhantes aos do Aduhelm, que já não está mais no mercado [58].
“Todos os novos medicamentos para Alzheimer — Aduhelm, Leqembi e Kisunla — são essencialmente os mesmos”, disse George Perry, professor de neurociência da Universidade do Texas em San Antonio e editor-chefe do Journal of Alzheimer’s Disease, ao The Lever. “Eles funcionam pelo mesmo mecanismo e demonstram a mesma eficácia insignificante e danos graves.”
“Tóxico e Potencialmente Letal”
Em 2019, uma mulher na faixa dos 60 anos chamada Monique morava com o marido Richard nas redondezas de Paris quando preocupações com perda de memória a levaram a consultar um neurologista. (Richard pediu à The Lever que usasse somente os primeiros nomes.) Ela e o neurologista conversaram sobre um ensaio clínico do Leqembi, e ela se inscreveu. Após a 11ª infusão do medicamento, Monique foi levada ao hospital enquanto sofria uma série de convulsões potencialmente fatais, que seu neurologista determinou terem sido causadas por inchaço cerebral associado ao Leqembi [59].
Uma série de novos problemas surgiram após as convulsões, deixando Monique internada por meses. Quando sua família foi autorizada a visitá-la, Richard lembra: “Ela estava delirando, tendo alucinações, puxando os equipamentos médicos, com os braços e pernas amarrados às grades da cama, sofrendo, sem nos reconhecer”. Uma vez em casa, Monique entrou rapidamente em estado de demência. Os poucos momentos em que ela está lúcida agora são difíceis de uma maneira diferente, disse Richard, porque ela tem vislumbres da realidade de sua condição.
Cinco meses após a internação de Monique, outra parisiense, Nicole Nicolle, de 70 anos, foi levada para a sala de emergência, tendo perdido metade da visão em cada olho. Uma tomografia computadorizada revelou uma enorme hemorragia cerebral [60]. Ela também participava do estudo com o Leqembi e estava tomando o medicamento. Em 18 meses, ela passou de um quadro de comprometimento cognitivo leve para demência avançada, um processo que normalmente pode levar até uma década [61]. Hoje, sua filha, Céline Marzin, diz que sua mãe raramente reconhece a família. “Ela está em seu próprio mundo”, disse Marzin. “Ninguém consegue entrar.”
Tanto o inchaço quanto o sangramento que Monique e Nicolle apresentaram são resultado da ação dos medicamentos, afirma Castellani, da Northwestern. O excesso de amiloide no cérebro geralmente se acumula nas paredes dos vasos sanguíneos e, quando removido, “pode ser como arrancar uma crosta de uma ferida”, disse ele. Os vasos sanguíneos são destruídos e ficam inflamados e com vazamentos, o que causa inchaço cerebral e hemorragia. Em casos severos, os vasos sanguíneos danificados começam a morrer. Como disse Castellani, “o fato é que você está lidando com um medicamento tóxico e potencialmente letal”.
Muitos pacientes que tomam esses medicamentos sofrem hemorragias cerebrais menores e menos inchaço do que Monique e Nicolle. Os fabricantes afirmam que esses sintomas geralmente “se resolvem” ou desaparecem por conta própria. Alguns não causam sintomas. Mas ninguém sabe as consequências a longo prazo desses incidentes — se, por exemplo, eles podem acelerar a progressão da demência — especialmente quando ocorrem repetidamente. Para ter certeza, os especialistas dizem que pesquisadores que não são pagos pelas empresas precisam de informações sobre pacientes que tiveram hemorragias cerebrais e inchaço.
Enquanto Thambisetty ainda estava no Instituto Nacional do Envelhecimento, ele e outros pesquisadores pediram à Eisai que divulgasse informações sobre essas complicações, mas não obtiveram sucesso [62]. A empresa afirmou que não forneceria dados de pacientes enquanto o medicamento estivesse sob análise regulatória global. Mas é “exatamente nesse momento que os dados são necessários”, afirmou Perry, do Journal of Alzheimer’s Disease. Sem eles, os reguladores não podem analisar as análises de fontes independentes.
Mesmo em relação à prevalência do efeito colateral potencial mais grave do Leqembi — a morte —, existem incertezas. Em dezembro de 2022, a Eisai publicou os resultados do seu principal ensaio clínico do Leqembi no The New England Journal of Medicine, no qual os autores afirmaram: “Nenhuma morte foi considerada pelos investigadores como estando relacionada” com o medicamento [63]. Eles acrescentaram: “São necessários ensaios mais longos para determinar a eficácia e a segurança do [Leqembi] na doença de Alzheimer em fase inicial.”
Mas uma investigação mais aprofundada das complicações do medicamento não pareceu ser uma prioridade para a Eisai; nenhuma autópsia foi relatada pela empresa nos seis casos de morte ocorridos durante a fase principal do estudo enquanto os participantes tomavam o medicamento, de um total de 898 participantes [64]. Pular a autópsia é comum quando a causa da morte parece claramente não estar relacionada ao medicamento em questão, mas é potencialmente muito importante quando um medicamento pode danificar repentinamente o cérebro e quando a morte pode ser atribuída incorretamente a algo que não seja o medicamento.
De acordo com Bryce Vissel, chefe do programa de neurociência e medicina regenerativa do St. Vincent’s Hospital, em Sydney, “sem uma autópsia, não é possível excluir a possibilidade de que o medicamento tenha contribuído ou mesmo causado suas mortes”. (A Eisai não costuma perguntar às famílias se elas gostariam de realizar uma autópsia quando um paciente morre, mas afirma que solicita cópias de todos os laudos de autópsia realizados por patologistas independentes.)
Pouco depois da conclusão da fase principal do ensaio, foram divulgados os resultados da autópsia de dois pacientes que faleceram enquanto tomavam Leqembi durante a fase de extensão do estudo. Ambos os casos implicaram o uso do medicamento.
Uma das pacientes era Genevieve Lane, a paciente da Flórida que morreu seis semanas após iniciar as infusões do medicamento. Sua autópsia foi realizada por uma equipe de médicos da Universidade Vanderbilt liderada pelo neurologista Matthew Schrag, professor assistente de neurologia. Ele e 11 colegas publicaram suas descobertas na revista médica Nature Communications, documentando inchaço e hemorragia, efeitos conhecidos do medicamento [65]. O artigo incluiu imagens e um vídeo dos vasos sanguíneos no cérebro de Lane.
Schrag enviou suas conclusões à Eisai e solicitou informações adicionais. Mas a resposta da empresa, segundo ele, “foi muito lenta” e não chegou a tempo. Com base nos documentos apresentados pela Eisai à FDA, a agência declarou que “não é possível chegar a conclusões definitivas” sobre a causa da morte de Lane, pois a empresa informou aos reguladores que não conseguiu obter “documentos essenciais que comprovassem as conclusões [da equipe de Schrag]”.
Em um e-mail enviado ao The Lever, a Eisai classificou as conclusões de Schrag a partir da autópsia como uma “opinião”. Quando solicitada a informar quais medidas a empresa tomou para confirmar ou refutar as conclusões, uma porta-voz da Eisai respondeu: “Geralmente não interagimos diretamente com pesquisadores independentes, pois não queremos estar em posição de influenciar ou tendenciar suas opiniões”
Os resultados de outra autópsia, realizada em Jean Terrien, uma mulher atlética de 65 anos que morreu no final de 2022, sugeriram que a droga teve um papel importante na sua morte [66]. Terrien foi levada às pressas para uma sala de emergência em Chicago, confusa e incapaz de falar. Quando ela morreu quatro dias depois, Castellani, o neuropatologista da Northwestern, realizou a autópsia. Ele relatou que ela morreu de hemorragias cerebrais extensas semelhantes às de Lane.
A Eisai também classificou os resultados da autópsia de Castellani como uma “opinião”, sugerindo que Terrien morreu de um derrame e hemorragia cerebral causados por um medicamento para dissolver coágulos usado para tratar um suposto derrame. Castellani afirma: “Ela não teve um derrame típico, teve um derrame mímico” causado pelos efeitos colaterais do Leqembi. Ele disse ao The Lever que a morte dela foi resultado de uma série de eventos desencadeados pelo medicamento, acrescentando: “Se ela não tivesse tomado Leqembi, não teria tido o derrame mímico que levou os médicos a tratá-la com um medicamento para dissolver coágulos”.
Em maio de 2024, a Eisai informou que quatro das nove mortes ocorridas durante a fase de extensão estavam “possivelmente” relacionadas ao medicamento [67].
Também ocorreram mortes durante os ensaios do Kisunla, o medicamento mais recente para o Alzheimer. A Eli Lilly, fabricante do medicamento, apresentou os seus dados à FDA em 2022. A agência observou um “desequilíbrio” nas mortes: 17 pacientes (2,7%) que tomaram Kisunla morreram durante os ensaios clínicos, em comparação com 10 (1,4%) que tomaram um placebo [68]. Além disso, foi descoberto que a Eli Lilly havia parado de acompanhar 391 pacientes que abandonaram o ensaio com 1.736 pacientes [69]. As pessoas que participam de ensaios clínicos frequentemente abandonam o ensaio quando sofrem efeitos colaterais, e algumas podem morrer subsequentemente. Não incluir esses desistentes na análise dos dados pode fazer com que um medicamento pareça mais seguro e eficaz do que ele realmente é [70].
A FDA rejeitou a primeira tentativa da empresa de obter a aprovação do Kisunla, alegando a grande quantidade de dados em falta, e instruiu-a a localizar os pacientes que faltavam [71, 71].
Para isso, a Eli Lilly procurou um fornecedor terceirizado não identificado, que investigou os pacientes desaparecidos. O fornecedor localizou metade deles, relatando duas mortes adicionais entre os participantes que tomaram Kisunla e outras cinco entre os pacientes que receberam placebo [73]. As descobertas reduziram um pouco a diferença no número de mortes entre os dois grupos (a mortalidade foi de 2,5% com o Kisunla e de 1,9% com o placebo) [74, 75]. Porém, vários especialistas disseram à The Lever que a falta de transparência sobre o fornecedor terceirizado e seus métodos impossibilita que pesquisadores independentes avaliem a confiabilidade dos novos dados].
Referências