Agencias Reguladoras
Las agencias reguladoras de los países europeos no están garantizando que los datos sobre los medicamentos que pueden salvar vidas se publiquen de forma rápida y sistemática, advierte un nuevo informe.
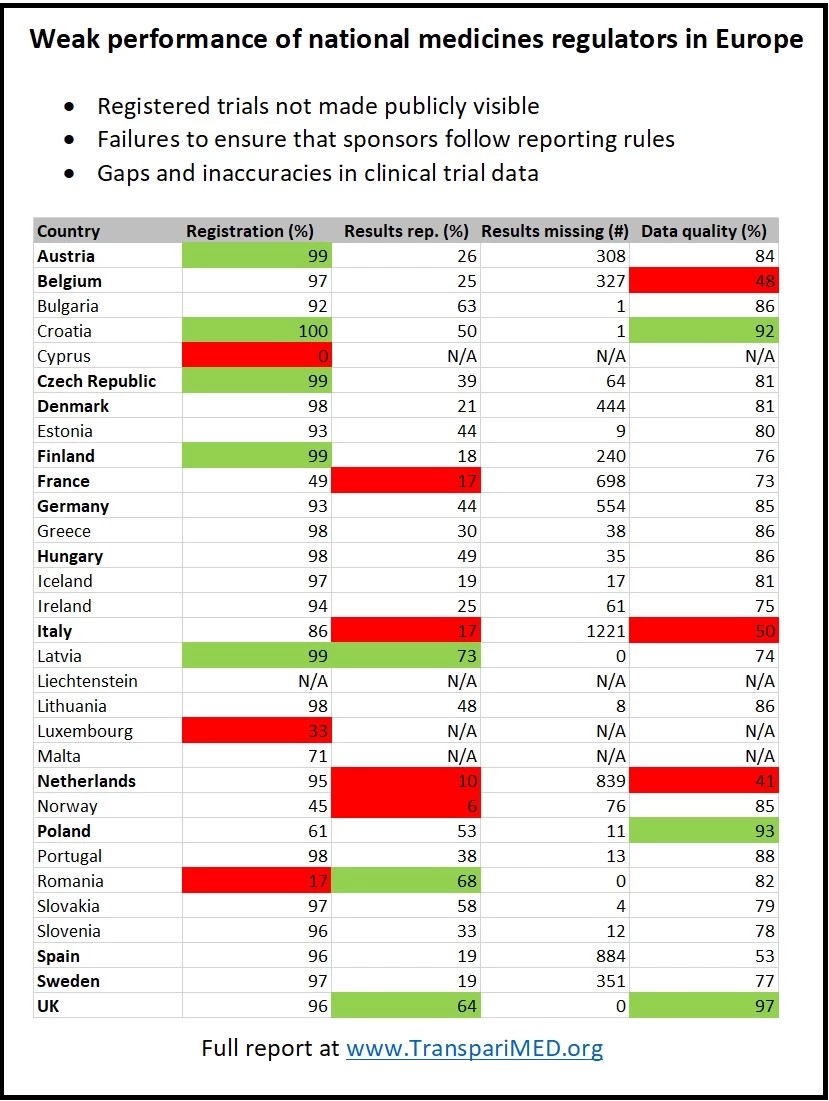
Entre los reguladores más importantes, CCMO (Países Bajos) tiene el peor desempeño: solo el 10% de los ensayos holandeses que se han hecho en un solo país y que se aprobaron antes de 2015 han publicado sus resultados en el registro. La agencia reguladora ANSM (Francia) y AIFA (Italia) también tienen un desempeño excepcionalmente débil, con una tasa de notificación de solo el 17%. Por el contrario, el regulador de Letonia cuenta con una tasa de notificación del 73% de tales ensayos.
Además, muchos reguladores nacionales han dejado el registro plagado de datos inexactos y datos faltantes, lo que impide determinar de manera confiable qué tratamientos y vacunas se están testeando actualmente en los ensayos, y cuánto han avanzado los ensayos individuales. Un análisis de un subconjunto de ensayos muestra que solo el 49% de los protocolos se pusieron a disposición del público en el registro, en primer lugar por ANSM, el regulador francés.
Los reguladores nacionales son responsables de garantizar que las empresas farmacéuticas, las universidades y los hospitales que realizan ensayos clínicos en sus países hagan públicos los resultados de los ensayos en el registro europeo de ensayos durante los 12 meses posteriores a la finalización de un ensayo.
Sin embargo, muchos reguladores nacionales ni siquiera se están poniendo en contacto con los patrocinadores de los ensayos que infringen las reglas. Actualmente, en el registro faltan miles de resultados de ensayos, lo que enlentece los avances en medicina y deja vacíos en la base de evidencia médica, algo que daña a los pacientes, socava la salud pública y desperdicia fondos públicos de investigación.
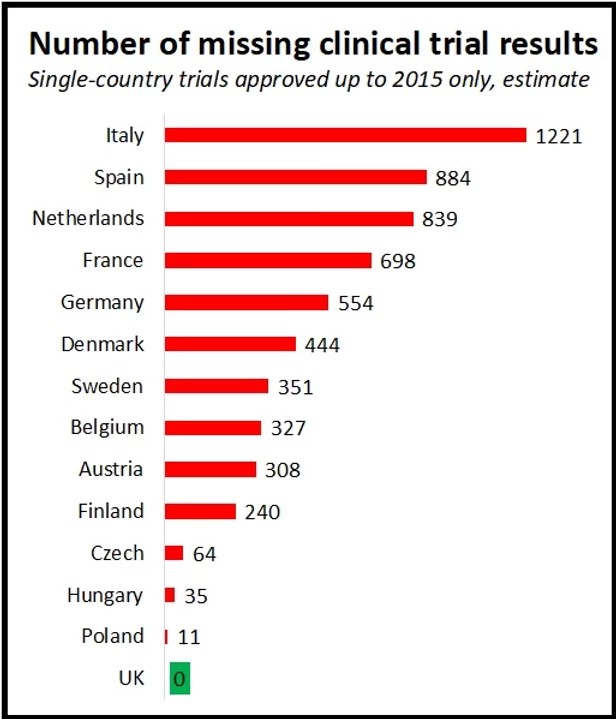
Solo en Italia, se estima que 1.221 ensayos que se realizan en un solo país aprobados y que la AIFA aprobó antes de 2015 carecen de resultados, infringiendo las normas europeas de transparencia. La inacción de los reguladores nacionales también ha provocado que falte un gran número de resultados en España (884), los Países Bajos (839), Francia (698) y Alemania (554).
El informe solicita que los reguladores nacionales de toda Europa den tres pasos:
Los reguladores nacionales podrían dar estos pasos de forma unilateral, sin esperar a tener los resultados de las discusiones en curso a nivel europeo sobre cómo mejorar los informes de ensayos clínicos en todo el continente.
El informe se basa en una preimpresión de Nicholas DeVito y Ben Goldacre de la Universidad de Oxford, además de un análisis de datos adicional que ha hecho DeVito. El informe lo han publicado conjuntamente cuatro grupos sin fines de lucro: Health Action International, Melanoma Patient Network Europe, Transparencia Internacional Francia y TranspariMED.
Puede descargar el informe completo en ingles en: https://haiweb.org/wp-content/uploads/2021/07/TranspariMED-NCA-report_final_20210705.pdf
Nota de Salud y Fármacos: Falta por publicar los resultados de casi 6.000 estudios realizados en 14 países. La falta de información se concentra en unos pocos países, mientras que los problemas con la calidad de los datos están más generalizados. Los resultados se van publicando a medida que académicos y defensores de los pacientes presionan por la transparencia en los datos de los ensayos clínicos en EE UU y Europa. Los investigadores sostienen que, sin acceso a datos específicos, no se pueden replicar los resultados de los ensayos, lo que impide tener una mayor comprensión de cómo funcionan los medicamentos. Y argumentan que esto, a su vez, puede afectar negativamente las decisiones de tratamiento y los costos de la atención médica. Este ha sido un tema de particular controversia en EE UU. Un análisis reciente encontró que solo el 40% de los resultados de estudios se informaron a ClinicalTrials.gov dentro del plazo requerido de un año.