Sesgo en estudios publicados de costo efectividad: Revisión sistemática (Bias in published cost effectiveness studies: systematic review)
Bell CM et al, BMJ 2006;332:699-703.
Reproducido y traducido con permiso del BMJ Group
Traducido por Víctor Arellano
Resumen
Objetivo: Investigar si los estudios publicados tienden a informar tasas favorables de costo efectividad (inferiores a 20.000, 50.000 y 100.000 dólares por AVAC -año de vida ajustados por calidad de vida) y evaluar las características de los estudios asociadas con este fenómeno.
Diseño: Revisión sistemática.
Estudios revisados: 494 estudios de impacto de intervenciones sobre la salud, medido en AVAC, publicados en inglés antes de enero de 2002, y que se identificaron utilizando las bases de datos de Medline, HealthSTAR, CancerLit, Current Content y EconLit.
Medidas de impacto: Tasas crecientes de costo efectividad, en dólares del año en que se publicó el artículo.
Resultados: Aproximadamente la mitad de las tasas crecientes de costo efectividad (712 de 1433) eran menores de US$20.000 por AVAC. En los estudios financiados por la industria se observó una mayor propensión a informar tasas de costo eficiencia inferiores a US$20.000 por AVAC (razón de riesgo ajustada 2,1, intervalo de confianza 95%, 1,3 a 3,3), US$50.000 por AVAC (3,2, 1,8 a 5,7) y US$100.000 por AVAC (3,3, 1,6 a 6,8). En los estudios de mayor calidad metodológica (razón de riesgo ajustada 0,58, 0,37 a 0,91) y en aquellos realizados en Europa (0,59, 0,33 a 1,1) y en Estados Unidos (0,44, 0,26 a 0,76), comparado con los realizados en cualquier otro lugar, se observó una menor tendencia a informar tasas de costo-efectividad inferiores a US$20.000 por AVAC.
Conclusión: En la mayoría de los estudios publicados se informaron tasas favorables y crecientes de costo efectividad. Los que fueron financiados por la industria eran propensos a informar costos por AVAC inferiores en los tres umbrales. Los estudios de mayor calidad metodológica y los que se llevaron a cabo en Europa y Estados Unidos, comparados con los realizados en cualquier otro lugar, eran menos propensos a informar costos inferiores a US$20.000 por AVAC.
Introducción
El análisis de costo efectividad puede ayudar a quienes toman decisiones a determinar mejores formas de distribuir sus recursos [1-3]. Las compañías de seguros médicos utilizan datos de costo-efectividad para determinar el tipo de intervenciones que van a cubrir [1,4,5]. El AVAC (años de vida ajustados por calidad de vida) se utiliza para comparar la efectividad de gran cantidad de intervenciones. El análisis de costo efectividad genera una tasa – la tasa creciente de costo efectividad – expresada en dólares por AVAC. Esta tasa se utiliza para mostrar la diferencia en el costo efectividad entre una prueba diagnóstica o tratamiento nuevo versus los que son de uso habitual.
La interpretación de los resultados de un análisis de costo efectividad puede ser problemática, dificultando la decisión de adoptar o no una nueva prueba diagnóstica o tratamiento. Generalmente se proponen como umbrales valores entre US$20.000 (£11.300, €16.500) y US$100.000 por AVAC, con frecuencia US$50-60.000 por AVAC [6-9].
Independientemente de la buena voluntad de la sociedad de pagar el verdadero valor de AVAC, sería de esperar que los estudios sobre intervenciones en el sistema de salud proporcionasen una gran variedad de tasas crecientes de costo efectividad. Cuando las tasas que se publican se concentran alrededor de los umbrales propuestos, hay razones para sospechar que ha habido sesgo en el manejo e interpretación de la información, y las políticas basadas en esos valores pueden ser erradas.
A fin de describir la distribución de tasas crecientes de costo efectividad reportadas y las características de los estudios asociadas con tasas favorables, hicimos una revisión sistemática de aquellos estudios sobre salud que utilizaron el AVAC como medida de impacto. Nuestra hipótesis era que los autores tendían a informar tasas favorables y crecientes de costo efectividad, por ejemplo, inferiores a US$50.000 por AVAC.
Métodos
Realizamos una investigación sistemática de los estudios originales de costo efectividad publicados en inglés entre 1976 y 2001 que presentaron sus resultados en AVAC; para ello consultamos las bases de datos de Medline, Health- STAR, CancerLit, Current Contents Connect (todas las ediciones) y EconLit [10-13]. Los estudios de costo-efectividad reportan el impacto de una intervención en dólares por AVAC [1]. Usamos un procedimiento estándar de recolección de datos y dos revisores evaluaron cada estudio y resumieron la información en forma independiente. Las discrepancias se resolvieron por consenso. Los detalles sobre el regitro de estudios de costo-efectividad de Tufts-NEMC (que previamente había sido el registo de estudios de costo-efectividad de Escuela de Salud Pública de Harvard) están disponibles en el internet (tufts-nemc.org/cearegistry).
Para cada artículo documentamos el nombre de la revista, el año de publicación, la categoría de la enfermedad y el país donde se realizó el estudio. Utilizamos la base de datos de Índice de Citas de Ciencia (Science Citation Index) para asignar un factor de impacto a cada artículo utilizando el factor de impacto asignado a cada revista durante el año previo a la publicación. Clasificamos a los financiadores de los estudios como “industria” (si el manuscrito indicaba que habían recibido financiación parcial o completa de una compañía farmacéutica o de tecnología médica), “no industria” y “no especificada” (cuando se desconocía el origen de los fondos). Además, asignamos una puntuación de calidad a cada artículo utilizando una escala de 1 (baja) a 7 (alta), basándonos en la calidad de la metodología del estudio, en los supuestos presentados y en la presentación de los resultados [10].
Dado que los análisis de costo efectividad a menudo comparan programas diversos e incluyen diversos escenarios para subgrupos de pacientes, circunstancias o entornos distintos, cada estudio puede incluir más de una tasa de costo efectividad. Todas las tasas se convirtieron a dólares estadounidenses a la tasa de cambio vigente el año de publicación [14]. Como lo que queríamos evaluar era si las tasas de costo-efectividad reportadas se acercaban a los umbrales que la sociedad quería pagar, tal como US$50.000 por AVAC, decidimos no ajustar las tasas a dólares constantes.
Análisis estadísticos
En cada estudio analizamos la distribución de todas las tasas crecientes de costo efectividad, y la tasa más alta y la más baja. Excluimos nueve tasas en las cuales el costo creciente y el AVAC creciente eran negativos. Aunque tales intervenciones podrían ser económicamente viables, es de esperar que quienes toman decisiones no adopten las que tengan un efecto negativo sobre la salud [15].
De acuerdo con lo que recomiendan algunos autores [6,8,9], se utilizaron ecuaciones generales de estimación para evaluar las características de los estudios asociadas con tasas crecientes de costo efectividad inferiores a los valores umbrales de US$20.000, US$50.000 y US$100.000 Utilizamos dichas ecuaciones porque toman en cuenta las tasas de costo efectividad derivadas del mismo estudio [16]. Estimamos razones de riesgo relacionando características del estudio con tasas favorables de costo efectividad. Las razones de riesgo ajustadas se estimaron adecuando un modelo no- parsimonioso que incluyó variables que a priori pesamos que tenían valor predictivo.
En todos los análisis utilizamos la versión 8.2 del software SAS. Valores de p menores a 0,05 fueron considerados significativos.
Resultados
Analizamos más de 3.300 resúmenes de estudios e identificamos 533 análisis originales de costo utilidad. Se excluyeron 39 estudios que no informaron tasas crecientes de costo efectividad. En total, se informaron 1.433 tasas de costo efectividad en esos 494 estudios, con una mediana de 2,0 (rango intercuartil 1-3) y un rango de entre 1 y 20 tasas por estudio. Del total, 130 tasas crecientes de costo efectividad (9%) se reportaron como que ahorraban costos (reducían costos y mejoraban la salud simultáneamente); 124 (9%) que en relación a otras estrategias empeoraban el estado de salud y elevaban costos y 1.179 (82%) presentaban mayores costos que otras intervenciones pero mejoraban el estado de salud.
La mayor parte de los estudios se publicaron en la década de los 90s (Tabla 1). El factor de impacto de la revista en que se publicó cada estudio, correspondiente al año previo a la publicación del artículo, estaba disponible para 449 artículos (91%). Las intervenciones en enfermedades cardiovasculares e infecciosas fueron las más estudiadas. La mayoría de los estudios provenían de Estados Unidos. Cerca del 18% fueron financiados por la industria y casi la mitad por otras fuentes, mientras que en el 34% de los estudios no se pudo determinar el origen de los recursos.
En la Figura 1 se muestra la distribución de frecuencia de las 1433 tasas crecientes de costo efectividad. La tasa mediana (rango intercuartil) por AVAC fue de US$20.133 (US$4.520-74.400). Aproximadamente la mitad de las tasas (712; 50%) eran inferiores a US$20.000 por AVAC, dos tercios (974; 68%) inferiores a US$50.000 por AVAC y más de tres cuartas partes (1129; 79%) inferiores a US$100.000 por AVAC. Un análisis del patrocinio de los estudios revela que el rango de tasas medianas por AVAC fue de US$13.083 (US$3.600-33.000) en los estudios financiados por la industria y de US$27.400 (US$4.600-96.600) en los que recibieron otra fuente de financiamiento. El rango de la tasas de costo efectividad mediana por AVAC en los estudios con patrocinio desconocido fue de US$18.900 (US$4.960-64.300). Limitando el análisis a las tasas menores y más elevadas informadas en cada estudio se observan tasas medianas de US$8.784 por AVAC y US$31.104 por AVAC (Figura 2).
Se pudieron identificar varias características de los estudios que se asociaron con la obtención de tasas de costo efectividad inferiores en uno o en los tres umbrales (Tabla 2). Las revistas más citadas, con un factor de impacto superior a 4, eran más propensas a informar tasas menores a US$20.000 por AVAC – (razón de riesgo 0,60, intervalo de confianza 95%, 0,42 a 0,86) o US$50.000 por AVAC (0,56, 0,38 a 0,82) que las publicaciones con un factor de impacto menor. Sin embargo, estos hallazgos no fueron significativos al incluirlos en un modelo multifactorial (Tabla 2).
En los estudios financiados por la industria había una mayor propensión a informar tasas de costo efectividad menores a US$20.000 por AVAC (razón de riesgo ajustada 2,1, 1,3 a 3,3), US$50.000 por AVAC (3,2, 1,8 a 5,7) o US$100.000 por AVAC (3,3, 1,6 a 6,8) que en aquellos financiados con recursos de la no industria (Tabla 2). En los estudios llevados a cabo en Estados Unidos y Europa había una marcada menor tendencia a informar tasas favorables y crecientes de costo efectividad que en los realizados en otro lugar; a su vez, en aquellos con puntuaciones por calidad metodológica superior a 5,5 se observó una tendencia mucho menor a informar tasas inferiores a US$20.000 por AVAC (0,48, 0,33 a 0,70) y US$50.000 por AVAC (0,57, 0,39 a 0,83). Dentro del modelo multifactorial, la asociación con la calidad continuó siendo significativa sólo para tasas de costo efectividad menores que US$20.000 por AVAC (razón de riesgo ajustada 0,58, 0,37 a 0,91; Tabla 2).
Discusión
En aproximadamente la mitad de todos los estudios de costo efectividad publicados en los 25 años se informaron tasas altamente favorables y crecientes de costo efectividad de menos de US$20.000 por AVAC. Más de la mitad de las tasas más altas informadas en cada estudio fue menor que US$50.000 por AVAC. En un análisis multifactorial, el lugar donde se realizó el estudio, la calidad metodológica y el patrocinio se relacionaron con tasas favorables de costo efectividad. En los estudios patrocinados por la industria había más del doble de propensión a informar tasas inferiores a US$20.000 por AVAC y más del triple de propensión a informar tasas menores que US$50.000 o US$100.000 por AVAC que en los que no fueron financiados por la industria. Además, los estudios patrocinados por la industria solían ser de peor calidad y tenían más probabilidades de publicarse en revistas con menor factor de impacto.
En pocos estudios se describió la distribución de las tasas crecientes de costo efectividad [12,17]. A pesar de haber revisado muchos trabajos, nos limitamos a analizar aquellos que midieron resultados sobre la salud en AVAC. Aunque este procedimiento continúa siendo controvertido, ha sido aprobado por la autoridades y potencialmente permite realizar un análisis de costo efectividad para evaluar tanto la eficiencia en la distribución de recursos como la eficiencia técnica [1,18,19]. Sería interesante determinar si el uso de mediciones alternativas de resultados sobre la salud resulta en tasas más o menos favorables de costo efectividad. Una limitación de nuestra evaluación es que algunos análisis de costo efectividad utilizados en toma de decisiones pueden no haber sido publicados [5]. Sin embargo, un análisis de evaluación de costo efectividad presentado en el Instituto Nacional para la Salud y la Excelencia Clínica, NICE (National Institute for Health and Clinical Excellence) en el Reino Unido encontró que las tasas de costo efectividad presentadas por los fabricantes eran significativamente inferiores a los análisis de tecnologías idénticas realizados por asesores de centros académicos [20].
Sesgo de publicación
Encontramos relativamente pocas tasas crecientes de costo efectividad entre US$50.000 y US$100.000 por AVAC, muchas inferiores a US$20.000 por AVAC y algunas superiores a US$100.000 por AVAC. Esto indica que en los análisis de costo efectividad se tiende a informar resultados “positivos” o “negativos” pero no intermedios. Existen tres posibles explicaciones para estos hallazgos. Primero, es posible que estos resultados reflejen la distribución real de las tasas de costo efectividad. Tal vez las intervenciones que los fabricantes consideran poco atractivas desde el punto de vista económico no llegan a comercializarse [21]. En segundo lugar, puede ser que los analistas no se interesen en estudiar intervenciones con tasas de costo efectividad de rango medio o que algunas revistas no deseen publicar tales estudios. Por último, es posible que algunos análisis de costo efectividad se manipulen para presentar tasas favorables o que se descarten aquellos estudios con tasas desfavorables. Estos hallazgos no nos aclaran si los autores (y sus patrocinadores) se equivocan en informar resultados de costo efectividad indeseables mientras comunican los de resultados positivos. No está claro si el sesgo en la publicación ocurre a nivel conciente o inconciente. En cualquier caso, nuestros resultados sustentan la preocupación sobre la existencia de un importante y persistente sesgo, tanto en la gestión como en la información de los análisis de costo efectividad [22,23]. Se podría deducir que todos los análisis de costo efectividad deberían ser registrados antes de iniciarlos, como se da en el caso de los ensayos clínicos, aunque esto puede ser poco práctico dada la forma como se llevan a cabo [24].
Si una buena parte de nuestros hallazgos se deben a la presencia de sesgo, nuestros resultados indican que la tasa de costo efectividad que debe tener una intervención para que sea aceptable para los sistemas de salud se sitúa entre US$20.000 y US$50.000 por AVAC. Se desconoce lo que la sociedad está realmente dispuesta a pagar un AVAC extra de vida, aunque algunos han intentado inferirla de principios económicos o deducirla de decisiones políticas [25-27]. En Estados Unidos, el umbral habitualmente más usado es US$50.000 por AVAC, este se basa en que Medicare cubre la diálisis, pero el método para seleccionar este valor ha sido cuestionado [8,26]. Además, se pueden adoptar intervenciones con tasas desfavorables, sobre todo si se tienen en cuenta otros criterios como la carga de la enfermedad y la equidad en salud [25].
Algunos intentos recientes de estandarizar la generación e información de análisis económicos y modelar los estudios pueden ayudar a prevenir la manipulación de los mismos [1,18,28-30]. Tales lineamientos ofrecen a los que realizan análisis de costo efectividad, a los revisores, lectores y editores de revistas un sistema que les permite evaluar análisis, aunque la complejidad de los modelos y el sesgo en las publicaciones continúan siendo asuntos importantes [5,8,22]. La publicación electrónica podría mejorar la transparencia en el modelado porque permitiría incluir suplementos técnicos y mejorar la presentación de resultados [3,23]. Además, se deben considerar formas de que el público pueda acceder a los modelos que se utilizan para tomar decisiones.
El patrocinio de la industria y el lugar donde se realiza el estudio no explican completamente que las tasas crecientes de costo efectividad tiendan a caer por debajo de umbrales deseables. Menos del 20% de los estudios revisados fueron financiados por la industria, y en otros 33% no se especificó el origen de los fondos. Por otra parte, la tasa mediana de los estudios no patrocinados por la industria fue muy inferior al umbral de US$50.000 por AVAC. Las bajas tasas encontradas en los trabajos realizados en Estados Unidos no pueden ser totalmente explicadas por las tasas de cambio ni la inflación, ya que los resultados en ese país fueron similares a los encontrados en Europa. Otro factor que se deberá considerar en futuras investigaciones es la calidad metodológica de los estudios.
Los editores de revistas y los revisores pueden ayudar a reducir el sesgo en las publicaciones [23,31-33]. Los potenciales conflictos de interés entre patrocinadores y autores tienen que ser evaluados [23,34-36]. Una manera sería limitar la publicación de análisis de costo efectividad financiados por la industria aunque solo uno de los autores tenga vínculos financieros directos con la compañía patrocinadora, posición que adoptó la Revista de Medicina de Nueva Inglaterra (New England Journal of Medicine) en 1994 [37]. Los editores pueden indicar sesgo en la publicación de estudios con resultados positivos, pero no en los que exponen resultados negativos, aunque esta práctica no es común [33,38-41]. En un estudio se plantea que las diferencias entre los análisis económicos no pueden explicarse solamente por una presentación selectiva o sesgo en la selección editorial, sino que probablemente reflejan otras diferencias más importantes en los estudios [42].
|
¿Qué se conoce actualmente sobre este tema? El análisis de costo efectividad es ampliamente utilizado por quienes formulan políticas sobre salud para decidir en forma más eficiente el destino de los recursos Se han propuesto diversos umbrales para las tasas de costo efectividad, pero no se ha investigado la distribución de las tasas publicadas con respecto a esos umbrales |
|
¿Qué nos añade este estudio? Dos tercios de las tasas de costo efectividad publicadas fueron inferiores a US$50.000 por año de vida ajustado por calidad de vida (AVAC) y sólo 21% era superior a US$100.000 por AVAC Los análisis de costo efectividad publicados tienen un uso limitado para identificar las intervenciones en salud que no cumplen con los estándares comunes de “costo efectividad” |
Conclusiones
Para que los responsables de la toma de decisiones y la población puedan confiar en que los análisis de costo efectividad fueron realizados y publicados en una manera imparcial, es necesaria una mayor precisión y franqueza en la evaluación de los aspectos económicos asociados a la salud. Estas consideraciones son un prerrequisito para que en esos análisis se puedan comparar estrategias de gestión en salud. El conocimiento profundo de las limitaciones de los análisis de costo efectividad y los potenciales factores influyentes puede ayudar a los usuarios a interpretar mejor las conclusiones de los estudios.
Este documento fue presentado en una forma resumida en el Quinto Congreso Internacional sobre Publicación Biomédica y Proceso de Revisión por Pares (Fifth Internacional Congress on Peer Review and Biomedical Publication) en Chicago, IL [16-18], en septiembre de 2005.
Colaboradores: Todos los autores contribuyeron a la concepción y diseño del proyecto, revisaron críticamente el artículo y aprobaron la versión final. CMB, DRU, JGR y AB analizaron e interpretaron los datos y ayudaron a bosquejar el artículo. CMB tuvo acceso a todos los datos y era responsable de la integridad de los mismos y de la precisión de su análisis. CMB y PJN son garantes.
Financiación: Agencia para la Investigación de Servicios de Salud y Calidad (AHRQ) (Agency for Health Care Research y Quality) (RO1 HS10919).
CMB y JGR ganaron un premio al investigador clínico por un estudio en fase 2 y un premio al investigador novel, ambos otorgados por Canadian Institutes of Health Research.
DRU obtuvo un premio al científico de carrera otorgado por el Ministerio de Salud de Ontario.
Conflictos de intereses: no declarados.
Referencias
1. Gold MR, Siegel JE, Russell LB, Weinstein MC. Cost-effectiveness in health and medicine. New York: Oxford University Press, 1996.
2. Granata AV, Hillman AL. Competing practice guidelines: using cost-effectiveness analysis to make optimal decisions.Ann Intern Med 1998;128:56-63.
3. Pignone M, Saha S, Hoerger T, Lohr KN, Teutsch S, Mandelblatt J. Challenges in systematic reviews of economic analyses.Ann Intern Med 2005;142:1073-9.
4. Laupacis A. Incorporating economic evaluations into decision-making: the Ontario experience. Med Care 2005;43(suppl 7):15-9.
5. Hill SR, Mitchell AS, Henry DA. Problems with the interpretation of pharmacoeconomic analyses: a review of submissions to the Australian pharmaceutical benefits scheme. JAMA 2000;283:2116-21.
6. Laupacis A, Feeny D, Detsky AS, Tugwell PX. How attractive does a new technology have to be to warrant adoption and utilization? Tentative guidelines for using clinical and economic evaluations. CMAJ 1992;146:473-81.
7. Owens DK. Interpretation of cost-effectiveness analyses. J Gen Intern Med 1998;13:716-7.
8. Evans C, Tavakoli M, Crawford B. Use of quality adjusted life years and life years gained as benchmarks in economic evaluations: a critical appraisal. Health Care Manage Sci 2004;7:43-9.
9. Eichler HG, Kong SX, Gerth WC, Mavros P, Jonsson B. Use of cost-effectiveness analysis in health-care resource allocation decision-making: how are cost-effectiveness thresholds expected to emerge? Value Health 2004;7:518-28.
10. Neumann PJ, Stone PW, Chapman RH, Sandberg EA, Bell CM. The quality of reporting in published cost-utility analyses, 1976-1997.Ann Intern Med 2000;132:964-72.
11. Neumann PJ, Greenberg D, Olchanski NV, Stone PW, Rosen AB. Growth and quality of the cost utility literature, 1976-2001. Value Health 2005;8:3-9.
12. Chapman RH, Stone PW, Sandberg EA, Bell C, Neumann PJ. A comprehensive league table of cost-utility ratios and a sub-table of “panel-worthy” studies. Med Decis Making 2000;20:451-67.
13. Greenberg D, Rosen AB, Olchanski NV, Stone PW, Nadai J, Neumann PJ. Delays publication of cost utility analyses conducted alongside clinical trials: registry analysis. BMJ 2004;328:1536-7.
14. Monthly exchange rates series. Federal Reserve Bank of St Louis. http://research.stlouisfed.org/fred2/categories/15 (accessed 9 Feb 2006).
15. O’Brien BJ, Gertsen K, Willan AR, Faulkner LA. Is there a kink in consumers’ threshold value for cost-effectiveness in health care? Health Econ 2002;11:175-80.
16. Zeger SL, Liang KY, Albert PS. Models for longitudinal data: a generalized estimating equation approach. Biometrics 1988;44:1049-60.
17. Tengs TO, Adams ME, Pliskin JS, Safran DG, Siegel JE, Weinstein MC, et al. Five-hundred life-saving interventions and their cost-effectiveness. Risk Anal 1995;15:369-90.
18. Canadian Coordinating Office for Health Technology Assessment. Common drug review submission guidelines. Ottawa: Canadian Coordinating Office for Health Technology Assessment (CCOHTA), 2005. ww.ccohta.ca/CDR/cdr_pdf/cdr_submiss_guide.pdf (accessed 9 Feb 2006).
19. Oliver A, Healey A, Donaldson C. Choosing the method to match the perspective: economic assessment and its implications for health-services efficiency. Lancet 2002;359:1771-4.
20. 20 Miners AH, Garau M, Fidan D, Fischer AJ. Comparing estimates of cost effectiveness submitted to the National Institute for Clinical Excellence (NICE) by different organisations: retrospective study. BMJ 2005;330:65.
21. Neumann PJ, Sandberg EA, Bell CM, Stone PW, Chapman RH. Are pharmaceuticals cost-effective? A review of the evidence. Health Aff (Millwood) 2000;19:92-109.
22. Freemantle N, Mason J. Publication bias in clinical trials and economic analyses. Pharmacoeconomics 1997;12:10-6.
23. Hillman AL, Eisenberg JM, Pauly MV, Bloom BS, Glick H, Kinosian B, et al. Avoiding bias in the conduct and reporting of cost-effectiveness research sponsored by pharmaceutical companies. N Engl J Med 1991;324:1362-5.
24. Rennie D. Peer review in Prague. JAMA 1998;280:214-5.
25. Devlin N, Parkin D. Does NICE have a cost-effectiveness threshold and what other factors influence its decisions? A binary choice analysis. Health Econ 2004;13:437-52.
26. Hirth RA, Chernew ME, Miller E, Fendrick AM,Weissert WG. Willingness to pay for quality-adjusted life year: in search of a standard. Med Decis Making 2000;20:332-42.
27. Garber AM, Phelps CE. Economic foundations of cost-effectiveness analysis. J Health Econ 1997;16:1-31.
28. Sculpher M, Fenwick E, Claxton K. Assessing quality in decision analytic cost-effectiveness models. A suggested framework and example of application. Pharmacoeconomics 2000;17:461-77.
29. Philips Z, Ginnelly L, Sculpher M, Claxton K, Golder S, Riemsma R, et al. Review of guidelines for good practice in decision-analytic modelling in health technology assessment. Health Technol Assess 2004;8:1-172.
30. Weinstein MC, O’Brien B, Hornberger J, Jackson J, Johannesson M, McCabe C, et al. Principles of good practice for decision analytic modeling in health-care evaluation: report of the ISPOR task force on good research practices-modeling studies. Value Health 2003;6:9-17.
31. Sharp DW. What can and should be done to reduce publication bias? The perspective of an editor. JAMA 1990;263:1390-1.
32. Chalmers TC, Frank CS, Reitman D. Minimizing the three stages of publication bias. JAMA 1990;263:1392-5.
33. Dickersin K. The existence of publication bias and risk factors for its occurrence. JAMA 1990;263:1385-9.
34. Haivas I, Schroter S,Waechter F, Smith R. Editors’ declaration of their own conflicts of interest. Can Med Assoc J 2004;171:475-6.
35. Lexchin J, Bero LA, Djulbegovic B, Clark O. Pharmaceutical industry sponsorship and research outcome and quality: systematic review. BMJ 2003;326:1167-70.
36. Friedberg M, Saffran B, Stinson TJ, Nelson W, Bennett CL. Evaluation of conflict of interest in economic analyses of new drugs used in oncology. JAMA 1999;282:1453-7.
37. Kassirer JP, Angell M. The journal’s policy on cost-effectiveness analyses. N Engl J Med 1994;331:669-70.
38. Ray JG. Judging the judges: the role of journal editors. QJM 2002;95:769-74.
39. Murray MD, Birt JA, Manatunga AK, Darnell JC. Medication compliance in elderly outpatients using twice-daily dosing and unit-of-use packaging. Ann Pharmacother 1993;27(5):616-21.
40. Dickersin K, Chan S, Chalmers TC, Sacks HS, Smith H, Jr. Publication bias and clinical trials. Control Clin Trials 1987;8:343-53.
41. Olson CM, Rennie D, Cook D, Dickersin K, Flanagin A, Hogan JW, et al. Publication bias in editorial decision making. JAMA 2002;287:2825-8.
42. Baker CB, Johnsrud MT, Crismon ML, Rosenheck RA,Woods SW. Quantitative analysis of sponsorship bias in economic studies of antidepressants. Br J Psychiatry 2003;183:498-506.
Figura 1. Distribución de frecuencia de 1433 tasas crecientes de costo efectividad en intervenciones en salud
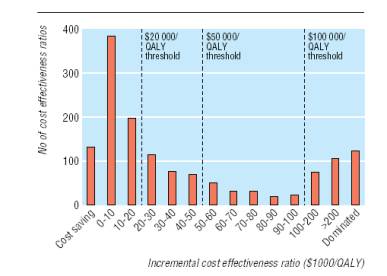
Figura 2 Distribución de frecuencia de las menores (marrón) y mayores (blanco) tasas crecientes de costo efectividad en cada estudio
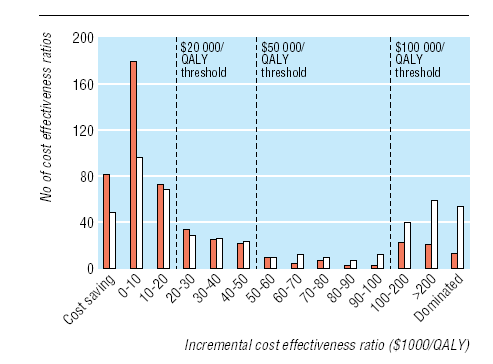
Tabla 1. Características de 494 análisis de costo utilidad de intervenciones publicadas
entre 1976 y 2001
|
Característica del estudio |
Nº (%) |
|
Año de publicación |
|
|
1976-91 |
47 (9) |
|
1992-6 |
125 (25) |
|
1997-2001 |
322 (65) |
|
Factor de impacto de la revista (a) |
|
|
<2 |
157 (32) |
|
2-4 |
137 (28) |
|
>4 |
155 (31) |
|
No disponible |
45 (9) |
|
Categoría de la enfermedad |
|
|
Cardiovascular |
110 (22) |
|
Endocrina |
30 (6) |
|
Infecciosa |
94 (19) |
|
Músculo esquelética |
21 (4) |
|
Neoplásica |
76 (15) |
|
Neurológica o psiquiátrica |
43 (9) |
|
Otras |
120 (24) |
|
Patrocinio o fuente de recursos |
|
|
No industria |
240 (49) |
|
Industria (b) |
88 (18) |
|
No especificada |
166 (34) |
|
Región del estudio |
|
|
Europa |
118 (24) |
|
Estados Unidos |
306 (62) |
|
Otras (c) |
70 (14) |
|
Calidad metodológica (d) |
|
|
1,0-4,0 |
214 (43) |
|
4,5-5,0 |
159 (32) |
|
5,5-7,0 |
121 (25) |
|
a) Factor de impacto de una revista en el año anterior a la publicación del estudio. |
|
Tabla 2. Características de los estudios asociadas con tasas favorables y crecientes de costo efectividad de acuerdo con tres valores umbrales. Los valores son razones de riesgo (intervalos de confianza de 95%)
| Características del estudio | OR | OR ajustada (a) | ||||
| <US$20.000/ AVAC | <US$50.000/ AVAC | <US$100.000/ AVAC | <US$20.000/ AVAC | <US$50.000/ AVAC | <US$100.000/ AVAC | |
| Año de publicación | ||||||
| 1976-91 | 1,6 (0,98 to 2,7) | 1,4 (0,80 to 2,4) | 1,2 (0,67 to 2,3) | 1,6 (0,96 to 2,7) | 1,3 (0,76 to 2,3) | 1,2 (0,61 to 2,2) |
| 1992-6 | 1,3 (0,94 to 1,9) | 1,4 (0,93 to 2,3) | 1,1 (0,68 to 1,6) | 1,3 (0,87 to 1,8) | 1,3 (0,87 to 1,9) | 1,0 (0,64 to 1,6) |
| 1997-2001 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Factor de impacto de la revista (b) | ||||||
| <2 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| 2-4 | 0,62 (0,42 to 0,91) | 0,62 (0,41 to 0,94) | 0,59 (0,38 to 0,94) | 0,75 (0,50 to 1,1) | 0,82 (0,53 to 1,3) | 0,77 (0,47 to 1,2) |
| >4 | 0,60 (0,42 to 0,86) | 0,56 (0,38 to 0,82) | 0,83 (0,53 to 1,3) | 0,95 (0,63 to 1,4) | 0,81 (0,52 to 1,3) | 1,1 (0,66 to 1,9) |
| Categoría de la enfermedad | ||||||
| Cardiovascular | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Endocrina | 1,3 (0,68 to 2,6) | 1,2 (0,58 to 2,5) | 1,3 (0,58 to 3,0) | 1,2 (0,56 to 2,4) | 1,1 (0,52 to 2,3) | 1,2 (0,53 to 2,7) |
| Infecciosa | 1,1 (0,66 to 1,7) | 0,79 (0,48 to 1,3) | 0,74 (0,43 to 1,3) | 1,0 (0,64 to 1,7) | 0,75 (0,44 to 1,3) | 0,71 (0,39 to 1,3) |
| Músculo esquelética | 1,4 (0,60 to 3,3) | 1,3 (0,51 to 3,1) | 1,4 (0,50 to 3,7) | 1,1 (0,43 to 2,7) | 0,89 (0,34 to 2,3) | 1,1 (0,37 to 3,1) |
| Neoplásica | 0,91 (0,56 to 1,5) | 0,79 (0,46 to 1,3) | 0,77 (0,42 to 1,4) | 0,78 (0,47 to 1,3) | 0,64 (0,37 to 1,1) | 0,69 (0,36 to 1,3) |
| Neurológica/ psiquiátrica | 0,76 (0,40 to 1,5) | 0,78 (0,40 to 1,5)) | 0,66 (0,31 to 1,4) | 0,75 (0,39 to 1,4) | 0,70 (0,34 to 1,4) | 0,61 (0,27 to 1,4) |
| Otras | 1,2 (0,75 to 1,8) | 0,67 (0,42 to 1,1) | 0,52 (0,31 to 0,88) | 1,0 (0,63 to 1,6) | 0,53 (0,31 to 0,88) | 0,49 (0,27 to 0,86) |
| Fuente de recursos (c) | ||||||
| No industria | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Industria | 2,2 (1,4 to 3,4) | 3,5 (2,0 to 6,1) | 3,4 (1,6 to 7,0) | 2,1 (1,3 to 3,3) | 3,2 (1,8 to 5,7) | 3,3 (1,6 to 6,8) |
| No especificada | 1,3 (0,95 to 1,9) | 1,5 (1,1 to 2,2) | 1,4 (0,93 to 2,1) | 1,3 (0,89 to 1,8) | 1,5 (1,0 to 2,1) | 1,5 (0,97 to 2,2) |
| Región del estudio | ||||||
| Europa | 0,50 (0,28 to 0,89) | 0,43 (0,21 to 0,87) | 0,46 (0,21 to 1,0) | 0,59 (0,33 to 1,1) | 0,42 (0,21 to 0,86) | 0,43 (0,19 to 0,96) |
| Estados Unidos | 0,35 (0,21 to 0,57) | 0,29 (0,16 to 0,55) | 0,33 (0,16 to 0,66) | 0,44 (0,26 to 0,76) | 0,35 (0,18 to 0,67) | 0,33 (0,16 to 0,68) |
| Otras (d) | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| Calidad metodológica (e) | ||||||
| 1,0-4,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 | 1,0 |
| 4,5-5,0 | 0,92 (0,64 to 1,3) | 0,95 (0,64 to 1,4) | 0,96 (0,62 to 1,5) | 1,0 (0,70 to 1,5) | 1,1 (0,70 to 1,6) | 1,0 (0,63 to 1,6) |
| 5,5-7,0 | 0,48 (0,33 to 0,70) | 0,57 (0,39 to 0,83) | 0,82 (0,52 to 1,3) | 0,58 (0,37 to 0,91) | 0,72 (0,45 to 1,2) | 0,90 (0,51 to 1,6) |
| AVAC: años de vida ajustados por calidad a) Se controla por otras variables b) Factor de impacto en el año anterior a la publicación c) Fondos provenientes de una compañía farmacéutica o fabricante de tecnología médica d) Canadá 41 (59%), Australia 18 (26%), Japón 2 (3%), Nueva Zelanda 2 (3%), África del Sur 2 (3%), otros 5 (7%) e) Principal puntuación de dos revisores |
||||||