Valoraciones que hizo Prescrire de medicamentos nuevos durante 2024: una breve revisión
(Prescrire’s ratings of new drugs in 2024: a brief review)
Prescrire International 2025; 34 (269): 102-104
Traducido por Salud y Fármacos, publicado en Boletín Fármacos: Prescripción, Farmacia y Utilización 2025; 28 (3)
Tags: avance terapéutico de nuevos fármacos, indicaciones nuevas con pocos beneficios, nuevos permisos de comercialización más peligrosos que beneficiosos, nuevos fármacos no ofrecen ventajas sobre otros tratamientos existentes
Todos los meses, Prescrire publica revisiones sistemáticas independientes de adelantos recientes en el mercado farmacéutico europeo, incluyendo los permisos de comercialización otorgados a nuevos principios activos, nuevas indicaciones, nuevas formas farmacéuticas, etc.
Nuestro objetivo es ayudar a nuestros suscriptores a identificar aquellos que mejoren el cuidado del paciente. También estamos atentos a las reevaluaciones del balance riesgo-beneficio de medicamentos que ya están en el mercado, a las novedades en cuanto a sus efectos adversos, a la escasez de medicamentos y a los retiros del mercado.
En general, menos avances terapéuticos reales que en años anteriores.
Durante 2024 Prescrire evaluó 122 permisos de comercialización nuevos, solo 30 de estos añadieron algún beneficio a los que aportan los tratamientos existentes. De los 30, uno (el 0,8% de todos los permisos de comercialización nuevos que evaluamos en nuestra edición en francés durante 2024), representó un avance terapéutico importante (que valoramos como “bravo”): el fexinidazol (Fexinidazol Winthrop) para la enfermedad del sueño causada por el Trypanosoma brucei rhodesiense. Otros seis (el 5% de nuestras evaluaciones), representaron un avance notable (que valoramos como “ofrece una ventaja”) y los otros 23 (el 19%), representaron un avance mínimo (que valoramos como “puede ser de ayuda”).
El número de indicaciones o productos nuevos que representaron al menos un avance notable (que evaluamos como “ofrece una ventaja”) estuvo por debajo del promedio que observamos durante los nueve años anteriores.
Casi la mitad de los nuevos permisos de comercialización que analizamos en 2024 (60, o el 49%) no ofrecía ventajas sobre otros tratamientos existentes (los valoramos como “nada nuevo”).
En 14 casos (el 11%), los datos no eran concluyentes (los valoramos como “se reserva la valoración”) y 18 permisos de comercialización nuevos (el 15%) se consideraron más peligrosos que beneficiosos para el problema clínico en cuestión (los valoramos como “no es aceptable”), una proporción más alta que la observada en los últimos años.
Algunos avances prácticos para los niños.
Dos novedades representaron un claro avance práctico para los niños:
Otros avances ofrecieron una pequeña ventaja práctica, en particular los comprimidos bucodispersables con 5mg de dolutegravir + 60 mg de abacavir + 30 mg de lamivudina (Triumeq) para los niños infectados por VIH que pesan entre 14 y 25kg, lo que elimina la necesidad de usar dos o hasta tres productos diferentes. También, las cápsulas duras con 100 mg de trientina (Cufence), que son útiles para ajustar las dosis diarias de algunos pacientes con enfermedad de Wilson.
Inhibidores de la Janus quinasa: por lo general, es mejor evitarlos para tratar las enfermedades inflamatorias crónicas.
La eficacia de los cuatro inhibidores de la Janus quinasa para tratar las enfermedades inflamatorias crónicas que evaluamos este año fue muy deficiente o no estuvo bien demostrada para justificar la exposición de los pacientes a sus efectos adversos cardiovasculares (incluyendo trombosis venosa y arterial) y a un aumento del riesgo de infecciones graves y de cáncer.
Los medicamentos y las enfermedades en cuestión son los siguientes:
el baricitinib y el ritlecitinib para la alopecia areata;
el upadacitinib para la enfermedad de Crohn y para la espondiloartritis axial “no radiográfica” y
el tofacitinib para la espondilitis anquilosante (espondiloartritis axial “radiográfica”).
Permisos de comercialización condicionales: las empresas presionan a la EMA.
En 2024 la EMA publicó conclusiones justificadamente desfavorables sobre la renovación de tres permisos de comercialización condicionales. Este tipo de permiso de comercialización se otorga en base a datos incompletos para cubrir una “necesidad médica insatisfecha” mientras se espera obtener datos adicionales, a menudo sobre la eficacia del medicamento.
En los tres casos, la presunta eficacia del medicamento no se confirmó con los datos obtenidos desde su entrada al mercado. Los medicamentos fueron los siguientes:
el atalureno (Translarna) para la distrofia muscular de Duchenne;
el belantamab mafodotina (Blenrep) para el mieloma múltiple, que se retiró del mercado a comienzos de 2024 y el ácido obeticólico (Ocaliva) para la colangitis biliar primaria [1-3].
En el caso del atalureno, la Comisión Europea no revocó el permiso de comercialización del medicamento y tomó la peculiar decisión de solicitar que la EMA reanalizara los datos. La EMA reafirmó su decisión tanto a mediados de 2024 como en octubre de 2024, tras otra solicitud de la farmacéutica en cuestión. El 3 de marzo de 2025 la Comisión Europea aún no había publicado su decisión definitiva [2].
En cuanto al ácido obeticólico, la Comisión Europea revocó su permiso condicional de comercialización, pero el Tribunal de Justicia Europeo suspendió temporalmente la decisión en septiembre de 2024: la farmacéutica sostuvo que la EMA no había tomado en cuenta “su abundante evidencia positiva según los datos de la práctica clínica (real world)” [3].
Finalmente, la revocación de este permiso de comercialización se confirmó en diciembre de 2024 [4]. El ácido obeticólico ha estado en la lista de medicamentos a evitar de Prescrire desde el 2019 ya que suele exacerbar los síntomas principales de la enfermedad (prurito y fatiga), y es posible que provoque efectos adversos hepáticos graves que en ocasiones son mortales [5].
Un cuarto caso es el permiso condicional de comercialización del pralsetinib (que antes se comercializaba bajo la marca comercial Gavreto), que se revocó a finales de 2024 a pedido de la farmacéutica, tras observarse un aumento de la incidencia de infecciones graves en un ensayo clínico (que se publicará en un número próximo).
El permiso de comercialización de un quinto medicamento, el darvadstrocel (que antes se comercializaba como Alofisel), que autorizaron precipitadamente para tratar las fístulas perianales, se revocó a finales de 2024 a pedido de la farmacéutica, debido a los resultados de un segundo ensayo clínico [6].
|
VALORACIÓN DE PRESCRIRE |
2015 |
2016 |
2017 |
2018 |
2019 |
2020 |
2021 |
2022 |
2023 |
2024 |
TOTAL |
|
BRAVO |
0 |
0 |
0 |
0 |
0 |
1 |
0 |
0 |
0 |
1 |
2 (0,19) |
|
UN AVANCE REAL |
3 |
1 |
1 |
2 |
1 |
2 |
3 |
0 |
0 |
0 |
13 (1,22) |
|
OFRECE UNA VENTAJA |
5 |
5 |
9 |
11 |
10 |
6 |
14 |
11 |
10 |
6 |
87 (8,19) |
|
PUEDE SER DE AYUDA |
15 |
9 |
18 |
22 |
13 |
18 |
19 |
23 |
20 |
23 |
180 (16,95) |
|
NADA NUEVO |
43 |
56 |
45 |
50 |
61 |
55 |
51 |
63 |
73 |
60 |
557 (52,45) |
|
SE RESERVA LA VALORACIÓN |
6 |
5 |
4 |
5 |
9 |
17 |
12 |
13 |
10 |
14 |
95 (8,95) |
|
NO ES ACEPTABLE |
15 |
16 |
15 |
9 |
14 |
10 |
9 |
14 |
8 |
18 |
128 (12,05) |
|
TOTAL |
87 |
92 |
92 |
99 |
108 |
109 |
108 |
124 |
121 |
122 |
1.062 (100) |
BRAVO
OFRECE UNA VENTAJA
PUEDE SER DE AYUDA
NO ES ACEPTABLE
Proporción de autorizaciones en 2024 que mejoraron el cuidado del paciente, en comparación con los nueve años anteriores
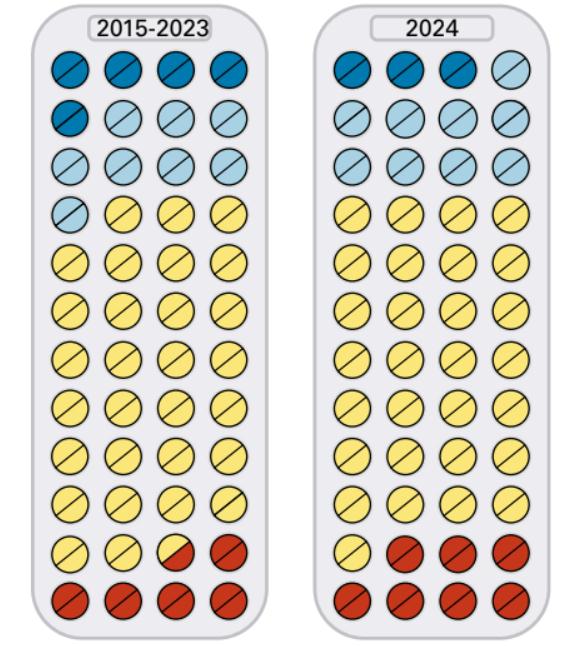
 Avance notable
Avance notable Avance mínimo
Avance mínimo Sin ventajas probadas
Sin ventajas probadas Más peligroso que beneficioso
Más peligroso que beneficiosoMedicamentos que son más peligrosos que beneficiosos: uno menos en el mercado y ¿se retirará otro?
El permiso de comercialización europeo del ulipristal de 5 mg (Esmya), que se usa para tratar algunos casos de miomas uterinos, se revocó finalmente a mediados de 2024, a pedido de la farmacéutica. Los datos de la eficacia del uso continuo del ulipristal para este problema clínico no fueron concluyentes. Sin embargo, este producto expone a las pacientes a un riesgo de lesión hepática mortal.
El 30 de diciembre de 2024, aún se estaba realizando una revisión del balance riesgo-beneficio de Mysimba [la combinación de bupropión + naltrexona], solicitada por la Comisión Europea. La farmacéutica no cumplió su obligación de ejecutar un ensayo clínico post autorización para evaluar los efectos adversos cardiovasculares a largo plazo de esta combinación, autorizada para la pérdida de peso.
Este producto tiene efectos adversos cardiovasculares y neuropsiquiátricos desproporcionados, dada su eficacia limitada. Ya era hora de que se lo retirara del mercado. Los dos fármacos de esta combinación han estado en la lista de medicamentos a evitar de Prescrire durante años [5].
En resumen
Además de un avance terapéutico importante y algunos avances prácticos para niños, el 2024 no fue un buen año. Aproximadamente un séptimo de los permisos de comercialización nuevos que evaluamos eran opciones peores para los pacientes que las que ya existían, lo que es alarmante, sobre todo debido a que las revocaciones y las retiradas son escasas y casi siempre lentas.
Comentario de Salud y Fármacos
Tras una década de evaluaciones rigurosas, sistemáticas y metodológicamente sólidas sobre los permisos de comercialización de nuevos fármacos, Prescrire International publicó los resultados de la valoración acumulada cuyos resultados constituyen una seria alerta para las políticas farmacéuticas, la elaboración de formularios, la farmacovigilancia y la salud pública.
Los datos que resume el Cuadro 1 muestran que más del 52% (n=557) de los medicamentos aprobados en la última década no aportan beneficios clínicos adicionales a las terapias existentes para las mismas indicaciones, lo que cuestiona la pertinencia de su incorporación en los sistemas sanitarios, especialmente en entornos de recursos limitados, porque agrava la presión financiera.
Más grave aún es que la evidencia acumulada muestra que el 12% (n=128) de los nuevos fármacos aprobados que fueron evaluados, conllevan más riesgos que beneficios para los pacientes, configurándose como una falla crítica y reiterada de los mecanismos que deberían velar por proteger los derechos fundamentales a la salud y la vida; y representa una asignación de recursos mal direccionada e ineficiente.
La aprobación y comercialización de medicamentos con escaso o nulo valor terapéutico o peor aún, con perfiles de riesgo desfavorables, compromete la seguridad de la población y la expone a la incertidumbre de eventos adversos graves (que incluyen la muerte) y desvía recursos que podrían destinarse a intervenciones seguras y costo-efectivas que respondan a los problemas prioritarios de las comunidades.
Esta contundente evidencia acumulada por Prescrire (Ver cuadro 1), tras una década de aplicar rigor científico y metodológico a la evaluación de los nuevos fármacos aprobados por las agencias reguladoras , demuestra también que menos del 10% de los medicamentos evaluados ofrecen una ventaja o un avance real y menos del 17% de los medicamentos evaluados podrían ser de ayuda, lo que debería movilizar las voluntades políticas y a los interesados en políticas farmacéuticas, a exigir medidas más estrictas y libres de conflictos de intereses en los procesos de aprobación y regulación de nuevas tecnologías en salud (que en gran parte se pagan con recursos públicos).
Actuar con determinación y contundencia implica fortalecer la independencia de las agencias regulatorias, exigir comparaciones clínicas directas con tratamientos estándar, priorizar el beneficio a los pacientes y la transparencia en los procesos de aprobación, y fortalecer los sistemas de farmacovigilancia post comercialización. Un buen sistema de farmacovigilancia permitiría detectar y retirar de manera oportuna los fármacos con evidentes perfiles perjudiciales para la salud, y aplicar las sanciones y reparaciones a los afectados.
Además del fracaso regulatorio, que genera ineficiencias en el uso de recursos y daños evitables en la población, lo descrito por Prescrire cuestiona la eficacia del modelo vigente de I+D, pues los medicamentos verdaderamente innovadores y útiles que se desarrollan son pocos, mientras muchos pacientes siguen sin contar con terapias para abordar sus problemas de salud.
Referencias
Productos fraudulentos Sugar Control y Meta Fit podrían afectar órganos vitales y provocar efectos adversos severos
Portal WEB Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA)
Bogotá, 31 de julio del 2025
https://www.invima.gov.co/sala-de-prensa/productos-fraudulentos-sugar-control-y-meta-fit-podrian-afectar-organos-vitales-y
Tags: Alerta INVIMA por productos fraudulentos Sugar Control y Meta Fit, efectos adversos severos por consumo de sumplementos Sugar Control y Meta Fit, afectación de órganos vitales relacionado con consumo de productos fraudulentos Sugar Control y Meta Fit
COMUNICADO.
El Instituto Nacional de Vigilancia de Medicamentos y Alimentos – Invima, alerta a la ciudadanía sobre la comercialización ilegal de los productos Sugar Control y Meta Fit, que se están promocionando como suplementos dietarios sin contar con el respectivo registro sanitario. La venta de estos productos en Colombia es ilegal y representa un riesgo inminente para la salud de quienes los consumen.
Tras denuncias ciudadanas y procesos de verificación, el Invima confirmó que Sugar Control y Meta Fit no están amparados por registro sanitario alguno y, por tanto, no garantizan condiciones mínimas de calidad, seguridad y eficacia. Adicionalmente, presentan un etiquetado fraudulento y hacen uso de publicidad engañosa.
“Estos productos no cuentan con controles sobre su composición o trazabilidad, lo cual puede generar efectos adversos graves, desde trastornos cardiovascular hasta daños en órganos vitales”, explicó William Saza, coordinador de Farmacovigilancia del Invima, en relación con los riesgos asociados al consumo de los productos fraudulentos.
Entre los efectos adversos asociados se encuentran la elevación de la presión sanguínea, palpitaciones y posibles trastornos cardíacos, así como síntomas neurológicos como nerviosismo, ansiedad, temblores, insomnio y pesadillas. Además, su uso puede ocasionar retención de líquidos, edemas y daños potenciales en órganos vitales como el corazón, los riñones y el hígado.
Recomendaciones para la comunidad
Indicaciones para profesionales de la salud
Para establecimientos y autoridades sanitarias