ADVIERTEN
Investigaciones
El estado de los sistemas de farmacovigilancia (The State of Drug Safety Systems)
Brian Overstreet
RxView Adverse Effects, 17 de julio de 2015
http://rxview.adverseevents.com/the-state-of-drug-safety-systems?utm_source=hs_email&utm_medium=email&utm_content=20828189&_hsenc=p2ANqtz-8yAN-xqCHb3oCMs9ohVOd6_lTwMAPn9a3WeBppwCCCl0MfB-_HUmdlSy63pXjpyjgG9PajZfcFBznop4OrmOlxRrycrg&_hsmi=20828189
Traducido por salud y Fármacos
Durante las últimas semanas he escrito mucho acerca de nuestros esfuerzos para promover una política que integre mejor la información sobre eventos adversos en el proceso de toma de decisiones en salud [1]. Si bien la respuesta ha sido abrumadoramente positiva, también hemos recibido algunas preguntas y comentarios sobre el estado actual de la base de datos de eventos adversos – Sistema de notificación de la FDA de Eventos Adversos (FAERS, por sus siglas en inglés).
La mayoría de esas preguntas se pueden clasificar en dos categorías:
1. ¿Existe algún sistema de farmacovigilancia mejor o más actualizado?
2. ¿No tiene FAERS una serie de limitaciones y sesgos que dificulta el análisis de los datos?
¿Hay nuevos sistemas de vigilancia de la seguridad de los medicamentos? Sí. ¿Son mejores que FAERS? Rotundamente no.
Las agencias reguladores de muchos países han gastado cientos de millones de dólares (incluyendo el proyecto Sentinel de la FDA a un costo de US$150 millones +) en desarrollar sistemas activos de farmacovigilancia a través del análisis “a la carta” de bases de datos que contienen millones de historias clínicas electrónicas. Mientras que, en teoría, la utilización de grandes bases de datos parece prometedor, la realidad ha demostrado ser mucho más difícil.
A finales de mayo, la revista Drug Safety publicó a finales de mayo [2] un artículo preparado por el Instituto para Medicamentos Seguros (Institute for Safe Medications). Los autores encontraron que, “Los programas de investigación y los sistemas piloto creados para estudiar los efectos adversos de los medicamentos que tenían permiso de comercialización fueron, en gran medida, incapaces de proporcionar evidencia creíble de efectos adversos nuevos, insospechados; y arrojaron resultados conflictivos y contradictorios cuando se trataba de confirmar daños conocidos. Entre los problemas principales se incluye la utilización de una terminología limitada, la escasez de estudios de validación, y la necesidad de nuevos estándares estadísticos para el manejo de datos tan complejos. De hecho, los autores afirman que, “Seis años después de que se iniciara la construcción de Sentinel, el sistema todavía no ha sido la principal fuente de datos para identificar un nuevo riesgo de un solo fármaco que sirviera para poder adoptar una medida reglamentaria significativa como la retirada del fármaco, la inclusión de una advertencia, una restricción o contraindicación”.
Un futuro sistema de farmacovigilancia puede incluir el monitoreo de los medios sociales, de los términos utilizados en los motores de búsqueda en el Internet, y otras fuentes de información generada por los pacientes. Aunque todo esto pueda parecer promisorio, todavía está en su infancia y hoy no es una realidad [3]. Se desconoce, si un día, en el futuro, puede convertirse en algo tangible.
Todo esto significa que, en lo que se refiere a la vigilancia de la seguridad de los medicamentos una vez que han sido comercializados, FAERS ha sido, y seguirá siendo, el estándar de oro para los reguladores y la industria.
Sobre la segunda pregunta: las limitaciones y sesgos que pueden existir en FAERS. Si ha seguido nuestro blog ha visto que hemos trabajo mucho y publicado un buen número de artículos que ha sido revisado por pares para desacreditar esas nociones de limitaciones y sesgos. No voy a repetir todos esos hallazgos aquí, pero los invitamos a leer nuestros trabajos sobre el llamado Efecto Weber [4] y las Simulaciones de Informes en FAERS [5].
En su lugar, pensé que sería más útil echar un vistazo a la serie de datos FAERS que hemos procesado más recientemente para entender como ha crecido el valor de FAERS durante los últimos años.
La cantidad de informes que se presentan a FAERS aumenta rápidamente
El volumen de informes que llegan a FAERS ha aumentado significativamente en los últimos cinco años. Es evidente que nuestros esfuerzos, así como los de nuestros socios, de dar a conocer la importancia de aportar datos y de utilizar la información de FAERS ha jugado un papel en su crecimiento. Otros factores incluyen el hecho de que la FDA haya facilitado y acelerado el proceso para notificar los efectos adversos a FAERS y al mismo tiempo ha tomado medidas enérgicas contra las empresas farmacéuticas por no informar. A veces, mejorar lo que uno tiene, en lugar de recrear el sistema (Sentinel) es la solución más conveniente y costo-efectiva.
En los últimos cinco años, el número de informes de eventos sospechosos de ser efectos adversos a medicamentos ha aumentado en un 71%, pasando de 525.000 en 2010 a 900.000 en 2014.
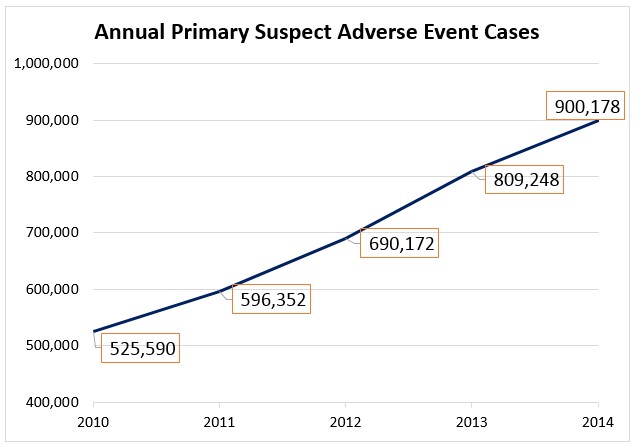
El problema de subregistro en FAERS se ha reducido
Una de las preocupaciones persistentes acerca de los datos de FAERS es la cuestión del subregistro. FAERS no registra cada evento adverso grave que se produce en un paciente que toma un medicamento recetado. Sin embargo, la estadística más ampliamente utilizada como tasa de subregistro es ahora claramente obsoleta. Un informe de la Government Accountability Office (GAO) de EE UU publicado en 2000 [6] afirmaba que no se notificaban el 90% de los eventos adversos graves a AERS (el sistema predecesor FAERS). Para ponerlo en contexto, ese año sólo se reportaron a AERS 153.000 casos de sospecha principal (que equivale al 17% del total de informes de 2014).
Si bien es difícil calcular con precisión la actual tasa de subregistro, creemos que ahora es más correcto asumir que el 90% es una gran exageración. Los datos de IMS revelan que en el mismo período de 2010 a 2014 las ventas de medicamentos en EE UU aumentaron en un 19%, lo que significa que la tasa de notificación de eventos adversos en FAERS ha superado con mucho el crecimiento de las ventas de medicamentos recetados. Sin importar cuál sea la tasa, FAERS cuenta con la mayor base de datos de eventos adversos post-comercialización que existe en el mercado.
La notificación de los efectos adversos más graves está aumentando aún más rápidamente
Al mismo tiempo, el número de notificaciones de eventos adversos probablemente atribuibles a medicamentos que han tenido las consecuencias más graves (hospitalizaciones, muertes y discapacidad) se ha incrementado aún más rápidamente. En 2010, los casos ascendieron a 170.000 y en 2014 habían aumentado a 331.000, un incremento de casi 95%.
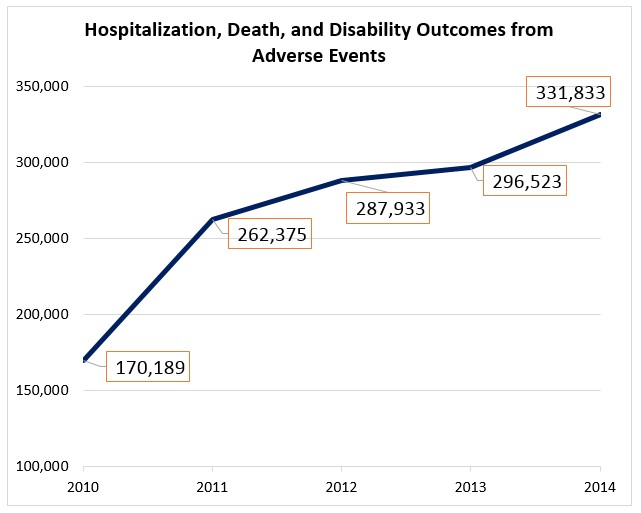
Esto es especialmente importante, ya que los eventos adversos que tienen consecuencias más graves son los que representan el mayor costo para el sistema de salud. AHRQ [7] y el CDC [8] estiman que el coste medio de una hospitalización por evento adverso es US$10,033, el costo promedio de una muerte $23,017, y el costo promedio de una discapacidad de un evento adverso en $ 11.471.
Entonces, en total, los efectos adversos más graves asociados en 2014 a medicamentos específicos con el nivel más alto posible de causalidad cuestan al sistema de salud US$4.500 millones. Y recuerde que esto es sólo lo que se ha informado. Esto debe ajustarse a lo que se considere una tasa de subregistro razonable (¡no el 90%!).
Las influencias y la estimulación de notificaciones a FAERS siguen siendo marginales
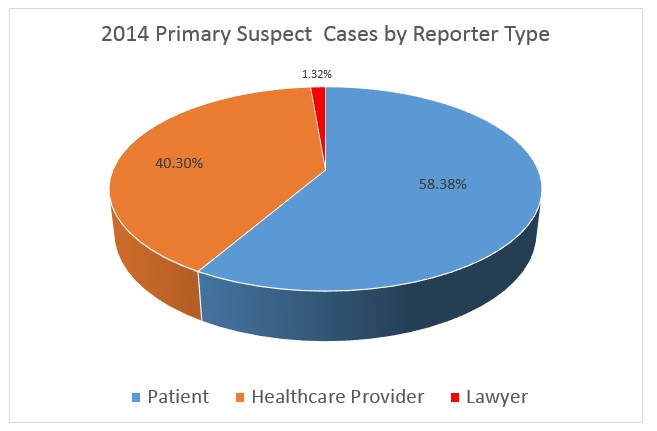
Es interesante echar un vistazo a las estadísticas de 2014 que muestran claramente la poca influencia que las notificaciones de terceros–potencialmente sesgados–tienen en la estadística de casos de sospecha primaria. Como en 2014 fueron los proveedores de servicios de salud y los pacientes los que enviaron el 99% de los informes, es justo decir que no hay influencia de los litigios en estos datos. Y el beneficio de FAERS es que solicitan información sobre el tipo de informante, a diferencia de las búsquedas en Internet que no son capaces de distinguir la información de calidad de la que no la tiene.
¿Qué se puede esperar en el 2015?
En resumen, más de lo mismo. Las notificaciones a FAERS seguirán superando al crecimiento del uso de medicamentos recetados, por lo tanto disminuirá aún más el problema de subregistro y se fortalecerá el valor total del conjunto de datos. La notificación de los eventos adversos más graves seguirá siendo la fuente principal de crecimiento de la información, y la influencia de los abogados y terceros ajenos seguirá siendo prácticamente nula.
Independientemente de los detractores y de las exageraciones de la industria respecto a futuros esfuerzos, la promesa de Sentinel, etc. FAERS es, sin nada que le pueda hacer la competencia, el activo más valioso que tenemos en este país para vigilar la seguridad de los medicamentos de venta con receta después de su comercialización. La mejoras en los informes de FAERS y su “colección de datos continúa siendo la forma más rápida y económica de monitorear la seguridad de la población estadounidense que tiene cada día un consumo mayor de medicamentos recetados.
Al obtener con éxito los datos disponibles en FAERS y posteriormente desarrollar herramientas analíticas poderosas que contrasten el verdadero costo total de un medicamento frente a otro, así como al cuestionar una amplia variedad de problemas de seguridad que se habían pasado por alto, AdverseEvents ha avanzado mucho en presentar estos datos a los financiadores, proveedores y compañías farmacéuticas, quienes ahora están utilizando esta información para ayudar a decidir los medicamentos que se deben incluir en los formularios, hacer proyecciones de costos y emitir alertas de seguridad.
Pero hay mucho más que se puede hacer. Para integrar mejor lo que se aprende al analizar este tesoro de información en nuestro sistema de salud, necesitamos que FAERS se utilice cada día más. Ningún hospital, médico, farmacéutico, asegurador o sistema de salud debe prescribir o aprobar un medicamento sin conocer el verdadero perfil de seguridad de ese medicamento específico comparado con otros. Y ningún medicamento debe ser prescrito o aprobado sin que el paciente conozca su perfil de seguridad y los costos asociados con la toma de un medicamento versus otro.
La eficacia y la seguridad del fármaco van de la mano para garantizar el bienestar general de la población estadounidense. Saber si los efectos secundarios de un medicamento pueden causar hospitalización es tan importante como saber si se pueden solucionar los síntomas originales. Como defensor de seguridad de los medicamentos, usted puede desempeñar un papel asegurándose de que todos los aspectos de seguridad de los medicamentos recetados son tomados en consideración antes de su prescripción. Deje que oigan su voz tomando el simple paso de pedir a CMS que fortalezca el plan de cobertura de medicamentos del programa de Medicaid en su modalidad de “sistemas de atención médica administrada” haciendo que las revisiones periódicas de los datos FAERS sean un componente del esfuerzo por mejorar la seguridad del paciente y reducir los costos para el sistema. Cuantos más datos y más análisis, más seguro será el mercado de los medicamentos de venta con receta.
Referencias