PRESCRIPCIÓN, FARMACIA Y UTILIZACIÓN
Investigaciones
Intervenciones tempranas para prevenir psicosis: revisión sistemática y meta-análisis.
(Early interventions to prevent psychosis: systematic review and meta-analysis)
Stafford MR, Jackson H, Mayo-Wilson E, Morrison AP, Kendall T
BMJ 2013;346:f185. http://www.bmj.com/content/346/bmj.f185
Traducido por Concha Moñino, Psicóloga clínica y Emilio Pol Farmacéutico de Hospital del Centro Dr. Esquerdo para Enfermos Mentales de Alicante
Introducción
La incidencia de “probable psicosis” calculada a partir de encuestas de comunidad en el Reino Unido parece permanecer estable y ser de aproximadamente 5 /1000 adultos [1,2]. La esquizofrenia parece ser la forma más común de psicosis y una de las causas más importantes de discapacidad a largo plazo [3], afectando a más de 25 millones de personas en todo el mundo. La esquizofrenia altera las relaciones sociales y familiares, dando lugar a importantes dificultades educativas y ocupacionales, pérdida de productividad, desempleo, enfermedad física, y mortalidad prematura [4]. En consecuencia, la esquizofrenia causa unos costes de aproximadamente ?55.000 (€67.000 ó US$88.000) por persona y año en el Reino Unido [5].
La esquizofrenia es usualmente precedida por un periodo prodrómico que dura de uno a tres años [6]. Este periodo se caracteriza por un abanico de conductas y síntomas psicológicos inespecíficos, deterioro funcional, y por síntomas positivos atenuados junto a breves síntomas psicóticos intermitentes limitados (BLIPS) [7]. Entre las personas con “ultra alto riesgo” de psicosis, aproximadamente entre el 22% y el 40% hacen la transición a esta en el plazo de 12 meses [8, 9, 10]. Las intervenciones que retrasan o previenen la transición a psicosis desde este síndrome prodrómico pueden ser clínica y económicamente importantes.
Los fármacos antipsicóticos y la terapia familiar pueden reducir la probabilidad de recaída en caso de esquizofrenia establecida y en el primer episodio; y la terapia cognitiva conductual (CBT) pueden reducir los síntomas y la admisión hospitalaria en personas con esquizofrenia [11]. La combinación de estos tratamientos en una estrategia integrada puede acarrear beneficios clínicos [12] y económicos [13] sustanciales para las personas con psicosis y esquizofrenia temprana. Estas intervenciones, si se aplican a personas de alto riesgo, podrían prevenir o retrasar la aparición de psicosis y esquizofrenia; y varios ensayos han estudiado si estas intervenciones previenen la transición desde el estado de alto riesgo hasta el de psicosis. Una revisión previa [14] encontró escasa evidencia de efectividad de las intervenciones para prevenir la psicosis, pero la búsqueda fue realizada en el 2009, y desde entonces ha habido varios estudios lo suficientemente grandes como para cambiar las conclusiones de la revisión. Se hace necesaria una revisión actualizada para determinar si alguna de las intervenciones tiene capacidad para prevenir o retrasar la transición a trastorno psicótico.
Método
Criterios de elegibilidad. Se incluyeron los estudios que evaluaron el efecto de cualquier intervención (farmacológica, psicológica, nutricional, o combinación) en participantes con síntomas prodrómicos. Utilizando una evaluación clínica para identificar rasgos prodrómicos, se consideró que los participantes incluidos tenían alto riesgo de desarrollar psicosis. Los estudios que incluyeron pacientes con un diagnóstico formal de esquizofrenia o trastorno bipolar (también primer episodio de psicosis) fueron excluidos. Se incluyeron ensayos clínicos aleatorizados de personas en riesgo y de participantes con trastornos esquizotípicos.
Tipos de resultados medidos. El principal resultado fue transición a psicosis. Los resultados secundarios fueron: síntomas de psicosis (totales, positivos, y negativos), depresión, y manía; calidad de vida; peso e interrupción del estudio. Los análisis se realizaron para los resultados medidos durante los seis primeros meses desde la aleatorización, entre los seis y los 12 meses de la aleatorización, y después de 12 meses de la aleatorización.
Estrategia de búsqueda. La búsqueda se efectuó en Embase, Medline, PreMedline, PsychINFO, y CENTRAL, y se incluyeron todos los estudios disponibles en la base de datos hasta noviembre del 2011. Las búsquedas en las cuatro primeras bases de datos se combinaron con filtros altamente sensibles para ensayos controlados aleatorizados. La búsqueda fue desarrollada inicialmente en Medline y posteriormente trasladada a las otras bases de datos. Los términos de búsqueda pueden verse en la versión web, apéndice 1. También se analizaron las referencias de los estudios incluidos, de los excluidos y de las revisiones previas, y se contactó con autores de los estudios y con expertos.
Valoración de sesgos. Los estudios fueron evaluados independientemente por dos de los autores, utilizando la herramienta para riesgo de sesgos de la Colaboración Cochrane [15]. Los desacuerdos fueron discutidos con un tercer autor y resueltos por consenso. Cada estudio fue puntuado por el riesgo de sesgos según: el tipo de secuencia de asignación; ocultamiento de la asignación; cegado de los participantes, evaluadores y proveedores de cuidados; reporte selectivo de resultados; y datos incompletos. El riesgo de sesgos para cada dominio fue clasificado como alto (debilita gravemente la confianza en los resultados), bajo (es poco probable que altere gravemente los resultados) o incierto.
Gestión de los datos. La extracción de datos y la evaluación del riesgo de sesgos se efectuaron empleando una hoja de cálculo Excel. Se recogieron datos para cada periodo de tiempo, incluyendo medidas, reclutamiento, criterios de exclusión e inclusión, edad, sexo, lugar y ubicación.
Análisis estadístico
Para resultados continuos, se calculó la diferencia de medias estandarizada Hedges g [16]. Para resultados dicotómicos se usó el cociente de riesgo conjunto. Todos los resultados se acompañan del intervalo de confianza al 95%. El efecto conjunto se calculó utilizando el modelo de efectos aleatorios. Los efectos continuos fueron ponderados empleando el método de Mantel-Haenszel [17,18].
Para cada resultado se indican los casos para los que no había información. Cuando no se notificaban pérdidas en el tamaño muestral, se contactó con los autores. Cuando los resultados, primarios o secundarios, se informaban para los sujetos que completaron el ensayo y también controlados por pérdidas (por ejemplo, datos imputados utilizando métodos de regresión), se utilizaron los datos controlados por pérdidas. Cuando los estudios informaban solo de los sujetos que completaron el ensayo se realizó un análisis de sensibilidad para la variable principal (transición a psicosis).
La heterogeneidad estadística se examinó mediante un examen visual del gráfico de bosque (forest plots), efectuando una prueba Chi-2 (cálculo del valor de P), y con el cálculo del valor del estadígrafo I2 [19, 20], que describe el porcentaje de heterogeneidad observada que puede atribuirse al azar. Si el valor de P fuera menor de 0,10 y el valor de I2 excediera el 50%, se considera que la heterogeneidad es sustancial.
El meta-análisis se realizó utilizando RevMan [21]. La confianza en los resultados se evaluó utilizando el método GRADE [22], que es un instrumento estructurado de evaluación de la calidad de las pruebas atendiendo a los siguientes factores: riesgo de sesgos, inconsistencia, imprecisión y sesgo de publicación.
Resultados
Flujo ensayos. De 1913 referencias potencialmente relevantes, recuperamos 39 artículos; de estos se excluyeron 18 por no cumplir los criterios de elegibilidad (ver apéndice 2 en la versión web). La razón de exclusión más común fue que el estudio no era aleatorizado y controlado. Once ensayos controlados y aleatorizados, que habían sido publicados en 21 artículos, cumplieron todos los criterios de inclusión (Figura 1), y los autores proporcionaron datos no publicados para dos de ellos [23, 24].
Características de los estudios. Los once ensayos incluidos comprendieron 1.246 participantes, con un tamaño medio de muestra de 81 (rango 51-288). La mediana de la media de edades fue de 21 años, y 710 (57%) de los participantes aleatorizados fueron varones. Ocho estudios [23, 24, 25, 26, 27, 28, 29, 30] incluyeron participantes pertenecientes a uno o más de tres grupos operativamente definidos (síntomas psicóticos atenuados, síntomas psicóticos transitorios, rasgos y factores de riesgo del estado).
Los dos primeros grupos se operacionalizaron a partir de obtener puntuación superior a un umbral en un instrumento de cribado: la entrevista estructurada para síntomas pródromos [9], la escala positiva y negativa (PANSS) [31], la escala breve de puntuación psiquiátrica (BPRS) [32], o la evaluación global de estados mentales de riesgo (CAARMS) [33]. Un estudio incluyó adultos que cumplían criterios de investigación del CIE-10 (clasificación internacional de enfermedades, 10º revisión) [34] para el trastorno esquizotipico [35], dos estudios utilizaron el inventario de reconocimiento temprano (ERIraos) [36], uno identificó a los individuos tempranamente al inicio del estado prodrómico [37], y otro no informó del umbral utilizado para determinar la elegibilidad de los participantes [38]. El Cuadro 1 describe las características de los estudios incluidos.
Cuadro 1. Características de los estudios incluidos
| Estudios | País | No | Instrumentos de cribado | Particip. (años y rango) | Comparación | Duración (sem.) | Seguim. (sem.) |
| Addington 2011(25) | Canadá | 51 | E. estructurada síntomas prodrómicos | 20,9 No informado (NR) | CBT v. Terapia de apoyo |
26 |
52 y 78 |
| Amminger 2010(14,26) | Austria | 81 | PANSS | 16,4 (NR) | Ácidos omega-3(1200mg/día) v.placebo |
12 |
52 |
| Bchdolf 2012(37,39) | Alemania | 128 | ERIraos | 25,8 (NR) | Terapias integradas v. Terapia de apoyo |
52 |
104 |
| McGlashan 2003(27,44-56) | Estados UnidosUSA | 60 | Entrev. estructurada síntomas prodrómicos | 17,8 (12-36) | Olanzapina (8mg/día) v. placebo |
52 |
104 |
| McGorry 2002(30,57) | Australia | 59 | BPRS | 20 (14-28) | Risparidona (1.3mg/día) y CBT v. Terapia de apoyo |
26 |
156-208 |
| Morrison 2004(23,58,59) | Gran Bretaña | 60 | PANSS | 22 (16-36) | CBT y Terapia de apoyo v. Terapia de apoyo |
52 |
156 |
| Morrison 2011(28,52) | Gran Bretaña | 288 | CAARMS | 20,7 (14-34) | CBT y Terapia de apoyo v. Terapia de apoyo |
26 |
104 |
| Nordentoft 2006(35) | Dinamarca | 79 | ICD-10 | 24,9 (NR) | Terapias integradas v. Tratamiento estándar |
104 |
NA |
| Phillips 2009(24,60) | Australia | 115 | CAARMS | 17,9 (NR) | Risperidona (2mg/día) y CBT v. CBT y placebo v. Terapia de apoyo y placebo |
52 |
104 |
| Ruhrmann 2007(38) | Alemania | 124 | Inventario de reconocimiento temprano. ERIraos | 25,6 (NR) | Amisulpiride (118.7mg/día) e Intervención según necesidad. |
12 |
NA |
| Van der Gaag 2012(29,61) | Holanda | 201 | CAARMS | 22,7 (NR) | CBTV. Terapia de apoyo |
26 |
52 y 78
|
Los once estudios incluidos efectuaron ocho comparaciones. Cuatro ensayos comparan terapia cognitivo conductual (CBT) con terapia de apoyo y seguimiento [23, 25, 28-29]. Dos ensayos compararon risperidona y CBT con terapia de apoyo [24, 30]. Un ensayo comparó risperidona y CBT con placebo y CBT [24], olanzapina con placebo [27], terapia integrada con terapia de apoyo [37], terapia integrada con tratamiento usual [35], ácidos grasos omega-3 con placebo [26] y amisulpiride más intervención según precise frente a intervención sola [38].
Los ensayos de CBT [23, 24, 25, 28, 29, 30] proveyeron tratamiento protocolizado centrado en problemas por un tiempo establecido que incluían: normalización, reestructuración cognitiva, y experimentación conductual. La terapia de apoyo y el seguimiento [23-25, 28, 30, 37] se utilizaron para emparejar aspectos del tratamiento experimental que tiene efectos inespecíficos, e incluían psicoeducación, referencia y gestión de crisis. “Tratamiento usual” se refería a las pautas vigentes para tratar a los pacientes que buscan ayuda por problemas de salud mental en servicios de salud mental [29] o en centros comunitarios de salud mental [35]. La terapia psicológica integrada
incluyó CBT para pacientes individuales, grupos de entrenamiento en habilidades, rehabilitación cognitiva y terapia familiar, con [35] o sin tratamiento antipsicótico concomitante [39]. En un estudio, la “intervención según precise”, incluyó el “tratamiento usual” del paciente y podía incluir psicoeducación, intervención en crisis, consejo familiar, y ayuda para resolver las dificultades escolares o laborales [38]. En el apéndice 3 de la versión Web se proporciona una descripción detallada de las intervenciones psicológicas utilizadas en los ensayos incluidos.
La transición a psicosis se definió de varias maneras, incluyendo el diagnósticos del ICD-10 [34] de trastorno psicótico [35]; diagnóstico de trastornos del espectro esquizofrénico [25] usando el DSM-IV [40]; una medida desarrollada por los autores [27]; gravedad de los síntomas [23, 26] en la PANSS [31] y gravedad de síntomas [24, 28, 29] en la CAARMS [33]; y la presencia de síntomas psicóticos positivos [30]. Un estudio evaluó la transición desde los síntomas prodrómicos tempranos hasta el desarrollo de síntomas atenuados o transitorios (esto es, psicosis subumbral) y/o trastorno psicótico DSM-VI [37].
Riesgo de sesgos. Valoramos el riesgo de sesgo para cada ensayo utilizando la herramienta para riesgo de sesgo Cochrane (Fig 2) [41]. Ninguno de los ensayos tuvo alto riesgo de sesgo en la generación de secuencias (falsa aleatorización), no obstante, el método de aleatorización no se explicó en tres de los ensayos [27, 30, 38]. El riesgo de sesgo por falta de ocultamiento de la asignación no estaba claro en cuatro ensayos [25, 27, 30, 38]. La falta de cegado del evaluador creó un alto riesgo de sesgo en algunos de los resultados en tres estudios [30,35, 38]. Ocho estudios [23, 25, 28, 29, 30, 35, 37, 38] tuvieron alto riesgo de sesgo debido a que los participantes o el staff no fueron cegados, algo imposible de hacer en investigaciones con intervenciones psicológicas.
Todos los estudios tuvieron un alto riesgo de sesgo debido a datos incompletos, lo cual es reflejo de la alta tasa de abandonos en este tipo de población, más que a deficiencias metodológicas de los estudios [6, 23, 24, 25, 26, 27, 28, 29, 30, 35, 37, 38]. En un estudio algunos participantes no fueron seguidos durante los 12 últimos meses, esto es aquellos que entraron en el último año de estudio, y los datos faltantes no pudieron se calculados basándose en el número de participantes aleatorizados [28]. Sólo cuatro estudios estuvieron claramente libres de informe selectivo de resultados [23, 28, 29, 38]; tres ensayos no informaron de todos los resultados [26, 35, 37], y no estuvo claro si cuatro estudios informaron de todos los resultados [24, 25, 27, 30].
Esta revisión incluye varios ensayos pequeños de intervenciones farmacológicas y nutricionales. A causa de su pequeño número, fuimos incapaces de evaluar formalmente el sesgo de publicación – esto es utilizando un análisis detallado de ajuste y de relleno [42] -, pero revisiones previas han mostrado que los beneficios de tales intervenciones en niños eran sistemáticamente sobrevaloradas y los riesgos infraestimados [43]. La mayoría de estas intervenciones fueron realizadas antes de la introducción de un registro obligatorio de ensayos clínicos [44], regla que los fabricantes podrían haber incumplido [45]. Como uno o dos ensayos pequeños no publicados podrían haber sido suficientes para cambiar la visión de beneficios y daños de estas intervenciones, consideramos que hubo un alto riesgo de sesgo de publicación.
Síntesis cuantitativa de datos
Hicimos un meta-análisis para ocho comparaciones. Un ensayo con tres grupos de tratamiento incluyó tres parejas de comparaciones [24]. Nosotros analizamos la transición a la psicosis (Cuadro 2); los síntomas de psicosis y depresión; calidad de vida; perdida de sujetos/atrición; y cuando fue posible, los efectos secundarios/colaterales (web apéndice 4).
Algunas evidencias indicaban que la transición se retrasaba (Cuadro 2) en los ensayos con CBT [23,24,25,28,29], CBT y Risperidona [30], psicoterapia integrada [35,37] y con ácidos grasos omega-3 [26]. Sin embargo, la confianza en estas estimaciones varió desde moderada a baja.
Intervenciones psicológicas y psicosociales complejas
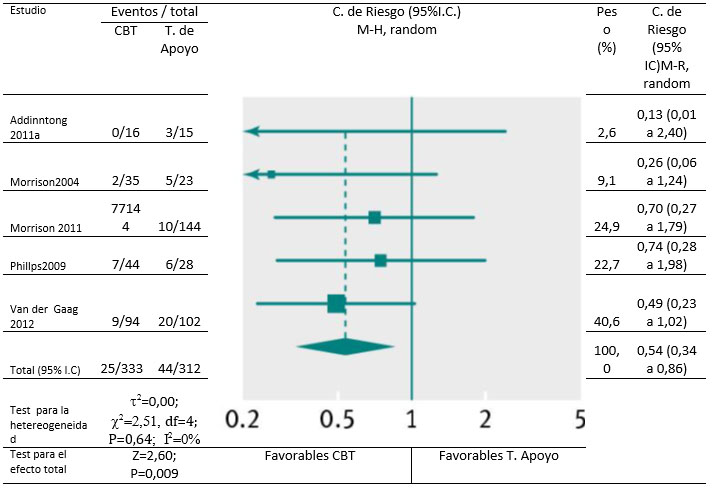
Dentro de los primeros seis meses de tratamiento, cuatro estudios compararon CBT con terapia de apoyo y monitorización [25, 28, 29, 46] e informaron que CBT no reduce la transición a la psicosis (razón de riesgo 0,62 IC95%: 0,29 a1,31). Pero los ensayos incluyeron solo 40 eventos (591 participantes), y en global, esta evidencia fue de baja calidad. Sin embargo, a los 12 meses hubo datos de calidad moderada que indicaban que más personas que finalizaron el estudio en el grupo que recibió terapia de apoyo, tuvieron transición a psicosis (0,54 IC 95% 0,36a 0,86, Fig. 3) lo cual continúo siendo significativo en un análisis de sensibilidad (0,64 IC95% :0,44 a 0,93).
Cuadro 2. Resumen de los efectos sobre la transición a psicosis
| Comparación | Duración(meses de tratamiento) | Número (%) de ensayos analizados | Nº (%) de participantes en los análisis | Cociente de riesgo (CI:95%), efectos aleatorios | Heterogeneidad (I2 (%), Chi-2 (P)) | Calidad de la evidencia (GRADE) |
| Terapia cognitivo conductual vs terapia de apoyo 23-25, 28, 29. | 0-6 | 4 (80) | 591 (88) | 0,62 (0,29-1,31) | 17; 3,6 (p=0,31) | Baja * ++ |
| 6-12 | 5(100) | 645 (71) | 0,54 (0,34-0,86) | 0; 2,51 (p= 0,64)=0P2) | Moderada* | |
| 12+ | 4 (80) | 570 (85) | 0,63 (0,40-0,99) | 0; 2,50 (p=0,48) | Baja* ++ | |
| Terapia cognitivo conductual y risperidona vs terapia de apoyo 24, 30. | 0-6 | 2 (100) | 130 (100) | 0,35 (0,13-0,95) | 0; 0,59 (p=0,44) | Muy baja * ++ $ |
| 6-12 | 2 (100) | 130 (100) | 0,63 (0,33-1,21) | 0; 0,25 (p=0,61) | Muy baja * ++ $ | |
| 12+ | 1 (50) | 41 (32) | 0,59 (0,34-1,04) | NA | Muy baja * ++ $ | |
| Psicoterapia integrada vs terapia de apoyo 37. | 6-12 | 1 (100) | 125 (100) | 0,19 (0,04-0,81) | NA | Muy baja * ++ ¶ |
| 12+ | 1 (100) | 125 (100) | 0,32 (0,11-0,92) | NA | Muy baja * ++ ¶ | |
| Psicoterapia integrada vs tratamiento usual 35 | 6-12 | 1 (100) | 67 (85) | 0,24 (0,07-0,81) | NA | Baja * ++ |
| 12+ | 1 (100) | 65(82) | 0,52 (0,26-1,02) | NA | Baja * ++ | |
| Terapia cognitivo conductual y risperidona vs terapia cognitivo conductual y placebo 24 | 0-6 | 1 (100) | 87 (100) | 1,02 (0,15-6,94) | NA | Muy baja * ++ $ |
| 6-12 | 1 (100) | 87 (100) | 1,02 (0,39-2,67) | NA | Muy baja * ++ $ | |
| Olanzapina vs placebo 27 | 6-12 | 1 (100) | 60 (100) | 0,43 (0,17-1,08) | NA | Muy baja * ++ $ |
| Ácidos grasos omega-3 vs placebo 26 | 0-6 | 1 (100) | 76 (94) | 0,13 (0,02-0,95) | NA | Baja * ++ |
| 6-12 | 1 (100) | 81 (100) | 0,18 (0,04-0,75) | NA | Baja * ++ | |
| NA = no aplicableNBI= intervención según precisa
*=razones de baja puntuación: imprecisión ++= razones para puntuar bajo: riesgo de sesgo $=razones para puntuar bajo: riesgo de sesgo de publicación ¶=razones para puntuar bajo: indirectness. |
||||||
A los 18 meses hubo evidencia de baja calidad que asoció la CBT con menor frecuencia de transiciones (0,63; IC95%: 0,40 a 0,99), y el efecto dejo de ser significativo al hacer el análisis de sensibilidad (0,55; IC95% 0,25 a 1,19).
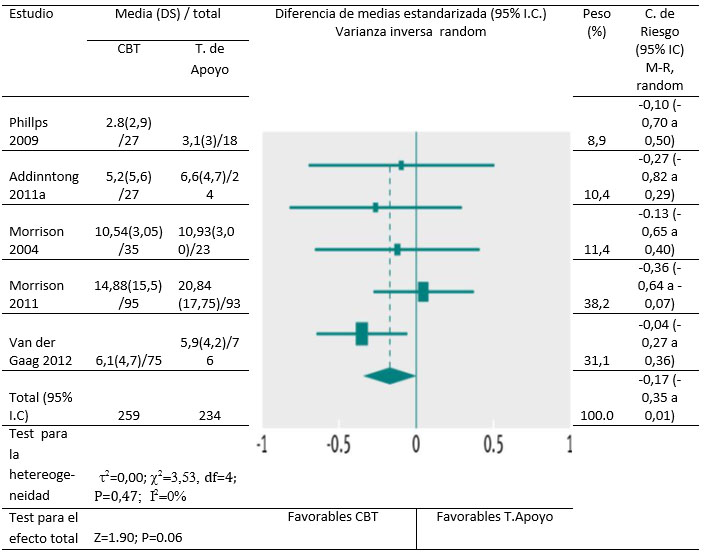
La combinación de efectos sobre los síntomas positivos de psicosis, depresión y calidad de vida no fueron significativos en ningún momento (Fig 4), pero los datos fueron de baja calidad para todos los resultados excepto para los síntomas positivos durante los seis primeros meses y a los 12 meses. Un estudio [29] informó de resultados secundarios sólo para participantes que no tuvieron transición a psicosis; los participantes con síntomas positivos graves fueron excluidos de este análisis. En los análisis de sensibilidad excluyendo este estudio, hubo un efecto significativo para síntomas positivos (diferencia de medias estandarizada -0,27; IC 95% -0.47 a 0,06), pero los efectos en otras medidas de resultado siguieron sin ser significativos. Hubo datos de baja calidad sobre el conjunto total de síntomas de psicosis y síntomas negativos de psicosis, y los efectos no fueron significativos. Las pérdidas de sujetos – atrición- fueron similares entre los distintos grupos dentro de los primeros seis meses. (Coeficiente o razón de riesgo 1,09; IC95% 0,88 a1,35).
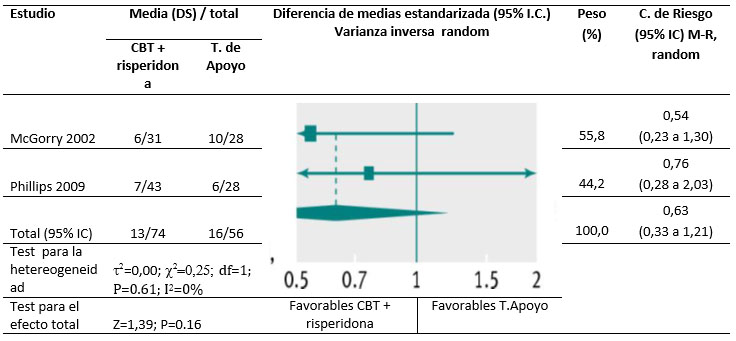
Hubo evidencia de muy baja calidad en los datos de beneficios y daños asociados con terapia cognitiva y risperidona procedente de dos estudios que comparaban CBT y risperidona con terapia de apoyo [24,30]. Dentro de los seis primeros meses de tratamiento hubo menos gente que recibía CBT y risperidona que hizo la transición a psicosis (C. riesgo 0,35; IC95% 0,13 a 0,95), pero estos ensayos incluyeron sólo 17 eventos (130 participantes). El efecto no fue significativo después de 12 meses (C. riesgo 0,63; IC95% 0,33 a 1,21)( Fig.5) ni después de 36 meses.( C. riesgo 0,59; IC95% 0,34 a 1,04). No hubo efectos significativos de este tratamiento sobre la calidad de vida, síntomas de psicosis (totales, positivos o negativos), depresión o manía. Dentro de los seis meses, no hubo atrición en un estudio [30] y la tasa de pérdidas en el segundo estudio [24] fue similar entre grupos (C. riesgo 0,76; IC95% 0,28 a 2,03).
Fig.3 Transición a psicosis para participantes que recibieron CBT versus terapia de apoyo (desde 6-12m; incluido sólo los completos). M-H Mantel-Haenszel
Hubo evidencia de muy baja calidad para los beneficios y daños asociados con psicoterapia integrada en un estudio [39] que comparaba psicoterapia integrada (una media de sesiones de 15,08 y una desviación estándar de 6,8) con consejo/terapia de apoyo (una media de 23,7 sesiones y una desviación estándar de 13,1) en participantes con un estado prodrómico inicial temprano [37]. Este estudio midió la transición a un estado de muy alto riesgo o alto riesgo para la salud mental o a trastorno psicótico (DSM-IV). Dentro de los primeros 12 meses, menos personas de las completaron la psicoterapia integrada hicieron la transición a los estados de muy alto riesgo o alto riesgo para la salud mental y psicosis (C. Riesgo 0,19; IC 95%:- 0,04 a 0,081), pero hubo sólo 13 eventos de (125 participantes). El efecto se mantuvo a los 24 meses (0,32; IC95% 0,11 a 0,92). Las pérdidas fueron similares entre grupos a los 12 meses (1,55; IC95% 0,68 a 3,53]) y a los 24 meses (0,95 IC95%: 0,61 a 1,49).
Hubo evidencia de baja calidad en el estudio que comparó psicoterapia integrada con el tratamiento usual [35]. Dentro de los 12 meses, menos gente recibiendo psicoterapia integrada hizo la transición a psicosis (C. Riesgo 0,24; IC 95% 0,07 a 0,81) pero hubo sólo 13 eventos (67 participantes). El efecto continuo siendo significativo cuando se realizó el análisis asumiendo que las pérdidas habían hecho la transición a psicosis (C. Riesgo 0,41; IC95% 0,20 a 0,85), pero el efecto no se mantuvo significativo a los 24 meses (0,52 IC95% 0,26 a 1,02). No hubo efectos sobre los síntomas positivos o negativos de psicosis en ningún momento. Las pérdidas fueron similares entre los grupos a los 12 meses (0,63; IC95% 0,22 a 1,81]) y a los 24 meses (0,66 IC95% 0,25 a 1,73).
Figura 4. Síntomas `positivos de psicosis en participantes que recibieron CBT vesus terapia de apoyo (6-12 meses).
Intervenciones farmacológicas
Un estudio comparó CBT y risperidona con CBT y placebo [24]. La evidencia fue de muy baja calidad en los seis primeros meses de tratamiento sugiriendo que no hay ninguna diferencia en la transición a psicosis (CR 1,02; IC95% 0,15 a 6,94), lo cual se mantuvo a los 12 meses (1,02 IC95% 0,39 a 2,67). Las diferencias en sintomatología psicótica (total, positiva o negativa), depresión o calidad de vida no fueron significativas. La pérdida fue similar entre grupos (1,09; IC95% 0,62 a 1,92), aunque la evidencia fue también de muy baja calidad.
Hubo evidencia muy baja calidad para los beneficios y daños asociados con olanzapina, procedente de un estudio que comparaba olanzapina con placebo [27]. Nosotros no encontramos diferencia en la transición a psicosis después de 12 meses (C.R. 0,44 IC95% 0,17 a 1,08). La atrición fue similar entre los grupos a los 12 meses (1,59 IC95%: 0,88 a 2,88). Los participantes que tomaban olanzapina experimentaron cambios importantes de peso en las primeras ocho semanas (diferencia estandarizada de medias (0,81 IC95% 0,28 a 1,34) la cual continúo siendo importante a los 12 meses (1,18 IC95% 0,62-1,73). Los efectos sobre los síntomas de psicosis total, positivos o negativos, depresión y manía no fueron significativos. Los datos a los 24 meses no se analizaron debido a que menos del 50% de los participantes continuaba en el estudio.
También encontramos evidencia de muy baja calidad asociada con amisulpride procedente de un estudio que comparaba amisulpride e intervención según necesidad, con solo intervención según necesidad [38]. No se informó sobre la transición a psicosis. Dentro de los seis primeros meses el efecto sobre los síntomas de psicosis totales y negativos no fue significativo, pero amsulpride se asoció con una reducción moderada de los síntomas positivos (diferencia estandarizada de medias -0,53; IC 95% -0,93 a -0,13) y depresión (-0,51; IC95% -0.91 a -0.11) la suma de amisulpride se asoció con una moderada reducción de pérdidas (0,59; IC95% 0,38 a 0,94).
Figura 5. Transición a psicosis entre participantes que recibieron CBT y risperidona versus terapia de apoyo (a los 6-12 meses; solo incluye personas que terminaron el ensayo). M-H=Mantel-Haenszel.
Suplementos Nutricionales
Encontramos evidencia de baja calidad para los beneficios y riesgos asociados con ácidos omega-3 a partir de los resultados de un estudio que comparaba ácidos grasos omega-3 con placebo [26]. Los participantes recibieron tratamiento por 12 semanas, lo cual se asoció con una gran reducción en la transición a psicosis (razón de riesgo=0,13 IC95%: 0,02 a 0,95), pero esto fueron sólo nueve sucesos (76 participantes). Asumiendo que los participantes que se perdieron hicieron una transición a psicosis, el efecto permaneció importante a las 12 semanas (0,39; IC95% 0,13 a 1,14). Este efecto permaneció significativo después de 12 meses (0,81; IC95% 0,04 a 0,75), aunque el número de eventos fue sólo de 13 (81 participantes). Los efectos del tratamiento en el total de los síntomas de psicosis (diferencia estandarizada entre medias -1,26 (IC95% -1,74 a -0,78), en los síntomas positivos -2,08 (IC95% -2,63 a -1,54) y en los síntomas negativos -2,22 (IC95%: -2,77 a -1,66) también favorecieron a los ácidos grasos omega -3 después de 12 meses. Las pérdidas al final del tratamiento no se notificaron; sin embargo las pérdidas después de 12 meses fueron pocas y similares entre ambos grupos (CR. 1,46; IC 95%: 0,26 a 8,30).
Discusión: Comparación con otros estudios
Esta revisión sistemática y meta-análisis de los tratamientos para personas en alto riesgo de desarrollar psicosis incluyó 11 ensayos y 1.246 participantes que buscaban tratamiento. Los participantes recibieron una serie completa de intervenciones psicológicas, farmacológicas, nutricionales y psicosociales.
Esta revisión incluyó el doble de estudios y participantes que una revisión previa, la cual no encontró clara evidencia de beneficio [14]. Estudios recientes han contribuido significativamente a crear una gran base de datos, que sugiere que la transición a psicosis desde un estado mental de alto riesgo podría ser prevenible. Estos datos también sugieren estrategias de investigación que podrían utilizarse en el futuro para que aporten resultados útiles, identificando los tratamientos que tienen el máximo potencial para reducir la transición a psicosis. En base a los resultados de esta revisión, se requiere más investigación para determinar los beneficios de ambas intervenciones psicológicas – especialmente CBT con o sin tratamiento familiar, y terapia nutritiva (ácidos grasos omega-3)
Resumen de resultados
En definitiva, cinco ensayos de CBT tuvieron un efecto moderado en la transición a psicosis tanto a los 12 meses como a los 18 meses. En los análisis de sensibilidad, asumiendo que los pacientes perdidos experimentaran transición, el efecto de CBT sobre la transición permaneció significativo a los 12 meses; no obstante, el efecto a los 18 meses no fue significativo. También hubo evidencia que las intervenciones psicosociales complejas podrían reducir o retrasar la transición a psicosis en comparación con la terapia de apoyo o tratamiento usual. Para los ácidos grasos omega-3, datos de baja calidad sugieren un efecto beneficioso en un curso de 12 semanas de suplemento nutricional comparado con placebo. Sin embargo, este dato procede de un único ensayo con pocos participantes, y que sepamos estos resultados nunca han sido replicados. Aunque el efecto absoluto de los tratamientos pudiera variar en poblaciones con diferente riesgo basal de psicosis (Cuadro 3), el efecto para las intervenciones más prometedoras son probablemente clínicamente significativas para la mayoría de los servicios psiquiátricos.
Cuadro 3. Efecto absoluto del tratamiento para pacientes con alto riesgo y muy alto riesgo de desarrollar psicosis.
Los datos reflejan el número de participantes de cada 1000 que hicieron transición a psicosis
| Población |
Intervención |
Control |
| Terapia cognitivo-conductual (cociente de riesgo=0,54) | ||
| Muy alto riesgo |
162 |
300 |
| Alto riesgo |
54 |
100 |
| Terapia cognitivo-conductual y risperidona (cociente de riesgo=0,63) | ||
| Muy alto riesgo |
189 |
300 |
| Alto riesgo |
63 |
100 |
| Psicoterapia integrada (cociente de riesgo=0,19) | ||
| Muy alto riesgo |
57 |
300 |
| Alto riesgo |
19 |
100 |
| Aceite de pescado/ácidos grasos omega-3 (cociente de riesgo=0,18) | ||
| Muy alto riesgo |
54 |
300 |
| Alto riesgo |
18 |
100 |
No obstante, ninguno de los tratamientos mostró efectos claros o seguros, muchos de los estudios incluidos en esta revisión tienen serios problemas. Muchos ensayos fueron poco claros en cuanto a riesgo de sesgo de selección, y algunos ensayos fueron clasificados como de alto riesgo de sesgo de detección. Consideramos que es improbable que el cegado de los participantes o profesionales de salud que atendían a los pacientes pudiera introducir un sesgo importante y nosotros no reducimos el valor del estudio por este motivo. Es posible cegar a los evaluadores en los estudios de intervenciones psicológicas y consideramos que no cegar a los evaluadores puede introducir un sesgo y eso sí se tuvo en cuenta en nuestra evaluación de la calidad de los estudios. Sólo cuatro estudios estuvieron claramente libres de una notificación selectiva de resultados, y muchos estudios no informaron sobre todos los resultados.
Todos los estudios identificados tuvieron un alto riesgo de sesgo debido a la recogida incompleta de datos; sin embargo este resultado refleja un alto nivel de atrición (o pérdidas) en este tipo de población, más que deficiencias metodológicas de los estudios. Además la definición de estado prodrómico, de alto riesgo y de ultra alto riesgo de enfermedad mental varía entre estudios. Un estudio [37] utilizó como resultado principal el desarrollo de psicosis sub umbral o (estado mental de ultra alto riesgo), el cual fue el criterio de entrada para la mayoría de los otros estudios. Aunque bastante similares, los diferentes criterios de entrada y definiciones operativas de transición a psicosis podían explicar porque las tasas globales de transición fueron menores que las esperadas; por lo tanto nuestros resultados deben ser interpretados con cautela. Del mismo modo, problemas epidemiológicos relacionados con el muestreo, la fluctuación temporal de síntomas y las estrategias de enriquecimiento de riesgo utilizadas en estos ensayos podrían afectar la generalización de estos hallazgos a la práctica rutinaria en los sistemas de salud.
Aunque la mayoría de las intervenciones evaluadas muestran tener algo de efectividad en pacientes con psicosis declarada, los estudios incluidos utilizaron diferentes comparadores, lo que limita la comparación entre tratamientos y el meta-análisis. Además, las condiciones de control que incluyen intervenciones activas pueden subestimar el efecto de algunas intervenciones en comparación con la no intervención. Por ejemplo, las comparaciones incluyeron combinaciones de terapia de apoyo, regular y frecuente monitorización del estado mental, y el tratamiento usual. Consecuentemente la transición a los 12 meses varió entre 7,1% [28] y 27% [30]. Además, el 25% de los participantes en un estudio estaban internados [35], sugiriendo que la población ya estaba bastante enferma en ese momento, quizás incluso se habría producido ya la transición a psicosis, o quizás tuvieran un alto riesgo de provocarse auto lesiones. Por otra parte, la mayoría de estudios reclutaron personas que estaban buscando tratamiento, lo cual necesariamente omitió gente que podía beneficiarse de la ayuda pero que no lo buscaba.
Nuestro análisis fue sensible a suposiciones sobre atrición/pérdidas. Los análisis de los que finalizaron el estudio sugieren que las intervenciones psicológicas (CBT con o sin intervención familiar) tienen un efecto beneficioso; sin embargo, algunos hallazgos no fueron significativos cuando se supuso que los que abandonaron habían hecho la transición a psicosis. Dado que la transición a psicosis probablemente va asociada con el uso de servicios y la mayoría de los ensayos hacen un seguimiento de los pacientes perdidos a través de los registros de salud y los médicos de familia, el análisis de los sujetos que finalizan (que es similar al análisis que asume que las pérdidas no son personas que han hecho la transición) puede realmente representar el impacto de las intervenciones en los participantes. Como la mayoría de los resultados son informados dentro del año, consideramos que el resultado dicotómico simple es el mejor para medir el momento de la transición. El momento para la transición se midió y se informó de varias formas, lo que no facilitaba que se pudiera hacer una síntesis transparente y clara, ni hacer un análisis de sensibilidad para probar la importancia de las suposiciones sobre las pérdidas.
Fortalezas y limitaciones del estudio
Nuestra elección de medida de resultado principal (variable dicotómica de transición a psicosis) refleja los resultados principales utilizados en los ensayos clínicos. Sin embargo, se ha dicho [47] que la selección de un umbral es una decisión arbitraria, que da demasiada importancia a los síntomas positivos, y que otras dimensiones podrían ser más informativas, como los síntomas negativos, funcionamiento, y calidad de vida. Por eso, nosotros también analizamos estos resultados, pero pocos ensayos informaron sobre estas variables y como resultado nuestro análisis no tiene suficiente poder estadístico.
Una de las conclusiones importantes es que nosotros no encontramos evidencia para apoyar la temprana promesa de que algunos antipsicóticos pueden retrasar o prevenir la transición a psicosis. Además, los antipsicóticos se asocian a efectos secundarios clínicamente significativos. Aunque es mejor definir la situación como la ausencia de evidencia que como evidencia de ausencia, esta revisión no encuentra razones para seguir con esta línea de indagación. Mucha gente en ultra alto riesgo no progresa a psicosis, y nosotros suponemos que si hubiera evidencia de que los beneficios superan los daños en esta población, esta habría sido publicada. Además, en un reciente estudio de gente joven en riesgo de desarrollar psicosis que se habían inscrito en un programa de tratamiento psicosocial se encontraron mejoras clínicas significativas sin el uso de anti psicóticos [48].
Los tratamientos psicológicos también se asocian con efectos secundarios significativos, y aproximadamente un 10% de los participantes en este tipo de tratamientos se deterioran [49, 50], pero es improbable que las terapias psicológicas causen los daños asociadas con antipsicóticos. El tratamiento psicológico podría asociarse con un incremento del estigma y con otras consecuencias para los participantes que no desarrollarían psicosis sin recibir tratamiento. Además existen consideraciones éticas en la aplicación de todas las intervenciones en esta población. Todos los ensayos futuros de intervenciones psicológicas deberían medir tales efectos adversos e informar sobre ellos.
Sugerencias para futuras investigaciones
Los hallazgos de esta revisión sugieren dos posibles direcciones para futuras investigaciones. Primeramente, los resultados de los ensayos usando ácidos grasos omega-3 sugieren que esta intervención podría tener efectos beneficiosos en las ratios de transición. Se precisa replicar el estudio con una muestra mayor para determinar si esta intervención tiene algún mérito. El uso de ácidos grasos omega-3 es un tratamiento relativamente seguro con pocos riesgos de salud que podría tener otros beneficios potenciales (por ejemplo para el estado cardiovascular) [51]. Por eso, esta intervención tiene especial interés.
La segunda aproximación terapéutica está basada en los posibles beneficios de la CBT, con o sin intervención familiar. Buena evidencia indica que las intervenciones familiares son efectivas en reducir las ratios de recaídas en el primer episodio de psicosis y esquizofrenia declarada; y hay evidencia de que la CBT individual tiene beneficios sintomáticos en cada uno de estos contextos [11]. La evidencia preliminar también indica que la terapia cognitiva podría beneficiar a los pacientes en su primer episodio de psicosis sin añadir tratamiento con fármacos antipsicóticos [52]. Es más, la evidencia más fuerte para prevenir episodios de psicosis es con las intervenciones familiares mejor que la CBT individual [11]. La transición desde un estado de alto riesgo a un primer episodio de psicosis podría ser susceptible de tratamiento combinando con CBT familiar e individual.
La CBT podría ser particularmente apropiada a la luz y considerando la prevalencia de ansiedad y trastornos del humor en esta población [28,30]. Esto es, las guías de tratamiento de ansiedad y depresión recomiendan CBT individual, sugiriendo que la CBT también podría ser apropiada para pacientes que acuden a los servicios pero nunca harán la transición a psicosis. Es necesario hacer una valoración de cómo aplicar estas intervenciones psicológicas para que sean accesibles y oportunas. Probablemente se tendrá que hacer una inversión considerable para formar terapeutas en esta línea, o hay que desarrollar y evaluar métodos innovadores. En el Reino Unido se podría incorporar esta línea dentro del existente programa de acceso mejorado a terapias psicológicas, el cual ha sido recientemente extendido para incluir a niños, jóvenes y adultos. Para superar algunos de los problemas epidemiológicos esbozados anteriormente, los tratamientos podrían aplicarse dentro de un estadio general amplio de salud mental. Este modelo tiene como meta aplicar intervenciones preventivas tempranas para jóvenes, con la esperanza de evitar el desarrollo de trastornos de mayor gravedad [53].
Conclusiones y recomendaciones de actuación
La esquizofrenia y las psicosis son altamente discapacitantes, recurrentes y a menudo un trastorno de por vida con alto coste para pacientes, sus familiares y el estado; y posiblemente más grave que cualquier otra condición psiquiátrica. La posibilidad de prevenir la transición a psicosis y esquizofrenia entre la gente de alto riesgo claramente representa un hallazgo importante [54]. Por eso, más investigación se debiera continuar en la forma de un gran ensayo multicéntrico que combine CBT familiar e individual para grupos de alto riesgo, evaluando tanto beneficios y como riesgos potenciales (por ejemplo posible aumento del estigma). Mientras tanto, el uso de estos tratamientos psicológicos ahora representa la intervención más adecuada disponible para ayudar a estas personas y evitar lo que podría ser una catástrofe personal, social y financiera.
Referencias
1. Bebbington P, Brugha T, Meltzer H, Farrell M, Ceresa C, Jenkins R, et al. Psychiatric disorder and dysfunction in the UK National Survey of Psychiatric Morbidity. Soc Psychiatry Psychiatr Epidemiol 2000;35:191-7.
2. Bebbington P, Brugha T, Coid J, Crawford M, Deverill C, D’Souza J, et al. Adult psychiatric morbidity in England, 2007. Results of a household survey. NHS Information Centre for Health and Social Care, 2011.
3. Mueser KT, McGurk SR. Schizophrenia. Lancet 2004;363:2063-72.
4. Bloom DE, Cafiero ET, Jané-Llopis E, Abrahams-Gessel S, Bloom LR, Fathima S, et al. The global economic burden of noncommunicable diseases. World Economic Forum, 2011.http://www3.weforum.org/docs/WEF_Harvard_HE_GlobalEconomicBurdenNonCommunicableDiseases_2011.pdf
5. Mangalore R, Knapp M. Cost of schizophrenia in England. J Ment Health Policy Econ 2007;10:23-41.
6. McGlashan TH. Commentary: Progress, issues, and implications of prodromal research: an inside view. Schizophr Bull 2003;29:851-8.
7. Ruhrmann S, Schultze-Lutter F, Salokangas RK, Heinimaa M, Linszen D, Dingemans P, et al. Prediction of psychosis in adolescents and young adults at high risk: results from the prospective European prediction of psychosis study. Arch Gen Psychiatr 2010;67:241-51.
8. Yung AR, Phillips LJ, Yuen HP, Francey SM, McFarlane CA, Hallgren M, et al. Psychosis prediction: 12-month follow up of a high-risk (“prodromal”) group. Schizophr Res 2003;60:21-32.
9. Miller TJ, McGlashan TH, Rosen JL, Somjee L, Markovich PJ, Stein K, et al. Prospective diagnosis of the initial prodrome for schizophrenia based on the Structured Interview for Prodromal Syndromes: preliminary evidence of interrater reliability and predictive validity. Am J Psychiatr 2002;159:863-5.
10. Fusar-Poli P, Bonoldi I, Yung AR, Borgwardt S, Kempton MJ, Valmaggia L, et al. Predicting psychosis: meta-analysis of transition outcomes in individuals at high clinical risk. Arch Gen Psychiatr 2012;69:220-9.
11. National Institute for Health and Clinical Excellence. The NICE guideline on core interventions in the treatment and management of schizophrenia in adults in primary and secondary care. Updated edition. NICE, 2009.
12. Bird V, Premkumar P, Kendall T, Whittington C, Mitchell J, Kuipers E. Early intervention services, cognitive-behavioural therapy and family intervention in early psychosis: systematic review. Br J Psychiatry 2010;197:350-6.
13. McCrone P, Craig TK, Power P, Garety PA. Cost-effectiveness of an early intervention service for people with psychosis. Br J Psychiatry 2010;196:377-82.
14. Marshall M, Rathbone J. Early intervention for psychosis (review). Cochrane Database Syst Rev 2011;6:CD004718.
15. Higgins J, Green S. Cochrane handbook for systematic reviews of interventions version 5.0.1. Cochrane Collaboration, 2008.
16. Hedges LV. Statistical considerations. In: Cooper HM, Hedges LV, eds. The handbook of research synthesis. Russell Sage Foundation, 1994.
17. Greenland S, Robins JM. Estimation of a common effect parameter from sparse follow-updata. Biometrics 1985;41:55-68.
18. Mantel N, Haenszel W. Statistical aspects of the analysis of data from retrospective studies of disease. J Natl Cancer Inst 1959;22:719-48.
19. Higgins JP, Thompson SG. Quantifying heterogeneity in a meta-analysis. Stat Med 2002;21:1539-58.
20. Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ 2003;327:557-60.
21. Review manager (RevMan) version 5.0. Nordic Cochrane Centre, Cochrane Collaboration, 2008. 22 Atkins D, Best D, Briss PA, Eccles M, Falck-Ytter Y, Flottorp S, et al. Grading quality of evidence and strength of recommendations. BMJ 2004;328:1490.
23. Morrison AP, French P, Walford L, Lewis SW, Kilcommons A, Green J, et al. Cognitive therapy for the prevention of psychosis in people at ultra-high risk: randomised controlled trial. Br J Psychiatry 2004;185:291-7.
24. Phillips LJ, Nelson B, Yuen HP, Francey SM, Simmons M, Stanford C, et al. Randomized controlled trial of interventions for young people at ultra-high risk of psychosis: study design and baseline characteristics. Aus N Z J Psychiatry 2009;43:818-29.
25. Addington J, Epstein I, Liu L, French P, Boydell KM, Zipursky RB. A randomized controlled trial of cognitive behavioral therapy for individuals at clinical high risk of psychosis. Schizophr Res 2011;125:54-61.
26. Amminger GP, Schafer MR, Papageorgiou K, Klier CM, Cotton SM, Harrigan SM, et al. Long-chain omega-3 fatty acids for indicated prevention of psychotic disorders: a randomized, placebo-controlled trial. Arch Gen Psychiatr 2010;67:146-54.
27. McGlashan TH, Zipursky RB, Perkins D, Addington J, Miller TJ, Woods SW, et al. The PRIME North America randomized double-blind clinical trial of olanzapine versus placebo in patients at risk of being prodromally symptomatic for psychosis. I. Study rationale and design. Schizophr Res 2003;61:7-18.
28. Morrison AP, Stewart SL, French P, Bentall RP, Birchwood M, Byrne R, et al. Early detection and intervention evaluation for people at high-risk of psychosis-2 (EDIE-2): trial rationale, design and baseline characteristics. Early Interv Psychiatry 2011;5:24-32.
29. van der Gaag M, Nieman D, Rietdijk J, Dragt S, Ising-Echergui H, Klaassen R, et al. Cognitive behavioural therapy for subjects at ultra-high risk for developing psychosis: a randomised controlled clinical trial. Schizophr Bull 2012.http://schizophreniabulletin.oxfordjournals.org/content/early/2012/08/30/schbul.sbs105.full.pdf?keytype=ref&ijkey=tdJNazinP9pNhfR.
30. McGorry PD, Yung AR, Phillips LJ, Yuen HP, Francey S, Cosgrave EM, et al. Randomized controlled trial of interventions designed to reduce the risk of progression to first-episode psychosis in a clinical sample with subthreshold symptoms. Arch Gen Psychiatr 2002;59:921-8.
31. Kay SR, Fiszbein A, Opler LA. The positive and negative syndrome scale (PANSS) for schizophrenia. Schizophr Bull 1987;13:261-76.
32. Overall JE, Donald RG. The brief psychiatric rating scale. Psychol Rep 1962;10:799-812.
33. Yung AR. The comprehensive assessment of at-risk mental states (CAARMS). University of Melbourne, 2000.
34. World Health Organization. The ICD-10 classification of mental and behavioural disorders. Diagnostic criteria for research. WHO, 1993.
35. Nordentoft M, Petersen L, Jeppesen P, Thorup AA, Abel MB, Ohlenschlaeger J, et al. [OPUS: a randomised multicenter trial of integrated versus standard treatment for patients with a first-episode psychosis—secondary publication]. Ugeskrift Laeger 2006;168:381-4.
36. Hefner HBA. Early detection and intervention in psychosis. A practice handbook. Schattauer, 2011.
37. Bechdolf A, Wagner M, Ruhrmann S, Harrigan S, Putzfeld V, Pukrop R, et al. Preventing progression to first-episode psychosis in early initial prodromal states. Br J Psychiatry 2012;200:22-9.
38. Ruhrmann S, Bechdolf A, Kuhn KU, Wagner M, Schultze-Lutter F, Janssen B, et al. Acute effects of treatment for prodromal symptoms for people putatively in a late initial prodromal state of psychosis. Br J Psychiatry 2007;51(suppl):s88-95.
39. Bechdolf A, Wagner M, Veith V, Ruhrmann S, Pukrop R, Brockhaus-Dumke A, et al. Randomized controlled multicentre trial of cognitive behaviour therapy in the early initial prodromal state: effects on social adjustment post treatment. Early Interv Psychiatry 2007;1:71-8.
40. American Psychiatric Association. Diagnostic and statistical manual of mental disorders, 4th edition. American Psychiatric Association, 1994.
41. Higgins JPT, Altman DG, Gøtzsche PC, Jüni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ 2011;343:d5928.
42. Sutton AJ, Duval SJ, Tweedie RL, Abrams KR, Jones DR. Empirical assessment of effect of publication bias on meta-analyses. BMJ 2000;320:1574-7.
43. Whittington CJ, Kendall T, Fonagy P, Cottrell D, Cotgrove A, Boddington E. Selective serotonin reuptake inhibitors in childhood depression: systematic review of published versus unpublished data. Lancet 2004;363:1341-5.
44. Abbasi K. Compulsory registration of clinical trials. BMJ 2004;329:637-8.
45. Zarin DA, Ide NC, Tse T, Harlan WR, West JC, Lindberg DA. Issues in the registration of clinical trials. JAMA 2007;297:2112-20.
46. Yung AR, Nelson B. Young people at ultra high risk for psychosis: a research update.Early Interv Psychiatry 2011;5(suppl 1):52-7.
47. Fusar-Poli P, van Os J. Lost in transition: setting the psychosis threshold in prodromal research. Acta Psychiatr Scand 2012, doi:10.1111/acps.12028.
48. Marshall C, Addington J, Epstein I, Lui L, Deighton S, Zipursky RB. Treating young individuals at clinical high risk for psychosis. Early Interv Psychiatry 2012;6:60-8.
49. Hansen NB, Lambert MJ, Forman EM. The psychotherapy dose-response effect and its implications for treatment delivery services. Clin Psychol Sci Pract 2002;9:329-43.
50. Lambet M.Presidential address: what we have learned from a decade of research aimed at improving psychotherapy outcome in routine care. Psychother Res 2007;17:1-14.
51. Freeman MP, Hibbeln JR, Wisner KL, Davis JM, Mischoulon D, Peet M, et al. Omega-3 fatty acids: evidence basis for treatment and future research in psychiatry. J Clin Psychiatry 2006;67:1954-67.
52. Morrison AP, French P, Stewart SLK, Birchwoord M, Fowler D, Gumley AI, et al. Early detection and intervention evaluation for people at risk of psychosis (EDIE-2): a multisite randomised controlled trial of cognitive therapy for at risk mental states. BMJ 2012;344:e2233.
53. McGorry P. Risk syndromes, clinical staging and DSM V: new diagnostic infrastructure for early intervention in psychiatry. Schizophr Res 2010;120:49-53.
54. McGlashan TH, Zipursky RB, Perkins D, Addington J, Miller T, Woods SW, et al. Randomized, double-blind trial of olanzapine versus placebo in patients prodromally symptomatic for psychosis. Am J Psychiatry 2006;163:790-9.
55. Miller TJ, Zipursky RB, Perkins D, Addington J, Woods SW, Hawkins KA, et al. The PRIME North America randomized double-blind clinical trial of olanzapine versus placebo in patients at risk of being prodromally symptomatic for psychosis. II. Baseline characteristics of the “prodromal” sample. Schizophr Res 2003;61:19-30.
56. Woods SW, Breier A, Zipursky RB, Perkins DO, Addington J, Miller TJ, et al. Randomized trial of olanzapine versus placebo in the symptomatic acute treatment of the schizophrenic prodrome. Biol Psychiatry 2003;54:453-64.
57. Phillips LJ, McGorry PD, Yuen HP, Ward J, Donovan K, Kelly D, et al. Medium term follow-up of a randomized controlled trial of interventions for young people at ultra high risk of psychosis. Schizophr Res 2007;96:25-33.
58. Morrison AP, Bentall RP, French P, Walford L, Kilcommons A, Knight A, et al. Randomised controlled trial of early detection and cognitive therapy for preventing transition to psychosis in high-risk individuals. Study design and interim analysis of transition rate and psychological risk factors. Br J Psychiatry 2002;43(suppl):s78-84.
59. Morrison AP, French P, Parker S, Roberts M, Stevens H, Bentall RP, et al. Three-year follow-up of a randomized controlled trial of cognitive therapy for the prevention of psychosis in people at ultrahigh risk. Schizophr Bull 2007;33:682-7.
60. Yung AR, Phillips LJ, Nelson B, Francey SM, PanYuen H, Simmons MB, et al. Randomized controlled trial of interventions for young people at ultra high risk for psychosis: 6-month analysis. J Clin Psychiatry 2011;72:430-40.
61. Rietdijk J, Dragt S, Klaassen R, Ising H, Nieman D, Wunderink L, et al. A single blind randomized controlled trial of cognitive behavioural therapy in a help-seeking population with an At Risk Mental State for psychosis: the Dutch Early Detection and Intervention Evaluation (EDIE-NL) trial. Trials 2010;11:30.
62. French P, Morrison AP. Early detection and cognitive therapy for people at high risk of developing psychosis. Wiley, 2004.
63. Beck AT. Cognitive therapy and the emotional disorders. International Universities Press, 1976.
64. Morrison AP. The interpretation of intrusions in psychosis: an integrative cognitive approach to hallucinations and delusions. Behav Cogn Psychother 2001;29:257-76.
65. Zubin J, Spring B. Vulnerability: a new view of schizophrenia. J Abnorm Psychol 1977;86:103-26.
66. Chadwick P, Birchwood M, Trower P. Cognitive therapy for delusions, voices and paranoia. John Wiley and Sons, 1996.
67. Fowler D, Garety P, Kuipers E. Cognitive behaviour therapy for psychosis: theory and practice. Wiley, 1995.
68. Haddock G, Tarrier N, Spaulding W, Yusupoff L, Kinney C, McCarthy E. Individual cognitive-behavior therapy in the treatment of hallucinations and delusions: a review. Clin Psychol Rev 1998;18:821-38.
69. Kingdon DG, Turkington D. Cognitive-behavioural therapy for schizophrenia. Lawrence Erlbaum, 1994.
70. Larsen TK, Bechdolf A, Birchwood M. The concept of schizophrenia and phase specific treatment. Psychological treatment in pre-psychosis and non-responders. J Am Acad Psychoanal Dyn Psychiatr 2003;31:209-28.
71. Stein LI, Test MA. Alternative to mental hospital treatment I. Conceptual model, treatment program and clinical evaluation. Arch Gen Psychiatry 1980;31:37-42.