En febrero de 2024 se celebrará la 13ª Conferencia Ministerial de la Organización Mundial del Comercio (OMC) [1]. Se espera que los miembros de la OMC decidan si van a ampliar la Decisión Ministerial del 17 de junio de 2022 sobre el ADPIC (Acuerdo sobre los Aspectos de los Derechos de Propiedad Intelectual relacionados con el Comercio) [2], cuyo objetivo fue aumentar el acceso a las vacunas contra la covid-19, para incluir a los tratamientos y pruebas diagnósticas. El plazo límite original para tomar esta decisión era diciembre de 2022.
La Decisión Ministerial del 17 de junio refuerza los derechos de los países a utilizar las flexibilidades incluidas en el ADPIC de la OMC. También elimina, en el caso de las vacunas contra la covid-19, las restricciones a la exportación contenidas en el artículo 31 (f) del ADPIC, el cual determina que los productos que se elaboren bajo una licencia obligatoria se deben destinar predominantemente al mercado nacional. Además, aclara que un miembro puede autorizar el uso del objeto de una patente sin el consentimiento del titular por cualquier medio disponible, tanto si el miembro tiene normas para la concesión de licencias obligatorias como si no las tiene. Esto es especialmente útil para los países sin procedimientos, o con procedimientos complicados, para expedir una licencia obligatoria. La decisión también estipula que el artículo 39.3 de los ADPIC (el cual protege contra el “uso comercial injusto” de los datos de prueba necesarios para registrar un medicamento) no impide que los organismos reguladores de medicamentos emitan un permiso de comercialización de forma rápida. Actualmente, la Decisión se limita a las vacunas contra la covid-19, pero sería más útil si incluyera otros productos, especialmente los tratamientos.
Según la Organización Mundial de la Propiedad Intelectual (OMPI o World Intellectual Property Organization) [3], entre enero de 2020 y finales de septiembre de 2022 se presentaron 4.787 solicitudes de patentes para tratamientos contra la covid-19. Además, podría ser más fácil aplicar el uso efectivo de la Decisión a tratamientos y pruebas diagnósticas, ya que estos a menudo se pueden producir sin necesidad de acceder a conocimientos técnicos adicionales o a tecnología.
En las últimas semanas se han publicado dos documentos que deberían ayudar a alentar a los miembros a ampliar la decisión del 17 de junio a los tratamientos y pruebas diagnósticas.
El primer documento es el tan esperado estudio realizado por la Comisión de Comercio Internacional de EE UU (USITC o US International Trade Commission), a petición de la Representante de Comercio de EE UU, Katherine Tai, titulado: “COVID-19 Diagnostics and Therapeutics: Supply, Demand, and TRIPS Agreement Flexibilities” (“Covid-19 pruebas diagnósticas y tratamientos terapéuticos: suministro, demanda y flexibilidades del Acuerdo sobre los ADPIC”) (Inv. No. 332-596, publicación 5469 de la USITC, octubre de 2023) [4]. El segundo documento es el informe del presidente del Consejo de los ADPIC sobre la Sesión temática informal del Consejo de los ADPIC para las partes interesadas externas [5], celebrada en la OMC el 28 de septiembre de 2023.
Ninguno de los informes ofrece recomendaciones concretas de “sí o no”, pero los datos y la evidencia que presentan constituyen un argumento convincente para ampliar la Decisión a los tratamientos y pruebas diagnósticas.
El informe de la USITC, de 497 páginas, incluye informes de debates con diversas partes interesadas y una exhaustiva revisión bibliográfica. El informe describe la disparidad en el acceso y la disponibilidad de los tratamientos y pruebas diagnósticas para la covid-19: el 80% fue adquirido por países de ingresos altos, el 14% por países de ingresos medios-altos, el 5% por países de ingresos medios-bajos, mientras que los países de ingresos bajos no adquirieron nada. El informe menciona que son muchos los factores que afectan el acceso, pero pone de manifiesto que los precios altos y la falta de transparencia en los precios parecen perjudicar a muchos países que quieren acceder.
De la revisión bibliográfica que realizó la USITC se resalta lo siguiente:
“De la evidencia disponible se deduce que, en general, la protección de patentes aporta más beneficios a la innovación en el sector salud para los países desarrollados, que para los países en desarrollo. A menudo se demuestra que la protección de patentes provoca que los medicamentos suban de precio, disminuyendo el acceso, pero la protección de patentes también puede tener algunos efectos compensatorios —como, por ejemplo, el aumento de los flujos comerciales internacionales de productos farmacéuticos y la comercialización más rápida de los medicamentos— que ayudan a mejorar el acceso. Los investigadores han descubierto que las licencias obligatorias y el Banco de Patentes de Medicamentos (MPP o Medicines Patent Pool) se asocian con un incremento de la disponibilidad de genéricos y precios más bajos, y con un mayor acceso a los productos farmacéuticos. Los investigadores no han estudiado la relación entre las licencias obligatorias, el MPP y el acceso a las pruebas diagnósticas y tratamientos para la covid-19″.
La USITC alienta a que se investigue más a fondo la relación entre las licencias obligatorias, el Banco de Patentes de Medicamentos y el acceso a las pruebas diagnósticas y a los tratamientos para la covid-19.
El informe reconoce también las ventajas de las licencias obligatorias en términos de reducción de precios y aumento del acceso a los productos necesarios. El hecho de que las licencias obligatorias no cubran los conocimientos técnicos, los secretos comerciales y otras formas de propiedad intelectual puede ser un obstáculo para utilizarlas eficazmente. Esto es especialmente cierto en el caso de nuevas tecnologías complejas, como las vacunas de ARNm contra la covid-19. Sin embargo, las moléculas menos complejas —y varios tratamientos para la covid-19 entran en esa categoría— se pueden fabricar fácilmente sin tener que acceder a conocimientos adicionales. Otro de los retos mencionados es la falta de capacidad para producir genéricos. En el pasado, muchos países que han utilizado una licencia obligatoria han dependido de las importaciones. Por lo tanto, iría muy bien aplicar la exención de las restricciones a la exportación del artículo 31(f) de los ADPIC, que se incluye en la Decisión Ministerial, a los tratamientos.
También señala que, en el pasado, los países que han utilizado una licencia obligatoria se han visto sometidos a presiones políticas y comerciales por parte de países de ingresos altos (como EE UU y la Unión Europea) y de la industria farmacéutica. También expresa la esperanza de que la Decisión Ministerial de 2022 pueda ayudar a hacer frente a este tipo de presiones. Dice así:
“La implementación de la Decisión Ministerial de 2022 se ha destacado como un posible medio para reducir esta presión política y posiblemente limitar las represalias del sector farmacéutico, ya que reafirma el derecho a emitir una licencia obligatoria parecida a lo que representó la Declaración de Doha para el Acuerdo sobre los ADPIC y la salud pública” [6].
Utilizando la base de datos sobre flexibilidades de los ADPIC de Medicines Law and Policy (ML&P) [7], entre otras fuentes, el informe hace un buen trabajo al presentar la experiencia con las licencias obligatorias desde la adopción de la Declaración de Doha en 2001. Véase la ilustración.
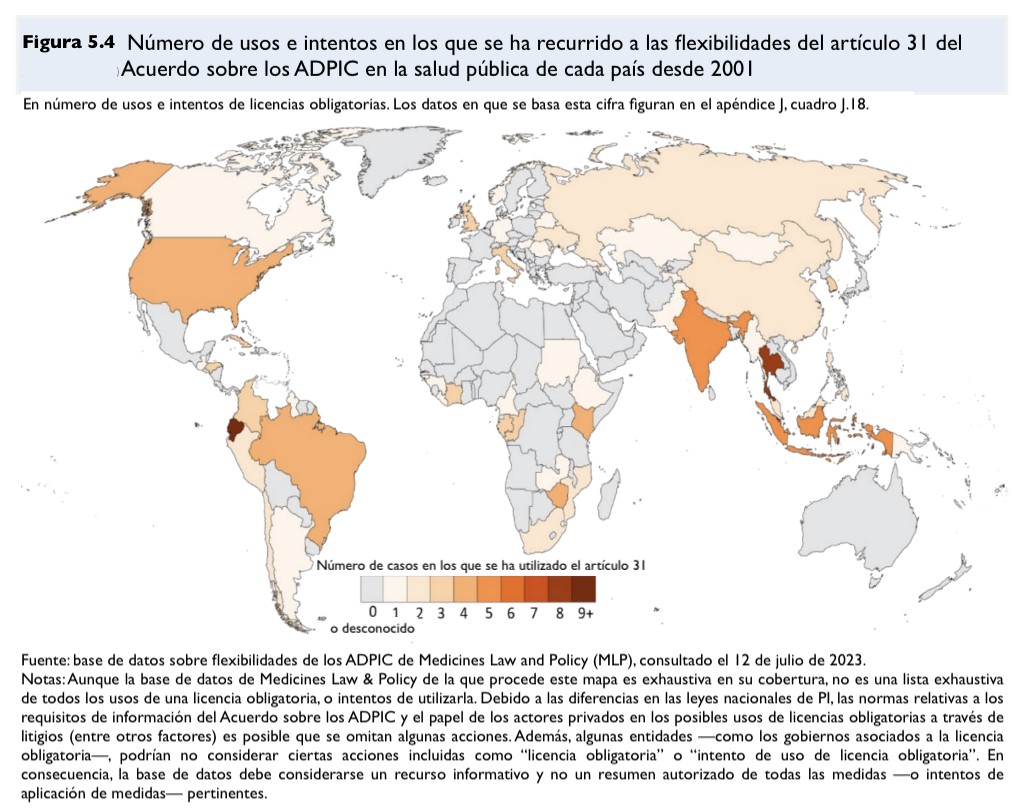
El informe ofrece una descripción exhaustiva de las licencias bilaterales voluntarias y las licencias del Banco de Patentes de Medicamentos (MPP). En ambos tipos de licencias, el titular de la patente determina en qué territorios se pueden comercializar los productos; en la práctica, esto significa que un número considerable de países de ingresos medios quedan excluidos de estos acuerdos. Sin embargo, esos países excluidos pueden recurrir a las licencias obligatorias para acceder a los productos bajo licencia. Por lo general, las licencias del MPP permiten que sus sublicenciatarios suministren a los países que han emitido una licencia obligatoria. Para más detalles, véase también el informe por países de la OMS/UNITAID [8]. Por lo tanto, las licencias obligatorias siguen siendo una opción importante, ya que la fijación de precios escalonados por parte del inventor no ofrece las mismas ventajas. El informe dice:
“En el caso de los tratamientos para la covid-19, la fijación de precios escalonados resulto, supuestamente, en precios varias veces superiores al precio [del genérico] que negoció [9] la Iniciativa Clinton para el Acceso a la Salud (Clinton Health Access Initiative)”.
La USITC ofrece una visión de los beneficios de las licencias obligatorias, en particular para los tratamientos que no requieren la transferencia de conocimientos técnicos. Aunque la USITC evita cuidadosamente adoptar una postura sobre si la Decisión del 17 de junio de 2022 se debería ampliar a los tratamientos y pruebas diagnósticas, la evidencia presentada lleva a la conclusión de que sería sensato ampliarla. Así es como la USITC resalta la cuestión:
“En la bibliografía disponible sobre el impacto que las licencias obligatorias tienen en los productos farmacéuticos, en general los investigadores han constatado que estas licencias se asocian a una disminución de los precios de los productos farmacéuticos en los países que las utilizaron. La investigación disponible también asocia las licencias obligatorias con un aumento del número de personas que pueden acceder a productos patentados. Hay alguna evidencia de que las licencias obligatorias fomentaron la innovación, aunque la bibliografía se ha centrado generalmente en la industria química en general”.
Esta conclusión de que las licencias obligatorias se asocian a precios más bajos de los medicamentos, y a un mayor acceso, está respaldada por gran parte de la evidencia presentada en la sesión temática informal del Consejo de los ADPIC para las partes interesadas externas, celebrada en la OMC el 28 de septiembre de 2023, y que se incluye en el informe del presidente que se mencionó anteriormente.
La mayoría de los 22 ponentes coincidieron en que la concesión de licencias de PI es una característica importante del sistema para mejorar el acceso a los productos médicos. En particular, aquellos productos médicos para los que el acceso a las patentes es suficiente para permitir la producción de medicamentos genéricos. Las tecnologías más complejas pueden requerir la transferencia de conocimientos adicionales o de tecnología.
Los representantes de la industria subrayaron el papel de la propiedad intelectual en la justificación de las inversiones en I+D e instaron al Consejo a no ampliar la decisión a los tratamientos y pruebas diagnósticas, con el típico argumento de que, de hacerlo, se debilitaría la capacidad de las empresas para invertir en innovación.
Esta postura no está respaldada por la evidencia, ya que la USITC señala que hay pruebas de que el uso de licencias obligatorias estimula la innovación. Incluso en el caso de enfermedades para las que se ha hecho un uso considerable de las flexibilidades de los ADPIC, no ha habido un efecto negativo en la innovación farmacéutica. Esto no es de extrañar, porque los territorios en los que se utilizan las flexibilidades de los ADPIC representan generalmente mercados en los que la industria no está presente con los productos en cuestión.
En conclusión, los dos informes ofrecen suficiente evidencia a favor de que la Decisión del 17 de junio se amplíe a los tratamientos y pruebas diagnósticas. Por lo tanto, sería sensato que los Miembros de la OMC lo hicieran. No hay motivos para seguir retrasándolo.
Nota de Salud y Fármacos. Según el informe de USITC [4], la investigación y el desarrollo de pruebas diagnósticas y terapias covid-19 se produjo principalmente en los países de altos ingresos, pero la fabricación de pruebas diagnósticas y terapias tuvo lugar en países de cualquier nivel de renta, excepto en los países de bajos ingresos. En el verano de 2023, China (ingresos medios-altos) tenía el mayor número de fabricantes de pruebas diagnósticas para la covid-19 (247), e India (ingresos medios-bajos) tenía el mayor número de fabricantes de terapias covid (56).
Thiru Balasubramaniam lamentó que el informe de USITC [4] no se pronunciara ni a favor ni en contra de la ampliación, y mencionó que en la Unión Europea se avanza hacia una excepción mucho más amplia para emergencias de salud, que no se limitará a una enfermedad o a contramedidas específicas. La política europea se centra en los derechos sobre los datos de los resultados de los estudios, incluye una medida para gestionar los conocimientos técnicos y limita las regalías al 4% del precio de los genéricos.
Referencias