Los delegados de la AMS aprobaron una resolución para mejorar la capacidad para hacer ensayos clínicos en todos los países, como aspecto central del fortalecimiento de los sistemas de salud de los países.
Los ensayos clínicos se consideran indispensables para generar pruebas de alta calidad sobre la seguridad y la eficacia de los medicamentos, las vacunas y otras intervenciones de salud, lo que es esencial para fundamentar la política de salud y la práctica clínica.
En la resolución se pide una mayor eficiencia, financiación e intercambio oportuno de datos y resultados, una mejor colaboración público-privada y una mayor coordinación, así como marcos reguladores y éticos más sólidos en los países.
En las emergencias de salud pública de importancia internacional, los delegados piden una mayor rapidez y transparencia en la realización y el intercambio de los resultados de los ensayos clínicos, salvaguardando al mismo tiempo el bienestar de los participantes en los mismos.
Puede leer el texto de la resolución en el siguiente enlace https://apps.who.int/gb/ebwha/pdf_files/WHA75/A75_ACONF9-sp.pdf
Nota de Salud y Fármacos: Ed Sullivan publicó un comentario [1] a esta resolución destacando sus objetivos de mejorar la calidad de los ensayos clínicos, fomentando la publicación puntual de los resultados completos de los estudios y diversificando el grupo de participantes. Para lograrlo hay que coordinar mejor la investigación, diseñar ensayos con buena potencia y crear mecanismos para registrar los ensayos e informar los resultados.
Esta iniciativa responde a la necesidad de generar suficientes datos fiables para informar las políticas de salud y la práctica clínica, aunque algunos defensores de los pacientes dicen que el documento final se quedó corto.
Los defensores de los pacientes afirman que el documento final no hace hincapié en la necesidad de mejorar el acceso no sólo a los resultados de los ensayos, sino a los medicamentos, pruebas diagnósticas y vacunas que pueden resultar del desarrollo de los ensayos clínicos. Con demasiada frecuencia, los patrocinadores de los ensayos no garantizan que los productos médicos probados en los países más pobres acaben estando disponibles en esos lugares, argumentan los defensores. También preocupa que la resolución no fomente la divulgación de los costes de los ensayos y de la medida en que los subsidios públicos apoyan el trabajo, ya que esto puede afectar las decisiones sobre el acceso y las negociaciones de precios.
Otra disposición que decepcionó a algunos grupos de pacientes es el papel previsto para la propia OMS. El borrador inicial sugería que la agencia de salud pública desarrollaría un plan de acción, pero la resolución que se adoptó lo sustituyó por un documento de orientación para ayudar a los países a implementar ensayos clínicos “científica y éticamente” sólidos.
Un representante de Médicos sin Fronteras se quejó de que hubo poco tiempo para revisar y debatir el lenguaje final de la resolución porque se incluyó en la discusión de las emergencias sanitarias en el último minuto y se publicó sólo un día antes de la votación final.
En proyecto DIME (Bogotá, Colombia) elaboró el siguiente infograma sobre la regulación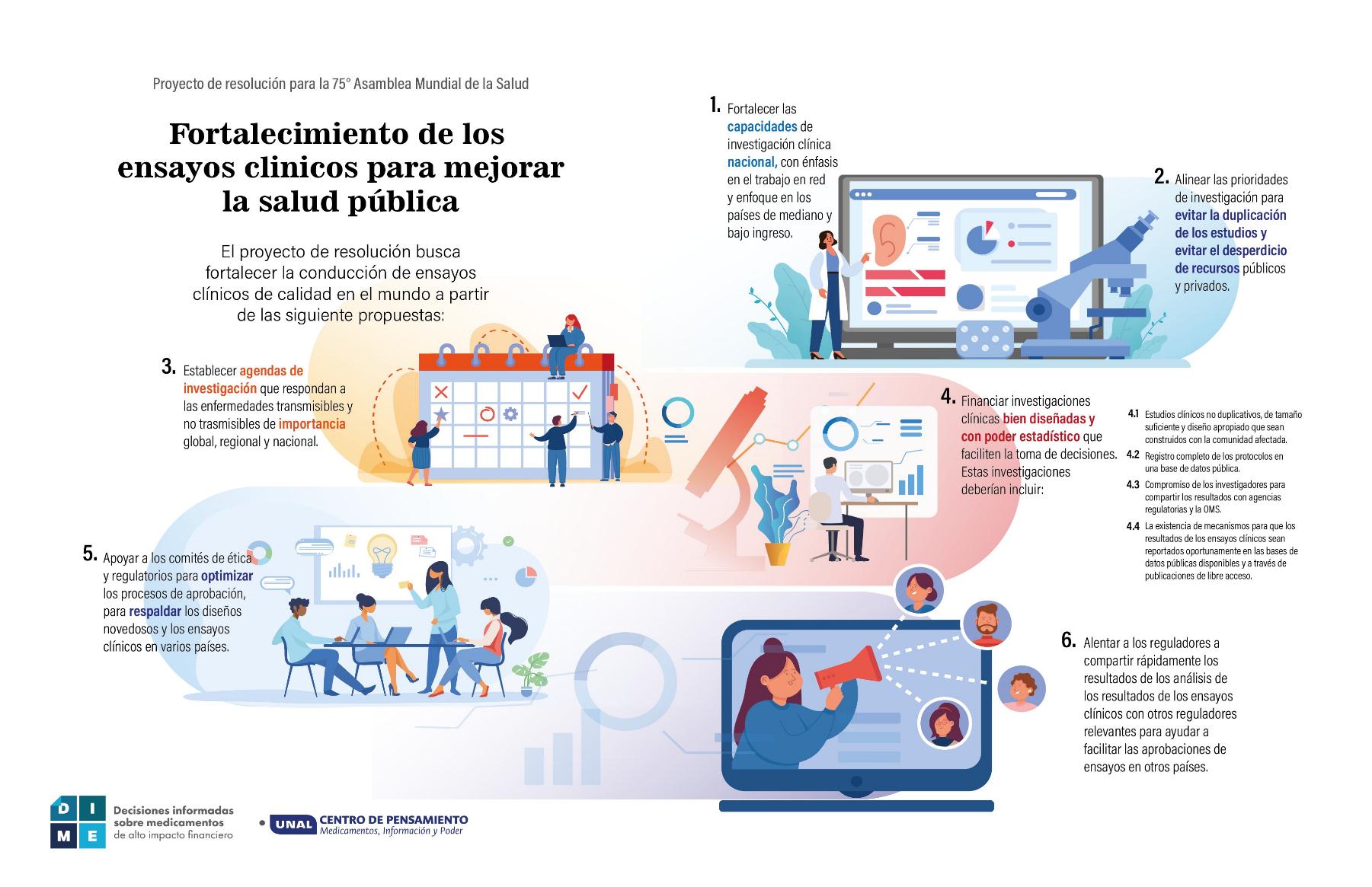
Referencia